План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Лабораторная работа № 11 “Качественные реакции анионов II группы”
5. Подведение итогов занятия
УЧЕБНЫЕ ЭЛЕМЕНТЫ ТЕМЫ
Типы комплексных соединений применяемых в аналитике
ХКС - координационные соединения металлов с одинаковыми или различными отрицательно заряженными или нейтральными полидентатными лигандами (органическими или неорганическими), имеющих один или несколько одинаковых или различных хелатных циклов.
К хелатам относятся:
1) соединения металлов с основаниями Шиффа;
2) порфирины;
3) хлорофилл;
4) гемоглобин (с Fe);
5) витамин В12;
6) инсулин (с Zn);
7) ферритин.
Частный случай ХКС – внутрикомплексные соединения (ВКС)
Внутрикомплексные соединения (ВКС) – координационные соединения металлов с одинаковыми или различными бидентатными (обычно – органическими) ацидолигандами, связанными с одним и тем же атомом металла-комплексообразователя через одну отрицательно заряженную и одну нейтральную донорные группы с образованием внутренних металлоциклов (хелатных циклов), не содержащие внешнесферных ионов и являющиеся комплексами-неэлектролитами.
Ещё один частный случай ХКС – комплексонаты металлов - используются в количественном анализе для определения катионов различных металлов.
Комплексонаты – координационные соединения металлов с анионами комплексонов – полиосновных аминокарбоновых. Анионы комплексонов обычно выступают в роли полидентатных лигандов.
трехосновная кислота, с атомом-комплексообразователем
могут участвовать атом азота и три депротонированные карбоксильные группы, при этом образуется металлоцикл.
Реакции основанные на образовании комплексных соединений.
В таких реакциях применяются циклообразующие лиганды, способные к построению хелатных комплексов, особенно - внутрикомплексных соединений и комплексонатов металлов. Молекулы подобных лигандов должны содержать функционально-аналитические группы (ФАГ), способные образовывать с атомами металлов-комплексообразователей прочные координационные связи, чаще всего – устойчивые металлоциклы.
Например, сурьма (III) дает малорастворимые белые осадки комплексов с лигандами, имеющими в качестве ФАГ две соседние фенольные группы в ароматическом ядре – пирогаллол:
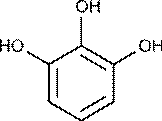
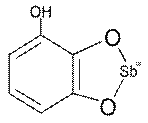
пирогаллол пятичленный металлоцикл(фрагмент более сложной молекулы)
Критерии применения внутрикомплексных соединений в аналитике.
Ø Наличие ФАГ в органической молекуле является необходимым, но не всегда достаточным условием, позволяющим использовать данные органического соединения в качестве аналитического реагента.
Ø Во многих случаях требуется присутствие аналитико-активных групп (ААГ), которые обычно не образуют координационных связей с атомом металла-комплексообразователя, но усиливают эффект ФАГ.
Основные критерии применения внутрикомплексных соединений в химическом анализе
1. малая растворимость комплексного соединения в тех случаях, когда их используют для осаждения ионов металлов из растворов;
2. наличие интенсивной характерной окраски образующихся комплексов, если их используют для открытия или определения ионов металлов по окраске раствора;
3. достаточно высокая устойчивость образующихся комплексов (большие значения констант устойчивости).
Для обеспечения этих критериев необходимо:
1. Молекулы органических реагентов должны содержать ФАГ;
2. ФАГ должны иметь такую пространственную конфигурацию, чтобы могла реализоваться возможность образования наиболее устойчивых пяти- и шестичленных металлоциклов;
3. Молекула органического лиганда должна иметь, по возможности, большую молекулярную массу – это понижает погрешности определения металлов.
Внутрикомплексные соединения (ВКС) и хелаты (ХКС) широко используется в аналитике:
1) для определения металлов;
2) при их осаждении и разделении;
3) в качестве катализаторов, красителей и пигментов;
4) основы фармакологически активных препаратов;
5) стабилизаторов вин, препятствующих их окислению;
6) для уменьшения жесткости воды и т.д.
Примерно в одной трети всех работ, публикуемых по аналитической химии, применяется ХКС или ВКС.
Групповой реагент – водный раствор AgNO3в разбавленной HNO3 (С(HNO3 = 2 моль/л) В присутствии Ag+ анионы второй группы образуют осадки, нерастворимые в воде и разбавленной азотной кислоте. Только Ag2S растворяется в HNO3 при температуре.
Все анионы второй группы в водных растворах бесцветны, их Ba-соли растворимы в воде.
Анион S2-– сильный восстановитель (легко обесцвечивает раствор I2).
Cl-, Br-, I-, CN-, SCN- - обладают более слабыми восстановительными свойствами. Они обесцвечивают раствор KMnO4 в H2SO4
- BrO3- - сильный окислитель
Реакции анионов второй аналитической группы см. в лабораторной работе.
Контрольные вопросы и задания по теме занятия
1. Какие типы комплексных соединений применяют в аналитике?
2. Что называют внутрикомплексными соединениями (ВКС)? Приведите примеры.
3. Что называют хелатами?
4. Что называют комплексонатами металлов?
5. Какой реагент используют для открытия катионов Zn2+ ? Какова его структура?
6. Какой реагент используют для открытия катионов Ni2+ ? Какова его структура?
7. Какой реагент используют для открытия катионов Co3+ ?
8. Какие ионы можно открыть с помощью дифениламина? Что при этом наблюдают?
9. Какие анионы открывает антипирин? Что при этом наблюдают?
Основная литература:
Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. Для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. Шк., 2008. – 450 – 463 ; 224 – 232 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 448 с.
2. Основы аналитической химии. Практическое руководство. Учеб. Пособие для вузов [Текст] / Под ред. Ю.А. Золотова - М.: Высш. Шк., 2001. – 87 – 94 с.
Тема 14
Дата: 2019-02-02, просмотров: 533.