В жидкой воде осуществляется протолитическое равновесие, которое называется автопротолизом воды:
Н2О + Н2О = Н3О+ + ОН- (3)
Вода – слабый электролит, поэтому за константу химического равновесия (3) можно приближенно принять концентрационную константу химического равновесия Кс, выраженную через равновесные концентрации участников реакции:
[ H 3 O + ][ OH - ]
 Кс =
Кс =
[ H 2 O ]2
и далее:
Кс [H2O]2 = [H3O+][OH-]
Кс [H2O]2 = const = Kw.
Для автопротолиза воды можно записать:
Kw = [ H 3 O + ][ OH - ] (4)
или упрощенно:
Kw = [ H + ][ OH - ]. (5)
Величина Kw, называется константа автопротолиза воды или ионное произведение воды. Она постоянно при постоянной температуре. При комнатной температуре (25 0С = 298,15К) числовое значение Kw равно:
Kw = 1,008*10-14 ≈ 10-14.
Так как числовые значения Kw очень маленькие, то вместо них принято использовать отрицательный десятичный логарифм («силовой показатель») величины Kw . При комнатной температуре
р Kw = - lg Kw = - lg 10-14 = 14. (6)
В чистой жидкой воде концентрации ионов водорода и ионов гидроксила одинаковы [H3O+] = [OH-]. Поэтому при t = 25ºC (298К) можно записать
:
[ H 3 O + ] = [ OH - ] = 10-7,
 рН = - lg [ H 3 O + ] = - lg 10-7 = 7, (7)
рН = - lg [ H 3 O + ] = - lg 10-7 = 7, (7)
pOH = - lg [OH-] = - lg 10-7 = 7
pKw = pH + pOH = 14. (8)
Таким образом, при комнатной температуре:
- в кислых водных растворах рН < 7,
- в нейтральных водных растворах рН = 7,
- в щелочных водных растворах рН > 7.
РН растворов слабых кислот

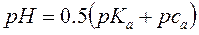 ( 9 )
( 9 )
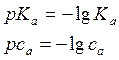
са – исходная концентрация слабой одноосновной кислоты
РН растворов слабых оснований

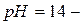
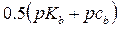 ( 10 )
( 10 )
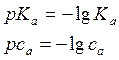
са – исходная концентрация слабой одноосновной кислоты

Kw = KaKb. (1 1 )
Ионное произведение воды К w равно произведению констант кислотности и основности сопряженной пары кислоты и основания.
Для показателя pKw получаем:

pKw = pKa + pKb . (12)
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Определите значение рН, концентрацию ионов водорода и гидроксильных групп в чистой воде (нейтральный раствор) при температуре 50°С, если ионное произведение воды при этой температуре равно Kw = 5,50·10-14. Во сколько раз изменилась концентрация ионов водорода по сравнению с комнатной температурой?
Решение:
В соответствии с уравнением ионное произведение воды Kw=[H3O+][OH-]. В рассматриваемом случае [H3O+][OH-]=5,50·10-14. Поскольку концентрации ионов гидроксония и гидроксильных групп в чистой воде одинаковы, то [H3O+]=[OH-]=(5,50·10-14)1/2 = 2,34·10-7 моль/л.
Рассчитаем рН раствора: pH = - lg [H3O+] = - lg (2,34·10-7) = 6,63.
Это значение рН соответствует нейтральной среде воды и водных растворов при 50°С.
Известно, что при комнатной температуре для чистой воды Kw = 10-14, [H3O+]=[OH-]=10-7 моль/л, рН = 7. Следовательно, при 50°С концентрация ионов водорода в чистой воде увеличилась по сравнению с их концентрацией при комнатной температуре в 2,34·10-7/10-7 = 2,34.
Задача 2
Рассчитайте концентрацию формиат-ионов HCOO- в водном растворе муравьиной кислоты HCOOH c концентрацией кислоты с(HCOOH)=0,05 моль/л. Константа кислотной диссоциации муравьиной кислоты равна 1,8·10-4.
Решение:
Муравьиная кислота как слабый электролит в водном растворе подвергается электролитической диссоциации:
HCOOH + H2O = HCOO- + H3O+
c константой кислотной диссоциации Kа=[H3O+][HCOO-]/[HCOOH]. Равновесные концентрации ионов [H3O+] и [HCOO-] одинаковы, так как при диссоциации из одной молекулы муравьиной кислоты образуются по одному иону гидроксония и формиат-иону. Равновесную концентрацию муравтиной кислоты [HCOOH] можно принять равной ее исходной концентрации с(HCOOH) в растворе, поскольку степень ионизации мала, так что число молекул муравьиной кислоты, распавшихся на ионы, намного меньше общего числа молекул муравьиной кислоты в растворе. Поэтому Kа=[HCOO-]2/c(HCOOH) или 1,8·10-4 = [HCOO-]2/0,05. Решая последнее уравнение относительно [HCOO-], получаем:
[HCOO-] = (0,05·1,84·10-4)1/2 = 3·10-3 моль/л.
Задача 3
Рассчитайте рН водного раствора, содержащего в 1 л массу m(H3BO3) = 3,0 г ортоборной кислоты H3BO3. Константа кислотной диссоциации этой кислоты по первой степени равна K1 = 7,1·10-10, pK1 = 9,15. Диссоциацией по второй и третьей стадиям – пренебречь.
Решение:
Ортоборная кислота H3BO3 в водном растворе на первой стадии диссоциации распадается на ионы по схеме:
H3BO3 + H2O = H3O+ + H2BO3-
c константой кислотности K1 = [H3O+][H2BO3-]/[H3BO3]. В соответствии с уравнением можно записать для данного случая: рН=0,5[pK1 +pc(H3BO3)], где с(H3BO3) – исходная концентрация раствора ортоборной кислоты, выраженная в моль/л. Рассчитаем с(H3BO3). Очевидно с(H3BO3) = m(H3BO3)/M(H3BO3)=3,0/61,833=0,049 моль/л, где M(H3BO3) = 61,833 – молярная масса ортоборной кислоты.
Вычислим теперь рН раствора:
рН=0,5(9,15 – lg 0,049) = 5,23
Задача 4
Рассчитайте рН водного раствора пиридина С5H5N с концентрацией с(С5H5N)=0,20 моль/л. Константа основности пиридина равна Kb = 1,5·10-9, pKb=8,82.
Решение:
В водном растворе пиридина устанавливается равновесие с образованием катиона пиридиния С5H5NH+:
С5H5N + H2O = С5H5NH+ + OH-
Концентрационная константа этого равновесия выражается формулой Kb = [С5H5NH+][OH-]/[С5H5N]. Пиридин – однокислотное основание, поэтому в соответствии с выражением можно записать:
pH=14-0,5[pKb + pc(С5H5N)]=14-0,5(8,82 – lg0,20) = 9,2
Задачи для самостоятельной работы
1. Ионное произведение воды при 90º С равно Kw = 38,0 · 10-14. Рассчитайте концентрацию ионов водорода и pH чистой воды при этой температуре.
Ответ: 6,17 · 10-7 и 6,21.
2. Рассчитайте концентрацию ионов аммония NH4+, степень ионизации аммиака и значение pH в водном растворе аммиака с концентрацией c(NH3) = 0,020 моль/л. Константа основности аммиака Kb = 1,76 – 10-5, pKb = 4,76. Ответ: 5,9 · 10-4; 0,03; 10,8.
3. Рассчитайте значение pH 3,0%-го водного раствора пероксида водорода H2O2. Плотность раствора принять равной 1г/см3. Константа кислотной диссоциации пероксида водорода Ka = 2,0 · 10-12, pKa = 1,70. Ответ: 5,88.
4. Рассчитайте pH водного раствора метиламина CH3NH2 с концентрацией с(CH3NH2) = 0,12 моль/л. Константа основности метиламина Kb = 4,6 · 10-3; pKb = 3,34. Ответ: 11,87.
Контрольные вопросы и задания по теме занятия
1. Что называют кислотой и основанием согласно протолитической теории?
2. Что называют протолитическими реакциями и реакциями протолиза?
3. Что называют амфолитами?
4. Что называют кислотой и основанием согласно теории Льюиса?
5. Как записать уравнение автопротолиза воды? Что называют константой автопротолиза воды? Чему равно её численное значение? Что называют силовым показателем?
6. Что называют константой кислотной диссоциации (константой кислотности) слабой одноосновной кислоты?
7. Что называют полной константой кислотной диссоциации?
8. Как рассчитать pH раствора слабой кислоты (вывод формулы)?
9. Что называют константой диссоциации слабого однокислотного основания (константой основности)?
10. Как рассчитать pH раствора слабого основания (вывод формулы)?
11. Чему равно ионное произведение воды?
12. Как протекают качественные реакции катионов IV группы Sn2+ , Sn4+ , Cr3+?
Основная литература:
1. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. шк., 2008. – 110 – 125 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 311 – 329 с.
Тема 8
Дата: 2019-02-02, просмотров: 628.