При использовании аналитических реакций, основанных на образовании осадков, первостепенное значение имеет полнота осаждения вещества из раствора. Обычно добиваются такой полноты осаждения, чтобы остаточное содержание в растворе осаждаемого вещества не превышало ~ 10-6 моль/л.
В таких случаях осаждение обычно считают полным для веществ, обладающих не слишком большой молекулярной массой.
Полнота осаждения осадков и их растворимость (а также и чистота) зависят от ряда факторов, важнейшим из которых являются: 1) природа осаждаемого вещества, осадителя, растворителя; 2) концентрация реагентов; 3) температура; 4) рН среды; 5) присутствие посторонних веществ, как имеющих, так и не имеющих одноименные ионы с осадком; 6) условия осаждения (быстрое или медленное образование осадка, осаждение из разбавленных или концентрированных растворов, при перемешивании или без перемешивания и т.д.); 7) характер образующегося осадка (аморфный, кристаллический, мелкозернистый, крупнозернистый, рыхлый, плотный и т.п.); 8) возможность протекания побочных реакций; 9) продолжительность выдерживания осадка с маточником.
Большую роль при осаждении или растворении осадка играет рН среды, особенно тогда, когда осаждаемое вещество обладает выраженными кислотно-основными свойствами и вступает в реакции с кислотами или основаниями. Так, например, малорастворимые в чистой воде гидроксиды или карбонаты ряда металлов при понижении рН раствора (т.е. при действии кислот) растворяются.
Фактически в таких случаях речь идет не о физическом растворении осадков, а об их химических реакциях с кислотами или основаниями, приводящих к образованию новых продуктов реакции. К аналогичным результатам приводят и реакции комплексообразования, например, упоминавшаяся выше реакция растворения иодида ртути (II) HgI2 в присутствии избытка иодид-ионов I-.
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Как изменится молярная растворимость йодида серебра, если в его насыщенный водный раствор прибавить Ba(NO3)2(к) до c(Ba(NO3)2) = 0.017 моль/л; Ks0 (AgI) = 8.3·10-17
Решение:
1. В чистой воде AgI→Ag+ + I-
Ks0 (AgI) = S2
S1 = √ Ks0 = √8.3·10-17 = 9.11·10-9
2. В присутствии индиферентного электролита
Ks0 = fAg+ · fI- = [Ag+]·[I-] = f2 · S2
Величина f определяется, исходя из значения ионной силы:
I(Ba(NO3)2) = 0.5(0.017·22 + 0.017·2) = 0.5·0.102 = 0.051
см.табл. №3.1 стр.66
z=1; I=0.05; f = 0.84
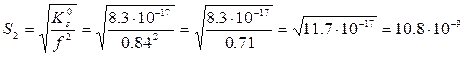
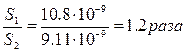
S2>S1
Индиферентный электролит повысил растворимость в 1,2 раза.
Задачи для самостоятельной работы
1. Рассчитайте молярную растворимость бромида серебра AgBr в водном растворе бромида стронция SrBr2 с концентрацией с(SrBr2) = 0,01 моль/л без учёта и с учётом влияния ионной силы раствора. Произведение растворимости бромида серебра равно 5,3 · 10-13. Ответ: 2,6 · 10-12 моль/л; 3,8 · 10-11 моль/л.
2. Как изменится растворимость иодата свинца Pb(IO3)2, если к его насыщенному водному раствору прибавить иодат натрия NaIO3, до концентрации с(NaIO3) = 2,0 · 10-4 моль/л? Произведение растворимости иодата свинца равно 2,6 · 10-13. Ответ: уменьшится в 6,2 раза.
3. Как изменится молярная растворимость иодита серебра AgI, если в его насыщенный водный раствор прибавить нитрат бария Ba(NO3)2 до концентрации с[Ba(NO3)2] = 0,017 моль/л? Произведение растворимости иодида серебра равно 8,3 · 10-17. Ответ: увеличится в 1,2 раза.
4. Водный раствор содержит ионы кальция Ca2+ и бария Ba2+, концентрации которых равны: с(Ca2+) = 0,01 моль/л и C(Ba2+) = 0,1 моль/л. К этому раствору медленно прибавляют оксалат аммония (NH4)2C2O4. Какой из катионов будет осаждаться из раствора первым? Произведения растворимости оксалатов кальция и бария равны 2,3 · 10-9 и 1,1 · 10-7 соответственно. Ответ: катион кальция будет осаждаться из раствора первым.
Контрольные вопросы и задания по теме занятия
1. Как влияет добавление посторонних электролитов на растворимость малорастворимых электролитов?
а) Как влияет добавление электролита с одноименным ионом?
б) Как влияет добавление постороннего электролита?
2. Какие факторы влияют на полноту осаждения осадков?
3. В чем заключаются качественные реакции катионов IV аналитической группы?
4. Какие существуют аналитические классификации катионов по группам?
Основная литература:
Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. шк., 2008. – 97 – 109 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 17 – 48 с., 170 c., 457 – 460 с.
Тема 7
Дата: 2019-02-02, просмотров: 2403.