Более общей, по сравнению с Еак, является ΔGак – энергия Гиббса активации. Эта величина вводится в рассмотрение во второй теории – теории активированного комплекса, разработанной Эйрингом.
1. Пусть опять речь идет о бисубстратной реакции. Согласно рассматриваемой теории, реакция проходит в две стадии:
 |
а) Первая стадия – обратимая; при этом те молекулы, которые обладают достаточной энергией, образуют активный комплекс.
Энергия данного превращения – это и есть энергия Гиббса активации.
 |
Причём, как и для всякой другой обратимой реакции, стандартное значение этой энергии связано с константой равновесия формулой вида (4.35):
 |
б) Вторая стадия процесса (18.30) – необратимый распад активированного комплекса на продукты; скоростью этого распада и определяется скорость реакции:
2. а) Обычно считается, что скорость второй стадии относительно невелика (по сравнению со скоростями прямой и обратной реакций первой стадии), так что на первой стадии практически успевает установиться равновесие.
 |
б) Тогда можно выразить концентрацию активированного комплекса через концентрации исходных реагентов:
 |
и подстановка в (18.32) даёт:
 |
в) Сопоставление последней формулы с уравнением скорости исходной реакции
 |
приводит к заключению:
Как видно, оно состоит в том, что константа скорости рассматриваемой реакции равна произведению соответствующих констант, характеризующих промежуточные стадии.
3. а) При этом 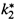 — это, по сути дела, частота распада возбужденных комплексов с образованием продуктов — в расчете на 1 появляющийся комплекс (тогда это число комплексов, которые при такой частоте распались бы за 1 с), или в расчете на 1 моль комплексов (тогда это количество молей, распавшихся бы за 1 с).
— это, по сути дела, частота распада возбужденных комплексов с образованием продуктов — в расчете на 1 появляющийся комплекс (тогда это число комплексов, которые при такой частоте распались бы за 1 с), или в расчете на 1 моль комплексов (тогда это количество молей, распавшихся бы за 1 с).
б) Поскольку в комплексе соответствующая связь уже полностью готова к разрыву, она разорвется при первом же колебании, имеющем среднюю для данной температуры энергию. Следовательно, 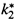 совпадает с частотой колебаний:
совпадает с частотой колебаний:
 |
 |
в) Данную частоту можно найти, если считать, что колебательная энергия комплекса равна его потенциальной энергии:
 |
г) Тогда
 |
Здесь фигурируют постоянные Больцмана (kБ) и Планка (h); вспомним их значения:
 |
д) Подставляя их в (18.36, б), можно найти:
е) Отсюда следует, что образовавшийся комплекс перед превращением в продукт существует в среднем около
 |
4. а) Подставим выражения для констант
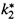 (18.36,б) и
(18.36,б) и 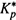 (18.31,б) в соотношение (18.34,б). Это дает формулу Эйринга:
(18.31,б) в соотношение (18.34,б). Это дает формулу Эйринга:
б) Она тоже (как и уравнение Аррениуса в предыдущей теории) вскрывает природу константы скорости и устанавливает ее зависимость от температуры.
в) Нетрудно убедиться: с точки зрения размерности эта формула верна лишь
для реакций первого порядка (где [k] = l/с). Для реакций же других порядков
в формулу Эйринга необходимо вводить дополнительный размерный множитель.
Например, в случае реакций второго порядка, где [k] = l/М·с (табл. 16.3), это
 |
множитель l/М:
Анализ уравнения Эйринга
 |
1. а) Как и любая энергия Гиббса, энергия Гиббса активации выражается через энтальпию активации и энтропию активации:
б) Заметим: в результате образования комплекса упорядоченность расположения частиц повышается, так что энтропия снижается.
в) А теплота, в расчете на моль реагирующих частиц, поглощается (поскольку активный комплекс обладает повышенной внутренней энергией).
 |
г) Следовательно, знаки величин таковы:
 |
2. Подстановка (18.42) в формулу Эйринга (18.40) дает:
а) Получается, что температура теперь входит не только в показатель экспоненты (как в уравнении Аррениуса), но и в предэкспоненциальный множитель.
б) И действительно, нагревание оказывает двоякое действие:
- во-первых, по принципу Ле-Шателье, она сдвигает равновесие первой (эндотермической) стадии процесса в сторону образования активированного комплекса,
- во-вторых, ускоряет распад этого комплекса.
 |
 в) В итоге получается важное отличие от формулы Аррениуса: при высоких температурах — не стремление k к некоему пределу, а неограниченный рост (рис. 18.8):
в) В итоге получается важное отличие от формулы Аррениуса: при высоких температурах — не стремление k к некоему пределу, а неограниченный рост (рис. 18.8):
3. Какая же зависимость более правильная — по уравнению Аррениуса или по формуле Эйринга?
а) При относительно небольших температурах более точной, видимо, является формула Эйринга.
б) А при высоких температурах она перестает быть справедливой: рост константы скорости ограничивается тем или иным уровнем.
4. Наконец, установим связь величины 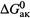 (или ее компонентов) с энергией активации по Аррениусу (Eак).
(или ее компонентов) с энергией активации по Аррениусу (Eак).
 |
а) Для этого выразим константу скорости двумя способами — через уравнение Аррениуса и через формулу Эйринга:
 |
б) Прологарифмируем оба выражения:
в) И, чтобы освободиться от разных констант (А и В), продифференцируем обе части равенства по T:
 |
 |
г) Отсюда и следует искомая связь:
д) Как видно, энергия активации по Аррениусу почти совпадает с энтальпией
(или теплотой) активации.
Таким образом, энергия Гиббса активации — более общее понятие: кроме энтальпии активации, она учитывает и изменение энтропии при активации.
е) Заметим: более точные расчеты показывают, что для бимолекулярной ре-
акции поправка в формуле (18.49) равна не RT, а 2RT.
Краткое содержание главы 18
В главе была рассмотрена ПРИРОДА КОНСТАНТЫ СКОРОСТИ.
1. ТЕОРИЯ АКТИВНЫХ СТОЛКНОВЕНИЙ исходит из следующего.
а) Молекулы вещества различаются по абсолютной скорости, образуя так называемое РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА, из которого вытекает распределение и по КИНЕТИЧЕСКОЙ ЭНЕРГИИ.
б) В реакцию же могут вступать лишь молекулы с энергией выше некоего барьерного уровня (Еб).
в) Разность между этим уровнем и средней энергией молекул вещества – ЭНЕРГИЯ АКТИВАЦИИ по Аррениусу: Еак = Еб – Еср .
г) Доля реакционноактивных молекул с ростом Еак убывает по экспоненте (ЗАКОН БОЛЬЦМАНА).
д) Кроме того, теория учитывает частоту столкновений молекул друг с другом, необходимость их правильной ориентации и ряд других факторов.
 |
е) Это приводит к УРАВНЕНИЮ АРРЕНИУСА:
ж) Согласно ему, с ростом Т константа k растёт тоже, стремясь к предельному уровню А. Причём, если 50 < Eак < 100 кДж /моль, то при увеличении Т на 10 градусов k возрастает в 2–4 раза (ПРАВИЛО ВАНТ-ГОФФА).
 |
з) Логарифмическая форма уравнения описывает линейную зависимость lnk от 1/ T. Из неё следует: определив k при двух температурах, можно оценить и Еак , исходя из уравнения:
2. а) В ТЕОРИИ же ЭЙРИНГА считается, что молекулы, обладающие достаточной энергией, образуют вначале АКТИВНЫЙ КОМПЛЕКС.
 |
б) Расчет приводит к ФОРМУЛЕ ЭЙРИНГА:
в) Эта формула описывает БЕСПРЕДЕЛЬНЫЙ рост k при нагревании. Она предпочтительней при не очень больших температурах.
 |
г) Энергии активации двух уравнений связаны соотношением:
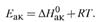
Глава 19. КИНЕТИКА СЛОЖНЫХ ПРОЦЕССОВ
 |
В данной главе будет рассмотрена формальная кинетика сложных процессов, под которыми понимают процессы, содержащие более одной стадии. Вообще говоря, один вид таких процессов мы уже обсуждали в п. 17.2, где речь шла об обратимых реакциях первого порядка
Их можно представить как двустадийные процессы:
 |
Теперь рассмотрим еще несколько видов сложных (в основном, двустадийных) процессов.
Дата: 2019-02-02, просмотров: 391.