а) Первый фактор – специфика реакции – количественно отражается в энергии активации. В качестве последней используют две несколько отличающиеся величины:
- ΔGак – энергию Гиббса активации и
- Еак – энергию активации по Аррениусу, или просто энергию активации.
б) В трактовке обеих величин ключевую роль играет представление о том, что молекулы одного и того же вещества существенно различаются по энергии.
в) Поэтому рассмотрим вначале, как образуется такое распределение. Для простоты будем пока иметь в виду лишь кинетическую энергию молекул.
1. Распределение по проекциям скорости на направление. Мгновенную скорость (u) любой молекулы можно разложить на составляющие по направлениям – ux, uy, uz .
Так вот, прежде всего молекулы различаются по проекциям своей скорости на каждое направление; причём эти проекции постоянно меняются. Тем не менее общий характер распределения проекций остаётся постоянным и характеризуется двумя функциями.
а) F ( ux ) – интегральная функция распределения, т.е. вероятность того, что проекция скорости – не более значения ux. Очевидно, с ростом аргумента ux указанная вероятность возрастает от 0 до 1 (рис. 18.1,а).
 |
 б) Но обычно рассматривают не саму функцию F(ux), а её производную – плотность вероятности:
б) Но обычно рассматривают не саму функцию F(ux), а её производную – плотность вероятности:
Очевидно, ω(ux)∙dux – вероятность того, что проекция скорости про-извольной молекулы изуча-емой системы лежит в интервале dux, примыкаю-щем к точке ux.
I . Распределение проекций их является нормальным. Это значит, что оно
описывается следующей формулой:
 |
 |
II . Центр этого распределения — в нуле (рис. 18.1, б). Действительно, так как частицы с равной вероятностью могут двигаться в обоих направлениях оси х, то
средняя скорость по этой оси равна нулю. Величина
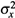 — среднеквадратичное
— среднеквадратичноеотклонение. Можно доказать, что
где М — молярная масса вещества.
2. Распределение частиц по абсолютной скорости (распределение Максвелла). А как найти распределение частиц по абсолютной скорости и?

 |
а) Величина ω(ux,uy,uz) — это плотность вероятности того, что проекции скорости частицы равны ux,uy,uz (рис. 18.2). Она получается путем перемножения выражений вида (18.2):
 |
б) Но некоторое значение скорости и может складываться из большого множества различных комбинаций значений ux,uy и uz. Величина этого множества определяется (в пространстве скоростей) площадью сферы радиуса и, равной 4πu 2. Учитывая это, приходим к распределению частиц по абсолютной скорости:
 |
в) Подставим сюда формулы (18.2)—(18.4), учитывая 3 обстоятельства:
В последнем соотношении N — число частиц, а N0 — общее количество частиц. С помощью этого соотношения переходим от плотности вероятности к числу частиц, имеющих определенную скорость (точнее, к производной числа частиц по скорости).
г) В итоге получаем распределение Максвелла — распределение числа частиц по абсолютной скорости:

 |
В отличие от нормального распределения, здесь (рис.18.3) максимум распределения и средняя арифметическая скорость находятся не в нуле, а имеют положительные значения, которые, как можно доказать, таковы:

Ещё больше по величине значение среднеквадратичной скорости:
 |
3. Распределение частиц по кинетической энергии.
 |
а) Наконец, перейдём к распределению частиц по кинетической энергии. Для этого учтём следующее:

 б) Отсюда
б) Отсюда
в) Данное распределение похоже на предыдущее, но является более пологим (рис. 18.4), т.к. и степенная, и экспоненциальная зависимости здесь уже не такие сильные.
г) Исходя из формулы (18.10) или формулы (18.8,в), можно придти к известному выражению (1.2,а) для средней кинетической энергии идеального газа или идеального раствора (в расчёте на 1 моль вещества):
 |
В частности, для 298 К получаем: Екср ≈ 3,7 кДж/моль.
Дата: 2019-02-02, просмотров: 370.