Такие реакции могут быть одно- и двусубстратными.
1. Односубстратные реакции.
 |
а-б) В этом случае реагируют две молекулы одного вещества:
Записано и дифференциальное уравнение скорости (где с — концентрация
вещества А). Теперь скорость зависит уже от второй степени концентрации.
в) I . Разделяем переменные и интегрируем:
 |
 |
II. Из начального условия (при t = 0 с = с0) следует:
 |
III . Отсюда — линейная форма интегрального уравнения:
т.е. здесь зависимость является линейной в координатах время — обратная концентрация.
 |
г) Поскольку сама концентрация со временем убывает, то обратная величина
увеличивается (рис. 17.5). В явном же виде зависимость c ( t ), как нетрудно
найти, такова:
 |
 |
По сравнению с экспоненциальным снижением концентрации в реакциях
первого порядка, здесь уменьшение концентрации (при том же численном
значении k) происходит более плавно (рис. 17.6).
д) Период полупревращения —
Как видим, этот период зависит от того, какую концентрацию вещества А
мы выбираем за начальную: чем меньше концентрация, тем больше период
полупревращения.
 |
2. Двусубстратные реакции:
а) Если начальные концентрации реагентов одинаковы ( 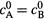 ), то, очевидно, в любой момент будут равны и текущие концентрации веществ (cA = cB). Тогда уравнение скорости сводится к предыдущему (17.22,б). И мы получим для концентрации каждого из двух реагентов те же самые формулы (17.25—17.26).
), то, очевидно, в любой момент будут равны и текущие концентрации веществ (cA = cB). Тогда уравнение скорости сводится к предыдущему (17.22,б). И мы получим для концентрации каждого из двух реагентов те же самые формулы (17.25—17.26).
б) В общем же случае начальные концентрации различны. Но убыль обоих веществ за некоторое произвольное время одинакова.
I . Поэтому можно выразить cB через cA и через начальные концентрации (считающиеся известными):
 |
 |
II. Подставляя в (17.28,б), получаем дифференциальное уравнение относительно cA:
 |
III . Для его решения надо сделать замену:
 |
откуда
IV . Подстановка в уравнение (17.30) дает:
 |
 |
или
V . Получили уравнение, аналогичное уравнению (17.13, г). Соответственно, решение тождественно формуле (17.16):
 |
 |
VI . Тогда для обратной величины (концентрации вещества А) приходим, с учетом вида а и b , к такому выражению:
 |
или
 в) Пусть, для определенности,
в) Пусть, для определенности, 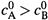 . Тогда экспонента в знаменателе формулы (17.35) — убывающая, и
. Тогда экспонента в знаменателе формулы (17.35) — убывающая, и

I . Следовательно, данная формула описывает убывание концентрации вещества А до того, пока не
израсходуется вещество В (рис. 17.7). Такой график
был приведен в п. 16.4 (рис. 16.1,б). Теперь получена
конкретная математическая формула, описывающая ход кривой. .
II . Нетрудно убедиться, что падение концентрации второго вещества (В) будет описываться в этом случае ( 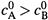 ) параллельной кривой, лежащей ниже первой на расстоянии
) параллельной кривой, лежащей ниже первой на расстоянии 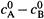 и потому стремящейся к нулю.
и потому стремящейся к нулю.
 |
г) Период полупревращения в том же случае (
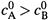 ) находим, полагая в левой части формулы (17.35), что
) находим, полагая в левой части формулы (17.35), что
Решая уравнение относительно времени, находим:
 |
Одновременно это период полуисчезновения вещества В.
Дата: 2019-02-02, просмотров: 324.