1. Для использования формул Нернста необходимо знать не только активности (концентрации) участников, но и стандартные значения потенциалов.
а) В принципе, исходя из физического определения потенциала (как работы по перемещению единичного положительного заряда из бесконечности в данную точку поля), можно было бы найти абсолютные значения стандартных потенциалов.
 |
б) Но принято исчислять их не в абсолютных значениях, а относительно стандартного потенциала водородного электрода, который (потенциал) принимается за ноль:
 |
2. а) На данном электроде (рис. 14.4) в ту или иную сторону происходит полуреакция:
 т.е. окислительно-восстановительную пару образуют протоны и молекулярный водород.
т.е. окислительно-восстановительную пару образуют протоны и молекулярный водород.
б) При этом молекулярный водород подводится в газообразном виде, а собственно электродом (в узком смысле) является платиновая пластинка, опущенная в кислый раствор.
в) Стандартным (т.е. нулевым) потенциал этого электрода считается при условиях:
 |
3. а) Таким образом, чтобы определить стандартный потенциал какой-либо окислительно-восстановительной пары (Oxι/Rdι) по водородной шкале, надо составить гальванический элемент из водородного электрода и исследуемого полуэлемента (электрода) со стандартными активностями компонентов.
б) Тогда создаваемая ЭДС просто равна искомому потенциалу, если пара Oxι/Rdι играет в реакции с водородной парой роль окислителя:
 |
 |
в) Если же, наоборот, данная пара выступает в качестве восстановителя, её
потенциал равен измеренной ЭДС, взятой с обратным знаком:
4. а) Электродные потенциалы, измеренные относительно стандартного водородного полуэлемента, называются редокс-потенциалами. Поскольку другой
шкалой измерения обычно не пользуются, то понятия «электродные потенциалы» и «редокс-потенциалы» часто совпадают.
б) Итак, редокс-потенциалы характеризуют окислительно-восстановительные
свойства соответствующей пары по сравнению со свойствами пары H+/H2
(в стандартных условиях).
 |
в) Стандартные редокс-потенциалы некоторых окислительно-восстановительных пар приведены в табл. 14.1.
5. а) При отрицательных значениях редокс-потенциала сродство ОВ-пары к электронам меньше, чем у водородной пары. Действительно, это соответствует
уравнению (14.30), в котором пара Oxι/Rdι выступает в качестве восстановителя, т.е. отдает электроны водородной паре.
б) При положительных же значениях Ψ0(Oxι/Rdι), напротив, сродство ОВ-пары к электронам выше, чем у пары H+/H2.
Примеры расчета ЭДС для элемента Даниэля-Якоби
Продемонстрируем использование полученных формул на примере элемента Даниэля–Якоби.
1. Стандартные условия.
 |
а) Применим формулу (14.10), учитывая (14.15) и табл. 14.1:
Очевидно, таким же будет значение ЭДС при любых, но равных, активностях ионов Cu2+ и Zn2+ в полуэлементах.
б) Зная же 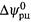 , по формуле (14.17,б) нетрудно найти стандартную энергию Гиббса реакции:
, по формуле (14.17,б) нетрудно найти стандартную энергию Гиббса реакции:
 |
Результат совпадает с полученной иным способом оценкой (14.4,б).
2. Теперь пусть а(Cu2+) = 0,01 М, а(Zn2+) =0,1 М.
 |
а) Здесь для каждого потенциала следует применить уравнение Нернста (Петерса). Используем его адаптированный вариант (14.26):
 |
 |
б) Можно рассчитать ЭДС и минуя предварительную оценку потенциалов. Для этого достаточно использовать уравнение Нернста, относящееся непосредственно к ЭДС (14.17,а):
По такому же принципу проводятся расчеты и во многих других случаях.
Кажущиеся потенциалы
1. а) Если в соответствующей ОВР участвуют протоны (в качестве реагентов
или продуктов), то, как было отмечено для водородного электрода (14.28,б),
стандартное значение ЭДС или отдельного потенциала относится к рН = 0.
б) Более же интересны для биолога так называемые кажущиеся потенциалы — Ψ i ', которые относятся к рН = 7,0 (и единичным активностям всех прочих,
кроме протонов, реагентов).
2. а) Оценить эти значения можно, вновь исходя из стандартных значений и снова используя уравнение Нернста, – но на этот раз вариант (14.23,б) данного уравнения (с учётом формулы (14.24)).
 |
б) Приведем кажущиеся редокс-потенциалы некоторых ОВ пар (табл. 14.2).
 |
в) Например, для водородного полуэлемента получаем:
г) Если обратиться к последней ОВ-паре табл.14.2, то нетрудно видеть, что для неё кажущееся значение потенциала меньше стандартного (1,223 В; см. табл. 14.1) на те же 0,413 В, что и для водородной пары.
Расчеты производятся так же, как и в случае стандартных потенциалов.
Дата: 2019-02-02, просмотров: 329.