1. а) Обратим внимание на знаки: для самопроизвольной реакции (т.е. реакции, идущей в прямом направлении)
 |
Положительный знак ∆ψрц означает, что работа по перемещению единичного положительного заряда от электрода 1 к электроду 2 совершалась бы над системой (п. 1.4); следовательно, перенос отрицательного заряда (каковыми являются электроны) происходит в указанном направлении самой системой.
б) Отсюда вытекает следующая расстановка индексов в записи
 |
1 — восстановитель (донор электронов),
2 — окислитель (акцептор электронов).
в) Соответственно,
Ψ1 — электрический потенциал катода (–): здесь — избыток электронов;
Ψ2 — электрический потенциал анода (+), на котором — дефицит электронов.
 |
2. а) Следовательно, обобщенную ОВР, за счет которой генерируется ЭДС в
гальваническом элементе, следует записать в виде
где фигурируют две окислительно-восстановительные пары (ОВ-пары):
- пара 1 (Ox1/Rd1) — служит в реакции восстановителем и образует катод,
- и пара 2 (Ox2/Rd2) — служит окислителем и образует анод.
б) Заметим: в записи отдельной окислительно-восстановительной пары первой указывается окисленная форма.
3. В результате, например, для элемента Даниэля—Якоби (рис. 14.1 и (14.5))
необходимо полагать:
 |
поскольку в происходящей в этом элементе реакции первая из указанных пар
является восстановителем, а вторая — окислителем.
14.8. Зависимость ∆Ψрц от концентраций участников ОВР
И от температуры
1. Зависимость от концентраций.
а) Вспомним уравнение изотермы реакции:
 |
 |
которое определяет зависимость энергии Гиббса от концентраций (активностей) участников. Здесь ΔG °рц – стандартное значение этой энергии; оно соответствует реакции при постоянных одномолярных концентрациях всех реагентов и продуктов. А Па – произведение активностей, которое для обобщённой ОВР вида (14.14) равно:

б) Подставим (8.35,б) в формулу (14.12,б). Тогда получаем уравнение Нернста:
де
u
Здесь 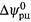 — стандартная ЭДС реакции {стандартный электрический потенциал реакции). Эта величина, как и ΔG °рц, соответствует ситуации, когда в полуэлементах поддерживаются одномолярные активности всех участников.
— стандартная ЭДС реакции {стандартный электрический потенциал реакции). Эта величина, как и ΔG °рц, соответствует ситуации, когда в полуэлементах поддерживаются одномолярные активности всех участников.
в) Вместе с тем, благодаря соотношению (4.35), стандартная ЭДС реакции просто связана с константой равновесия той же реакции (14.17,в).
г) Итак, уравнение Нернста (14.17,а) устанавливает зависимость ЭДС гальванического элемента от концентраций (активностей) участников ОВР.
Конкретно: чем меньше Па, тем больше генерируемая ЭДС. Важно отметить, что при этом учитываются активности веществ в обоих полуэлементах.
2. Зависимость от температуры.
а) А здесь воспользуемся формулой (5.13, а)
 |
которая следует из соотношения
 |
при условии, что энтальпия и энтропия реакции практически не зависят от
температуры. Подстановка (14.17,б) дает:
б) Производная 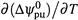 называется температурным коэффициентом ЭДС. Как видно, этот коэффициент полностью определяется энтропией реакции. Отсюда вытекает, что сама зависимость
называется температурным коэффициентом ЭДС. Как видно, этот коэффициент полностью определяется энтропией реакции. Отсюда вытекает, что сама зависимость 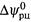 от температуры является линейной.
от температуры является линейной.
 |
в) С другой стороны, измеряя ЭДС гальванического элемента при разных температурах, производную
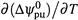 можно оценить из экспериментальных данных. Тогда легко найти не только энтропию реакции (исходя из (14.18)), но и энтальпию, т.е. (вместе с энергией Гиббса (14.17,в)) все три термодинамические характеристики соответствующей ОВР. Действительно,
можно оценить из экспериментальных данных. Тогда легко найти не только энтропию реакции (исходя из (14.18)), но и энтальпию, т.е. (вместе с энергией Гиббса (14.17,в)) все три термодинамические характеристики соответствующей ОВР. Действительно,
или
 |
г) Итак, чтобы воспользоваться данной формулой, надо знать производную
стандартной ЭДС по температуре, а также конкретное значение стандартной
ЭДС при какой-либо температуре.
Электродные потенциалы
1. а) В практических расчетах часто используют не только ЭДС самой реакции (ОВР), т.е. разность потенциалов между электродами — ∆Ψрц, но и потенциалы отдельных электродов — Ψ1 и Ψ2; они же — потенциалы соответствующих окислительно-восстановительных пар:
 |
б) Из того факта, что величина ∆Ψрц зависит от концентраций участников ОВР, следует аналогичная зависимость и для электродных потенциалов.
Однако каждый такой потенциал, очевидно, зависит от концентраций
участников только своей полуреакции.
 |
2. а) Чтобы найти эту зависимость, надо в уравнении Нернста (14.17,а) разделить величины, относящиеся к разным полуреакциям:
В частности, стандартная ЭДС (∆Ψ0рц) представлена как разность стандартных потенциалов, относящихся к единичным активностям всех компонентов соответствующей окислительно-восстановительной пары.
 |
б) I . Сопоставляя (14.21, б) с (14.20), для потенциала любой пары (любого электрода) можно записать выражение:
 |
II . Если стехиометрические коэффициенты в уравнении полуреакции (α и β)
отличны от 1, то, очевидно, формулу надо несколько усложнить:
III . Наконец, если в уравнении полуреакции, кроме основных компонентов ОВ-пары, фигурируют другие ионы, например, протоны (как часто бывает в случае органических веществ), то их активность, естественно, тоже входит в формулу расчета потенциала. Так, для полуреакции
 |
 |
потенциал равен
3. а) Эти формулы и определяют зависимость электродного потенциала от активностей участников полуреакции.
а) Если все активности равны 1, то потенциал равен стандартному.
б) В противном случае потенциал тем больше, чем сильнее сдвинуто соот-ношение активностей в сторону окисленной формы, т.е. чем выше сродство пары к электронам.
в) И, как следует из (14.23,б), потенциал может зависеть от рН среды.
Полученные нами выражения фактически являются разновидностями
уравнения Нернста, отчего данное название нередко используют и для них,
хотя в некоторых учебниках их называют уравнениями Петерса.
4. Другие формы записи ур-я Нернста (Петерса).
 |
а) Часто обсуждаемые уравнения записывают для Т = 298 К и одновременно переходят от натуральных логарифмов к десятичным. Тогда, например, выражение (14.22, б) приобретает вид:
б) Нередко активности тех или иных участников полуреакции следует принять за 1. Это относится к веществу
- в твердой фазе (например, металлической меди в паре (Сu2+/Cu)),
- или в газообразном состоянии, если давление вещества равно нормальному атмосферному давлению.
в) В общем же случае активность газообразного участника (например, H2)
равна отношению его давления к стандартному:
 |
5. Используем сделанные замечания для электродов элемента Даниэля—
Якоби. Кроме того, учтем, что в этом случае z = 2, так что 0,059/z ≈ 0,03В.
Тогда получаем выражения вида:
 |
 |
которые, по существу, аналогичны формулам для химического потенциала:
Дата: 2019-02-02, просмотров: 321.