И элементов
Кроме вышеизложенного, существуют и другие принципы подразделения электродов и элементов. Так, и те, и другие могут быть обратимыми и
необратимыми.
1. а)Обратимые электроды таковы, что если с помощью внешней ЭДС изменить направление тока в цепи на противоположное, в полуэлементе пойдет
обратная полуреакция.
б) В элементе Даниэля—Якоби оба электрода — обратимые:
 |
в) Обратимые электроды, в свою очередь, могут быть двух видов.
I . Обратимые по катиону: электроды и раствор обмениваются катионами. В
основном, это электроды первого рода: электроды элемента Даниэля–Якоби
(медный и цинковый), водородный электрод и др. Потенциал таких электродов определяется активностью соответствующего катиона в растворе.
II . А в обратимых по аниону электродах происходит обмен (между твердой
фазой и раствором) анионами; соответственно, от их концентрации и зависит
потенциал электрода. Очевидно, сюда относятся электроды второго рода.
2. а) А каковы необратимые электроды и элементы? В этом случае при изменении направления тока (с помощью внешней цепи) происходит не та реакция, которая обратна исходной, а другая.
 б) Пример — элемент Вольта (рис. 15.5):
б) Пример — элемент Вольта (рис. 15.5):
 |
В нем цинковая и медная пластинки погружены в один и тот же раствор.
I . При отсутствии внешней ЭДС (рис. 15.5,а) происходят те же реакции, что в элементе Даниэля–Якоби:
 |
т.е. цинковая пластинка растворяется, а медная — утолщается. Но если изменить направление тока (рис. 15.5,б), будет происходить электролиз, и на цинковой пластинке будет выделяться не цинк, а медь — потому что сродство к электронам у неё выше, чем у цинка.
3. Наконец, отметим еще одно подразделение гальванических элементов:
с переносом и без переноса.
а) В элементах с переносом есть граница между жидкими фазами полуэлементов, и поэтому при замыкании цепи происходит перенос ионов (по солевому мостику) из одной среды в другую. Сюда относится большинство известных нам элементов.
б) В элементах же без переноса нет границы между жидкими фазами. Приме-
ры — элементы Вольта (рис. 15.5, а) и Вестона (рис. 15.1).
Потенциометрия
1. Нам осталось рассмотреть последний вопрос этого раздела — измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия. Возможные его применения весьма многообразны.
а) Например, найдя для OB-реакции ∆Ψрц (при нескольких температурах), можно рассчитать термодинамические параметры этой реакции — ∆Gрц, ∆G0рц, Kp, ∆Н0рц и ∆S0рц.
б) С помощью потенциометрии определяют также характеристики растворенного вещества:
- коэффициент активности сильного электролита (активность рассчитывают по формуле Нернста и сравнивают с реальной концентрацией),
- рН раствора и
- константу кислотности слабого электролита (в эквимолярной буферной
смеси, составленной с участием этого электролита, рН совпадает с pKa), и т.д.
2. Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
 3. Пример: титрование раствора FeCl3 раствором SnCl2.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
а) Пусть требуется определить в растворе концентрацию соли FeCl3. Составим гальванический элемент (рис. 15.6): один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
б) В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счет окисления H2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ-пары ещё нет, так как имеется только один ее компонент — ионы Fe3+.
 |
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 . Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением её компонентов:
 |
 г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
Б. В критической точке титрования (КТТ) будет оттитровано всё количество Fe3+, так что в растворе останутся только продукты реакции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
 |
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возникнет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ продолжает снижаться.
е) Но теперь критический объём титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объёме, можно найти и количество исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
ж) Кроме того, можно оценить и стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
при V1 = 0,5 VКТТ ΔΨ = Ψ0 (Fe3+/Fe2+), (15.28, а-б)
а при V1 = 2 VКТТ ΔΨ = Ψ0 (Sn4+/Sn2+) (15.29, а-б)
Заметим, что самомỳ критическому объёму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
 |
Краткое содержание главы 15
В этой главе продолжалось рассмотрение гальванических элементов.
1. В частности, в обобщённом виде природу элемента записывают так:
При этом гальванические элементы делятся на
ХИМИЧЕСКИЕ — полуэлементы различны по природе, и
КОНЦЕНТРАЦИОННЫЕ — оба полуэлемента одинаковы по природе, но различаются по концентрации компонентов.
Сами же электроды (полуэлементы) подразделяют на 4 группы.
I . ЭЛЕКТРОДЫ ПЕРВОГО РОДА – M│M2+, включают ПРОСТОЕ ВЕЩЕСТВО И ПРОСТОЙ ИОН этого вещества.
Примеры: электроды элемента Даниэля–Якоби — Zn│Zn2+ и Cu│Cu2+, водородный электрод — (Pt)H+│H, амальгамный электрод в элементе Вестона — Cd(в Hg) │Cd2+.
II . ЭЛЕКТРОДЫ ВТОРОГО РОДА — КатАн↓| M |Ан. Здесь — три компонента:
ПРОСТОЕ ВЕЩЕСТВО (М), его ТРУДНОРАСТВОРИМАЯ СОЛЬ (КатАн), а также
РАСТВОРИМЫЙ ИОН данной соли (Ан). Примеры: ртутно–сульфатный электрод
элемента Вестона — Hg2SO4|Hg|SO42-, каломельный электрод — Hg2Cl2|Hg(Pt)Cl-, хлорсеребряный электрод — AgCl|Ag|Cl-.
III . РЕДОКС-ЭЛЕКТРОДЫ: все компоненты полуреакции (Ох и Rd) находятся в растворе.
Примеры: пара 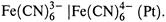 , хингидронный электрод — эквимолярная смесь хинона и гидрохинона.
, хингидронный электрод — эквимолярная смесь хинона и гидрохинона.
IV. ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ: включают твердую фазу, которая избирательно сорбирует из раствора те или иные ионы. Пример — СТЕКЛЯННЫЙ электрод, используемый для измерения рН.
4. Кроме того, электроды могут быть ОБРАТИМЫМИ по катиону или аниону.
Обратимыми являются и составленные из них элементы.
НЕОБРАТИМЫЕ же элементы таковы, что при изменении направления тока происходит не реакция, обратная исходной, а другая. Пример — элемент Вольта:
(-)Zn|CuSO4|Cu(+).
5. Наконец, элементы делят еще по-иному: С ПЕРЕНОСОМ и БЕЗ ПЕРЕНОСА. В
последнем случае нет границы между жидкими фазами (пример – тот же элемент Вольта).
6. Составление гальванических элементов и измерение их ЭДС может служить для физико-химического анализа, что обозначается как ПОТЕНЦИОМЕТРИЯ. В частности, при ПОТЕНЦИОМЕТРИЧЕСКОМ ТИТРОВАНИИ в критической точке титрования резко меняется ЭДС элемента. Это позволяет оценить концентрации веществ и стандартные редокс-потенциалы.
ЗАДАЧИ К РАЗДЕЛУ 3
1. Раствор содержит оксалат натрия, Na 2 C 2 O 4 ( c 1 = 0,1 M ), сульфат меди, С uSO 4 ( c 2 =0,1 М) и уксусную кислоту, СН3СООН (с3 = 0,01 М). Найти ионную силу раствора.
Решение
Действуем по формуле (13.2):
I = 0,5 Σ zi2 ci = 0,5 (12·2 c 1 + 22·c 1 + 22·c 2 + 22·c 2 + 12·α·c 3 + 12·α·c 3 ) ≈ 0,7 . (III.1)
 |
Na + C 2 O 4 2– Cu + SO 4 2– H + CH 3 COO –
При расчёте этой суммы двумя последними слагаемыми можно пренебречь (а значит, не рассчитывать степень диссоциации α) по двум причинам:
- во-первых, в растворе отсутствуют основания (щёлочи), а в нейтральной и кислой среде степень диссоциации (α) уксусной кислоты очень мала (11.29,б);
- во-вторых, концентрация уксусной кислоты (c 3) на порядок ниже концентрации остальных компонентов раствора, так что даже при большей диссоциации вклад этой кислоты в ионную силу был бы весьма мал.
 |
2. Имеется раствор Са Cl 2 c концентрацией с = 0,002 М при 25оС. Оценить коэффициент активности ионов Са2+ с помощью предельного закона Дебая-Хюккеля. Фигурирующий в этом законе коэффициент считать равным А ≈ 0,52 √1/M.
Решение
а) Ионная сила раствора:
I = 0,5 (22·c + 12·2 c ) = 0,006 М . (III.2)
Первый член в этой сумме относится к ионам Са2+, второй – к ионам С l – .
б) Для оценки коэффициента активности ионов Са2+ используем формулу (13.15):
 lg γ (Са2+) ≈ – A·Z (Са2+)2·√ I ≈ – 0,52 √1/М ·22 · √0,006 М ≈ –0,161; (III.3,a)
lg γ (Са2+) ≈ – A·Z (Са2+)2·√ I ≈ – 0,52 √1/М ·22 · √0,006 М ≈ –0,161; (III.3,a)
γ (Са2+) = 10–0,161 ≈ 0,690 . (III.3,б)
Как видно, даже в таком относительно разбавленном растворе (0,002 М) коэффициент активности ионов существенно меньше единицы. Правда, при использовании более точной формулы расчёта (13.16) результат оказывается несколько выше (13.18,а-б).
3. Требуется приготовить V = 1 л натрий-фосфатного буфера с рН =6,6 и ионной силой I = 0,1. Определить количество необходимых (не считая воды) компонентов (в молях). Значения рКа для фосфорной кислоты таковы (рис. 12.2):
рКа,1 = 2,1 ; рКа.2 = 7,2 ; рКа.3 = 12,4 .
Решение
а) Заданное значение рН (6,23) лежит во второй буферной зоне фосфорной кислоты, в которой существуют следующие две её формы:
Н2РО4– ↔ Н+ + НРО42– , рКа.2 = 7,2 . (III.4)
(“кислота”) (“соль”)
Таким образом, требуются две натриевые соли: Na Н2РО4 (“кислота”) и Na 2 НРО4 (“соль”).
б) Соотношение, в котором они должны быть взяты, находим из уравнения Гендерсона-Хассельбаха (12.3):
рН = рКа.2 + lg (сс /ск ), откуда lg (сс /ск ) = – 0,6 и сс /ск ≈ 0,25 . (III.5,а-в)
в) Количество же солей определяется условием, наложенным на ионную силу:
I (моль/л) = 0,5 ( 12·2 c с + 12·c к + 22·c с + 12·c к ) = 0,1. (III.6,а)

Na+ из “соли” Na+ из “к-ты” HPO42– H2PO4–
Отсюда
3 c с + c к = 0,1 моль/л (III.6,б)
г) Подставляя в это уравнение сс = 0,25 ск (из III.5,в), легко находим искомые концентрации компонентов в составляемой буферной системе:
ск ≈ 0,057 моль/л ; сс ≈ 0,014 моль/л . (III.7,а)
Поскольку требуемый объём раствора – 1 л , то таковы же по величине и количества солей, необходимые для приготовления системы:
n ( Na Н2РО4) = 0,057 молей и n ( Na 2 НРО4)= 0,014 молей . (III.7,б)
Дата: 2019-02-02, просмотров: 335.