1. а) Во втором варианте электродных процессов происходит обратное — трансформация химической энергии веществ (реакций) в электрическую энергию.
 б) Для осуществления такой трансформации надо:
б) Для осуществления такой трансформации надо:
- разбить ОВР на две полуреакции ,
- для каждой полуреакции сконструировать полуэлемент (или, как принято говорить, электрод)
- и объединить их в единый гальванический элемент.
2. Простейший пример — элемент Даниэля-Якоби (рис. 14.2).
а) Один электрод здесь — пластинка Zn в растворе ZnSO4, а второй — пластинка Cu в растворе CuSO4.
 |
б) Рассчитаем энергию Гиббса соответствующей окислительно-восстановительной реакции:
 |
в) Из результата следует: термодинамически выгодно, чтобы в левом полуэлементе схемы (рис. 14.2) атомы Zn в металлической пластинке отдавали
электроны во внешнюю цепь:
и чтобы далее электроны перетекали к правому полуэлементу и восстанавливали здесь ионы меди:
 |
Действительно, совокупность этих процессов будет приводить к итоговой
реакции (14.4, а), а следовательно, и к высвобождению энергии (14.4,6).
3. а) Таким образом, здесь энергия химической реакции (ОВР) приводит к
возникновению электрического тока во внешней цепи.
б) А это означает, что между двумя полуэлементами существует разность потенциалов, ∆Ψ, или, что то же самое, ЭДС (электродвижущая сила).
Отсюда — приведенное выше название данного феномена: генерация ЭДС
в гальванических элементах.
Далее рассмотрим именно этот вид электродных процессов.
Дополнительные замечания об элементе
Даниэля-Якоби
Сделаем несколько поясняющих замечаний о работе элемента Даниэля—
Якоби (см. рис. 14.2).
1. Изменение электродов. Представим, что в этом элементе замкнулась внешняя цепь и начались полуреакции (14.5, а-б).
а) В ходе первой из них происходит распад атомов Zn (находящихся в соответствующей пластинке) на электроны, поступающие во внешнюю цепь, и ионы Zn2+, диффундирующие в раствор.
Следовательно, со временем происходит постепенное растворение цинковой
пластинки.
б) В ходе второй полуреакции совершается обратное: ионы Cu2+ из раствора CuSO4 получают электроны (перетекающие на медную пластинку из внешней цепи), и, теряя растворимость, откладываются на электроде.
Таким образом, медная пластинка со временем утолщается.
2. Солевой мостик.
а) Для того, чтобы эти процессы стали хоть сколько-нибудь заметными, необходимо соединить жидкие среды полуэлементов «солевым мостиком». Обычно это U-образная трубка, заполненная насыщенным раствором KCl.
б) Дело в том, что, как следует из предыдущего, при работе элемента в растворе левого полуэлемента создается избыток катионов (Zn2+), а в растворе правого полуэлемента — дефицит катионов (Cu2+), т.е. избыток анионов ( 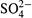 ). Это приводит к образованию такой разности потенциалов (ΔΨдиф), которая препятствует прямой реакции (14.4) и, всё возрастая по величине, довольно быстро её останавливает.
). Это приводит к образованию такой разности потенциалов (ΔΨдиф), которая препятствует прямой реакции (14.4) и, всё возрастая по величине, довольно быстро её останавливает.
в) Благодаря же «солевому мостику» в каждом растворе постоянно поддерживается состояние, близкое к электронейтральному: под действием даже очень небольшой ΔΨдиф ионы K+ быстро диффундируют к правому полуэлементу, а ионы Cl- — к левому. Поэтому ΔΨдиф далее не возрастает и существенно не влияет на генерируемое значение разности потенциалов (ΔΨ).
г) Выбор в качестве раствора именно КCl обусловлен тем, что ионы K+ и Cl-
|обладают наибольшей подвижностью среди всех ионов (за исключением ионов H+ и OH-; см. п. 13.7).
д) «Солевой мостик» необходим при работе не только элемента Даниэля-
Якоби, а и очень многих других элементов.
Дата: 2019-02-02, просмотров: 363.