1. Стандартное значение энергии Гиббса реакции. Если концентрации всех реагентов — одномолярные, то энергия Гиббса реакции, соответствующая таким условиям, называется стандартной и обозначается 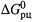 . Кроме того, для величин
. Кроме того, для величин 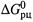 обычно предполагаются и стандартные значения температуры, давления и количества веществ.
обычно предполагаются и стандартные значения температуры, давления и количества веществ.
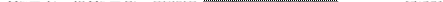 |
Таким образом, принципиальное отличие
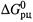 от
от 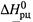 состоит в том, что наряду с обычными стандартными условиями (для Т, Р и п) задается еще одно стандартное условие — постоянные одномолярные концентрации всех участников. С учетом этого в уравнении (4.34, а) пропадает второе слагаемое:
состоит в том, что наряду с обычными стандартными условиями (для Т, Р и п) задается еще одно стандартное условие — постоянные одномолярные концентрации всех участников. С учетом этого в уравнении (4.34, а) пропадает второе слагаемое:
Получается, что стандартная энергия Гиббса реакции однозначно связана с константой равновесия.
Подчеркнем еще раз, что величина 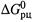 относится вовсе не к состоянию равновесия (тогда бы
относится вовсе не к состоянию равновесия (тогда бы 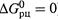 ), а к одномолярным концентрациям участников, которые в общем случае не являются равновесными.
), а к одномолярным концентрациям участников, которые в общем случае не являются равновесными.
2. Связь между 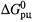 и K p . Обратим внимание на конкретный характер связи между
и K p . Обратим внимание на конкретный характер связи между 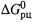 и Кр. Так, из формулы (4.35) следуют соотношения:
и Кр. Так, из формулы (4.35) следуют соотношения:

а) В частности, видно: если Кр = 1, то при одномолярных (или даже просто при равных) концентрациях всех реагентов реакция находится в состоянии равновесия.
б) Если Кр >1, то равновесие сдвинуто в сторону прямой реакции, и при равных концентрациях всех реагентов имеется термодинамический стимул для прямого превращения 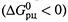 .
.
в) Наконец, если Кр >1, то прямой процесс (при одинаковых концентрациях участников) самостоятельно не проходит.
3. Зависимость 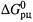 от концентрации участников реакции.
от концентрации участников реакции.
а) Вернемся к уравнению изотермы реакции (4.34), которое с учетом (4.35) можно записать и так:

Отсюда следует, что за счет концентрационного члена (RT lnПс) изменение энергии Гиббса в реакции может существенно отличаться от стандартного значения, т.е. процесс, эндергонический в стандартных условиях, при соответствующем сдвиге концентраций может становиться обратимым или даже экзергоническим.
б) Считается, что в природных условиях для обратимой (в химическом смысле) реакции Пс вряд ли спускается ниже 10-7 или поднимается выше 107. Поэтому максимально возможный вклад концентрационного члена в 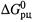 ограничивают величиной
ограничивают величиной

в) На основании уравнения (4.34,6), можно получить серию соотношений, поясняющих характер зависимости 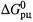 от концентраций:
от концентраций:
 |
Первое из них означает: если действительные концентрации участников таковы, что Пс совпадает с Кр, то реакция находится в состоянии термодинамической обратимости. Если Пс является ниже Кр, прямая реакция — экзергонична. И, наоборот, при повышении Пс свыше Кр прямая реакция протекать не может.
4.11. Практический расчет Δ G рц
1. На практике рассчитывают энергию Гиббса реакции при известных концентрациях участников следующим образом. Проблема сводится к расчету стандартной энергии Гиббса реакции, 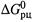 , поскольку, зная ее и концентрации, нетрудно воспользоваться формулой (4.37).
, поскольку, зная ее и концентрации, нетрудно воспользоваться формулой (4.37).
Есть два принципиальных подхода к нахождению 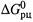 :
:
а) либо по известной константе равновесия реакции (формула (4.35)),
б) либо аналогично тому, как определяется стандартная энтальпия (п. 2.3), а именно — через 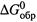 или
или 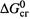 участников.
участников.
2. Остановимся несколько подробней на втором способе. Прежде всего, уточним, что понимается под величинами 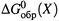 и
и 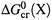 .
.
а) 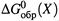 — стандартная энергия Гиббса образования вещества X; это ΔG реакции образования из простых веществ 1 моля X при стандартных условиях и в определенном состоянии, под которым подразумевается
— стандартная энергия Гиббса образования вещества X; это ΔG реакции образования из простых веществ 1 моля X при стандартных условиях и в определенном состоянии, под которым подразумевается
- либо (как и в случае энтальпии 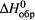 ) соответствующее агрегатное состояние вещества (твердое, жидкое или газообразное),
) соответствующее агрегатное состояние вещества (твердое, жидкое или газообразное),
- либо (в отличие от энтальпии) одномолярный водный раствор вещества.
б) Соответственно, 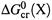 — стандартная энергия Гиббса сгорания вещества X; это ΔG реакции окисления до конечных оксидов 1 моля X , находящегося в определенном состоянии (например, в виде 1 М раствора) и при стандартных условиях.
— стандартная энергия Гиббса сгорания вещества X; это ΔG реакции окисления до конечных оксидов 1 моля X , находящегося в определенном состоянии (например, в виде 1 М раствора) и при стандартных условиях.
При этом имеются в виду два обстоятельства:
I . для простых веществ и элементов равны нулю величины 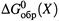 (как и
(как и 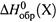 ),
),
II. а для конечных продуктов окисления равны нулю величины 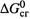 (как и
(как и 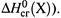
в) Формулы расчета 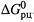 через стандартные характеристики участников реакции аналогичны таковым в случае энтальпии (2.18, а-б):
через стандартные характеристики участников реакции аналогичны таковым в случае энтальпии (2.18, а-б):
 |
Снова необходимо либо из суммы энергии Гиббса образования продуктов вычесть сумму соответствующих величин для реагентов, либо из суммы энергии Гиббса сгорания реагентов вычесть сумму соответствующих величин для продуктов.
Пример — спиртовое брожение глюкозы:

Согласно (2.19,б), для этого процесса 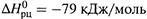 . Следовательно, за счет энтропийного вклада способность брожения совершать полезную работу увеличивается почти втрое. Это очень важно, поскольку подобные процессы служат основным источником энергии у многих анаэробных организмов, а при интенсивной мышечной нагрузке – также у животных и человека.
. Следовательно, за счет энтропийного вклада способность брожения совершать полезную работу увеличивается почти втрое. Это очень важно, поскольку подобные процессы служат основным источником энергии у многих анаэробных организмов, а при интенсивной мышечной нагрузке – также у животных и человека.
Дата: 2019-02-02, просмотров: 441.