и давлению
Выше шла речь об энергии Гиббса применительно только к изотермо- изобарным процессам в закрытых системах, где данная функция является термодинамическим потенциалом.
Однако величину ΔG можно рассматривать в любом процессе. От каких параметров и как тогда она зависит?
а) Согласно определению (4.7, а),

б) Отсюда изменение энергии Гиббса на микростадии произвольного процесса таково:

в) Пусть процесс является обратимым (т. е. на каждой микростадии система находится в состоянии равновесия) и пусть возможная работа совершается только против давления. Тогда, в соответствии с (1.7) и (3.4),

г) С учетом этого в выражении (4.17,б) три подчеркнутые члена сокращаются, давая в сумме ноль. Остается следующее:

Отсюда вывод: энергия Гиббса равновесного процесса (и равновесной системы) зависит от двух независимых переменных — давления и температуры (чего, в общем, и следовало ожидать).
д) Соответствующие частные производные таковы:

т.е. температурная зависимость энергии Гиббса определяется энтропией системы, а зависимость от давления — объемом системы.
Химический потенциал
1. а) Как известно, в химических процессах меняется и количество того или иного вещества. Поэтому энергия Гиббса системы в состоянии равновесия зависит также от количества ее компонентов:

Это означает, что выражение (4.19) следует расширить, добавляя члены, содержащие дифференциалы ni :

б) Множители μj при данных дифференциалах называются химическими потенциалами компонентов системы.
Очевидно, каждый такой множитель — это частная производная энергии Гиббса по количеству соответствующего вещества:
 |
2. а) Если условия являются изотермо-изобарными (т.е. когда dP = dT = 0), выражение (4.21,б) сводится к сумме парциальных энергий Гиббса, относящихся к отдельным химическим компонентам системы:

б) Отсюда вытекает простая интерпретация химического потенциала того или иного компонента. По существу, μ j — это та часть энергии Гиббса системы, которая приходится на 1 моль данного вещества, т. е. это просто энергия Гиббса 1 моля вещества.
 |
в) Следовательно, для изотермо-изобарных процессов химический потенциал компонента системы можно отождествлять с его молярной энергией Гиббса, а так как зависимость Gj от числа молей — линейная, то можно просто написать:
3. Соответственно, для изотермо-изохорного процесса

т. е. здесь 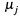 — это энергия Гельмгольца 1 моля вещества.
— это энергия Гельмгольца 1 моля вещества.
Вышесказанное применимо и к физическим, и к химическим процессам. Далее же будет рассмотрена энергия Гиббса преимущественно химических систем, для которых мы получим ряд полезных соотношений.
Однако предварительно необходимо остановиться на осмотических процессах, поскольку химическую систему можно представить как совокупность осмотических систем.
Осмотические процессы
1. а) В осмотическом процессе все изменение системы состоит в изменении концентрации растворенного вещества.
б) В п. 3.4 отмечалось, что в таком процессе (в изотермических условиях) теплота не поглощается и не выделяется. Как там было сказано, разбавление раствора эквивалентно расширению газа в пустоту, а при таком расширении работа против давления не совершается, отчего не требуется и поглощение теплоты.
в) Итак, первое слагаемое энергии Гиббса равно нулю, и все изменение этой энергии обусловлено только изменением энтропии системы:

г) В том же п. 3.4 указано, что изменение энтропии в таких процессах рассчитывается (при не очень больших концентрациях) по формуле:

 |
д) Подставляя это выражение в (4.26, б), получаем и формулу для расчета энергии Гиббса:
2. а) Обе эти формулы имеют строго определенную область применимости и относятся к переходу п молей вещества от концентрации 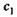 к концентрации
к концентрации 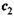 .
.
Указанный переход может совершаться в следующих случаях:
I . при разбавлении или концентрировании вещества путем изменения
содержания растворителя,
II . в ходе переноса вещества через границу, разделяющую две среды с разными и постоянными концентрациями этого вещества (рис. 4.2).
 б) Второй случай особо важен для биологических объектов — это, по существу, трансмембранный транспорт веществ. А чтобы концентрации в отсеках оставались постоянными, отсеки надо считать неограниченными. При этом совокупность растворенного вещества в обоих отсеках — закрытая система, так что критерием самопроизвольности переноса веществ через границу, действительно, является энергия Гиббса (при Т и Р – const).
б) Второй случай особо важен для биологических объектов — это, по существу, трансмембранный транспорт веществ. А чтобы концентрации в отсеках оставались постоянными, отсеки надо считать неограниченными. При этом совокупность растворенного вещества в обоих отсеках — закрытая система, так что критерием самопроизвольности переноса веществ через границу, действительно, является энергия Гиббса (при Т и Р – const).
3. Формула (4.27) показывает:

т.е. самопроизвольным может быть только переход вещества от состояния с большей концентрацией в состояние с меньшей концентрацией.
Дата: 2019-02-02, просмотров: 400.