В ходе реакций с участием водородных ионов чаще используют не стандартную, а так называемую кажущуюся энергию Гиббса.
Рассмотрим простейшую из таких реакций — диссоциацию слабой кислоты:

1. а) Использование формулы (4.35) позволяет записать такие выражения для стандартной энергии Гиббса реакции:

А поскольку для слабых кислот 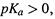 то всегда
то всегда 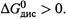
б) Однако следует заметить: 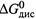 , как обычно,относится к реакции при одномолярных концентрациях всех участников — в том числе протонов H+:
, как обычно,относится к реакции при одномолярных концентрациях всех участников — в том числе протонов H+:

Следовательно, речь идет о диссоциации при p H = 0!
Данное условие не очень естественно, отчего соответствующая ему характеристика ΔG0дис не столь интересна.
2. Чаще пользуются так называемой кажущейся энергией Гиббса реакции, ΔG 'рц .
а) Данная величина характеризует превращение 1 моля субстрата в продукт (это может быть только диссоциация или более сложная реакция) при стандартных значениях температуры и давления (1.4, а-в) и при постоянных 1 М концентрациях всех реагентов, кроме протонов: концентрация же последних равна 10-7 М.
Иными словами, реакция протекает при постоянном рН = 7,0.
б) Для реакции диссоциации вида (4.42, а) кажущееся значение энергии Гиббса (ΔG 'дис) легко рассчитать из стандартной ( 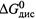 ).
).
 |
Будем исходить из уравнения изотермы реакции (4.37):
 |
где в данном случае
 |
Отсюда для T = 310 K (37°) получаем:
в) Это соотношение справедливо для любых (в т.ч. и для сложных) реакций, сопровождаемых диссоциацией протона. Если же протон не является продуктом или субстратом реакции, то стандартное и кажущееся значения энергии Гиббса совпадают.
г) Можно также выразить ΔG 'дис через pKa:

 |
или
3. Последняя формула, в частности, показывает:

а) Так, если рКа электролита лежит в кислой среде, то его кажущаяся энергия диссоциации отрицательна, т.е. при рН = 7 диссоциация происходит самопроизвольно.
б) Наоборот: если рКа лежит в щелочной среде, то ΔG 'дис положительно и при рН = 7 вещество остаётся недиссоциированным.
Краткое содержание главы 4
1. В главе продемонстрировано применение второго начала термодинамики к различным системам и процессам.
а) Так, в изолированных системах остаётся один стимул для самопроизвольного протекания процессов – возрастание энтропии:
dS ≥ 0 .
б) В закрытых системах для изотермо-изохорных процессов всё решает баланс двух критериев, обозначаемый как изменение ЭНЕРГИИ ГЕЛЬМГОЛЬЦА:
ΔА = ΔЕ – T dS ≤ 0.
в) А в тех же системах для изотермо-изобарных процессов аналогичный баланс – это изменение ЭНЕРГИИ ГИББСА:
Δ G = ΔН – T dS ≤ 0.
2. Введены два понятия.
а) ТЕРМОДИНАМИЧЕСКИЙ ПОТЕНЦИАЛ – функция состояния, служащая в качестве единственного критерия возможности процесса.
б) ХИМИЧЕСКИЙ ПОТЕНЦИАЛ. В изотермо-изобарных условиях это производная энергии Гиббса по количеству соответствующего вещества:

3. Выяснены свойства энергии Гиббса.
а) Δ G численно равно максимальной полезной работе, которая могла бы быть совершена в таком процессе.
б) Производные этой величины по температуре и давлению таковы:

 |
4. Получена формула расчёта энергии Гиббса при переходе вещества от одной концентрации к другой:
5. а) Из неё следует УРАВНЕНИЕ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ:

б) Необходимо учитывать, что ΔGрц соответствует превращению реагентов в продукты при сохранении всех концентраций на исходном уровне. В случае же стандартной энергии Гиббса (ΔG °рц) это одномолярные коцентрации всех участников.
в) СТАНДАРТНЫЕ ЭНЕРГИИ ГИББСА реакций можно рассчитывать через соответствующие характеристики реагентов и продуктов:

г) Для реакций с участием водородных ионов может использоваться не стандартная, а так называемая КАЖУЩАЯСЯ ЭНЕРГИЯ ГИББСА, которая относится к рН = 7,0:
ΔG 'рц = ΔG °дис + RT ln10–7 ≈ ΔG °дис – 41 кДж/моль .
Дата: 2019-02-02, просмотров: 352.