Кинетические уравнения, описывающие процесс РП и хорошо согласующиеся с практическими данными, можно вывести только для начальных стадий процесса, когда степень конверсии мономера в полимер не превышает 10 % , вязкость полимера невелика, и не сказываются диффузионные процессы.
Кинетические уравнения обычно выводят для 2-х вариантов протекания РП:
А) в отсутствие реакций передачи цепи
Б) при наличии реакций передачи цепи
Вариант А) в отсутствие реакций передачи цепи
Когда нет реакций передачи цепи, то общая скорость радикальной полимеризации w РП будет равна сумме скоростей реакций инициирования и роста, обеспечивающих наращивание макромолекул, с вычетом скорости обрыва цепи, которая останавливает или тормозит процесс:
w РП = w и + w р - w о
Установлено, что во всех видах цепной полимеризации и, в том числе в РП, вскоре после начала процесса (~ в течение первых 10 мин) устанавливается равенство скоростей инициирования и обрыва w и = w о. Такое явление называется стационарное состояние. В стационарном состоянии число радикалов, образующихся в единицу времени, равно числу исчезающих радикалов. Рост цепи в этот период идет на тех радикалах, которые успели возникнуть в начале процесса.
После подстановки и преобразования соответствующих выражений скоростей инициирования, роста и обрыва цепи получается итоговое уравнение для скорости РП:
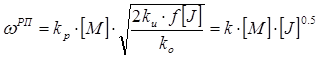
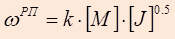 1.,
1.,
где k – это константа, объединившая все величины, постоянные для данного процесса (k о , k и , k р , f и множитель 2).
Из уравнения 1 вытекает, что скорость РП прямо пропорциональна концентрации мономера [ M ] в первой степени и концентрации инициатора в степени одна вторая [ J ]½.
Отношение скоростей роста и обрыва цепи 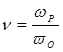 показывает, сколько молекул мономера успело присоединиться к растущему радикалу до момента его гибели. Следовательно, это есть не что иное, как среднечисловая степень полимеризации `n .
показывает, сколько молекул мономера успело присоединиться к растущему радикалу до момента его гибели. Следовательно, это есть не что иное, как среднечисловая степень полимеризации `n .
В случае обрыва цепи методом рекомбинации `n = 2 n .
При обрыве цепи методом диспропорционирования `n = n .
Величина 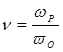 называется кинетической длиной цепи.
называется кинетической длиной цепи.
После подстановки выражений для соответствующих скоростей получаем, что степень полимеризации при РП в случае обрыва цепи методом рекомбинации будет равна:
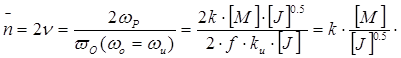
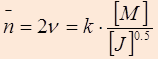 2.
2.
Следовательно, степень полимеризации и соответственно молекулярная масса полимера, полученного методом радикальной полимеризации, прямо пропорциональна первой степени концентрации мономера [ M ] и обратно пропорциональна концентрации инициатора в степени одна вторая [ J ]-½.
Из полученных уравнений следует:
1. Для ускорения РП следует увеличивать концентрацию мономера и инициатора
2. Для повышения молекулярной массы - тоже увеличивать концентрацию мономера, но снижать концентрацию инициатора.
Влияние инициатора на процесс РП оказалось двояким. В конечном итоге оптимальной концентрацией инициатора считается концентрация от 0,1% до нескольких относительных процентов от массы мономера.
Вариант Б) при наличии реакций передачи цепи
Если в процессе радикальной полимеризации протекают реакции передачи цепи, то общая скорость РП будет равна:
w РП = w и + w р - w о -  -
-  -
- 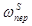 -
- 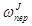 .
.
Степень полимеризации `n соответственно будет равна:
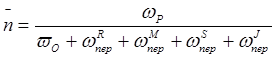
Величина, обратная степени полимеризации 1/`n , рассчитывается по формуле:
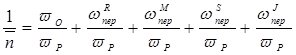
После подстановки выражений скоростей всех реакций ( w и ; w р ; w о ; 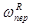 ;
; 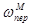 ;
; 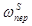 ;
; 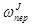 ) и преобразования получаем итоговое уравнение:
) и преобразования получаем итоговое уравнение:
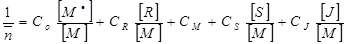 3.
3.
Где 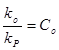
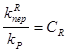
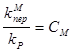
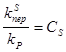
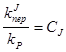 - это относительные константы скоростей обрыва и передачи цепи на различные реагенты.
- это относительные константы скоростей обрыва и передачи цепи на различные реагенты.
Последнее уравнение 3 называется общее уравнение кинетики радикальной полимеризации.
Если уравнение 3 перевернуть обратно, то из него следует, что молекулярная масса полимера при РП при наличии всех вариантов обрыва и передачи цепи прямо пропорциональна концентрации мономера и обратно пропорциональна концентрации любых реагентов передачи цепи (примесей, растворителя, регулятора, инициатора).
Явление передачи цепи на молекулы низкомолекулярного вещества используют в благих целях в промышленности для предотвращения преждевременной полимеризации при транспортировке или хранении мономеров. Для этого в массу мономера вводят вещества – реагенты передачи цепи, которые называются ингибиторы ( Jn ).
Ингибиторы – это соединения Z , которые взаимодействуют с образовавшимися радикалами -- M · и образуют такие продукты, которые не способны далее продолжать рост цепи.
Схематично механизм действия ингибитора выглядит так:
 |
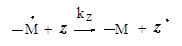
Эффективность ингибиторов оценивают по величине относительной константы ингибирования СZ, равной отношению констант скоростей ингибирования и роста 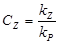
У эффективных ингибиторов СZ, >>1. Например, при введении в мономер стирол при температуре 500С ингибитора - п-бензхинона 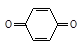 относительная константа ингибирования равна СZ=518. При введении в стирол кислорода (О=О) , который в этих же условиях тоже играет роль ингибитора, относительная константа ингибирования равна СZ=14600.
относительная константа ингибирования равна СZ=518. При введении в стирол кислорода (О=О) , который в этих же условиях тоже играет роль ингибитора, относительная константа ингибирования равна СZ=14600.
Ингибиторы подразделяют на:
· Истинные ингибиторы и
· Замедлители
Истинные ингибиторы полностью приостанавливают процесс полимеризации до момента полного исчерпания ингибитора Jn. Замедлители только снижают скорость полимеризации.
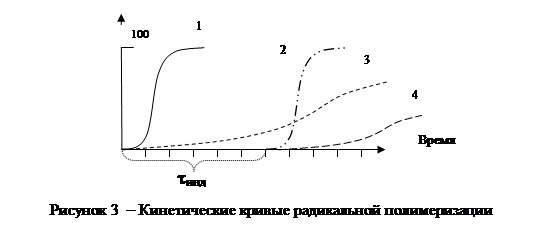
Кинетическая кривая полимеризации мономеров без введения ингибитора - это кривая 1 на рисунке 3. У нее три участка, соответствующие стадиям инициирования, роста цепи и обрыва цепи.
При введении истинного ингибитора полимеризация начнется только через некоторое время tинд, когда полностью израсходуется ингибитор (кривая 2). Это время tинд называется индукционным периодом и зависит от количества и эффективности введенного ингибитора. По истечении индукционного периода полимеризация начнется и будет протекать с такой же скоростью как в случае 1.
При введении в мономер замедлителей полимеризация начнется сразу же, но будет протекать с очень малой скоростью (кривая 3). Если в мономер добавить смесь истинного ингибитора и замедлителя (ингибитор смешанного действия), то тогда полимеризация начнется по истечении индукционного периода и пойдет с малой скоростью (кривая 4).
  |
В качестве ингибиторов преимущественно используют ароматические соединения. Радикалы, которые формируются на основе ароматических соединений, не активные, потому что неспаренный электрон радикала Z ., участвует в процессе p -сопряжения с электронными облаками ароматического кольца, делокализуется (рассеивается) и теряет свою активность (реакционную способность). В промышленности чаще всего применяют следующие типы ингибиторов:
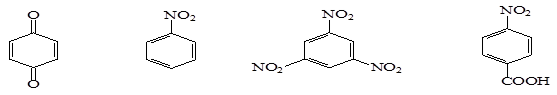
п-бензхинон, нитробензол, 1,3,5 –тринитробензол, п-нитробензойная к-та
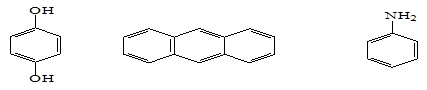
Гидрохинон (1,4-дигидроксибензол) Антрацен Аминобензол (анилин) и др.
Механизмы действия разных ингибиторов отличаются друг от друга. В частности механизм действия п-бензхинона следующий:
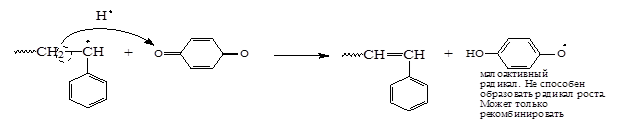
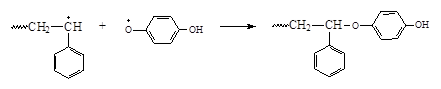
Некоторые низкомолекулярные соединения в одних условиях могут играть роль ингибиторов, в других – замедлителей, а в третьих – инициаторов полимеризации. Например, кислород О2 является специфичным реагентом. В ходе полимеризации этилена при высоком давлении и температуре кислород – инициатор, а при полимеризации стирола кислород - ингибитор полимеризации.
Дата: 2019-02-02, просмотров: 399.