Образование свободных радикалов возможно при действии химических и физических факторов, поэтому инициирование радикальной полимеризации подразделяют на физическое и химическое (смотри схему)
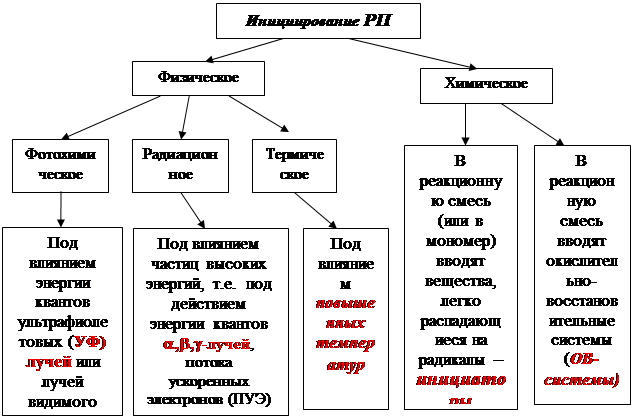
В технологии производства полимеров преимущественно распространены химические методы инициирования, когда в реакционную смесь вводят инициаторы ( J )- вещества, которые в определенных условиях легко распадаются на радикалы или ОВ-системы.
В группу инициаторов входят следующие вещества (таблица 10)
Таблица 10 –Типы инициаторов радикальной полимеризации
| Тип инициатора | Формула (в общем виде) | Механизм распада на радикалы |
| Дигидропероксиды | 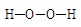
| 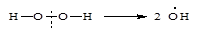
|
| Алкилгидропероксиды | 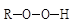
| 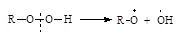
|
| Диалкилпероксиды | 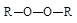
| 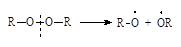
|
| Диацилпероксиды | 
| 
|
| Дисульфиды | 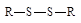
| 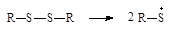
|
| Персульфаты | 
| 
|
| Азосоединения | 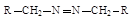
| 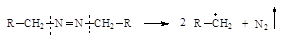
|
Конкретные представители инициаторов, условия и механизм их распада приведены в таблице 11.
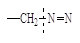 Легкий и быстрый распад инициаторов на радикалы происходит по связям кислород – кислород или углерод – азот, так как эти связи обладают наименьшей прочностью (энергией связи).
Легкий и быстрый распад инициаторов на радикалы происходит по связям кислород – кислород или углерод – азот, так как эти связи обладают наименьшей прочностью (энергией связи).
| Связь | 
| 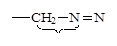
| 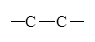
| 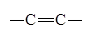
| 
|
| Энергия связи, кДж/моль | 147 | 305 | 346 | 605 | 413 |
Наиболее низкие температуры распада (50÷850С) и соответственно наименьшая энергия активации (Еаи) у таких инициаторов, как персульфат аммония, динитрил азобисизомасляной кислоты, пероксид бензоила. Эти инициаторы чаще всего используются в радикальной полимеризации (смотри таблицу 11).
Окислительно-восстановительные системы (ОВ-системы) – это комплексные системы, которые включают в себя окислитель и восстановитель (промотор). Роль окислителя чаще всего играют выше приведенные инициаторы J (пероксиды, гидропероксиды и др.). Промотором называют вещество, которое ускоряет распад инициаторов на радикалы. Промоторами в ОВ-системах служат соли металлов переменной валентности в низшей степени окисления, такие как хлорид железа двухвалентного FeCl2, хлорид меди одновалентной CuCl, нафтенаты кобальта, нафтенаты никеля общей формулы ( 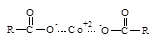 ) и др., где R – алкил. Кроме них, роль промоторов играют амины, сульфиты и др. соединения. В лакокрасочной промышленности промоторы – ускорители полимеризации называют сиккативы.
) и др., где R – алкил. Кроме них, роль промоторов играют амины, сульфиты и др. соединения. В лакокрасочной промышленности промоторы – ускорители полимеризации называют сиккативы.
 Механизм действия окислительно-восстановительных систем различен. Простейшей ОВ-системой является реактив Фентона – смесь из пероксида водорода Н-О-О-Н и хлористого железа FeCl2. В этой системе нестабильный катион Fe2+ легко теряет электрон `е и переходит в высшую степень окисления. Fe3+. Выделившийся электрон ускоряет распад пероксида водорода Н-О-----О-Н на ион НО- и радикал НО·.
Механизм действия окислительно-восстановительных систем различен. Простейшей ОВ-системой является реактив Фентона – смесь из пероксида водорода Н-О-О-Н и хлористого железа FeCl2. В этой системе нестабильный катион Fe2+ легко теряет электрон `е и переходит в высшую степень окисления. Fe3+. Выделившийся электрон ускоряет распад пероксида водорода Н-О-----О-Н на ион НО- и радикал НО·.
Распад инициаторов на радикалы в присутствии ОВ-систем идет очень быстро и энергия активации стадии инициирования при использовании ОВ-систем ниже, чем при использовании только одних химических инициаторов: Еаи (ОВ) < Еаи (J). Обычно энергия активации окислительно-восстановительного инициирования Еаи (ОВ) составляет 42÷84 кДж/моль, а энергия активации инициирования с применением только инициаторов Еаи (J ) равна 112÷170 кДж/моль.
Инициирование РП, т.е. образование свободных радикалов, идет в два этапа, которые схематично можно представить следующим образом:
а) образование радикалов J· в результате распада молекул инициатора J:
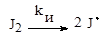
б) образованием активных радикалов роста J - М · из молекул мономеровМ:


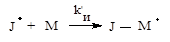
На примере мономера винилхлорида реакция на стадии б) выглядит так:
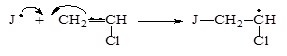
При использовании инициатора динитрила азобисизомасляной кислоты (ДИНИЗа) механизм двух этапов инициирования следующий:
а) образование радикала J· в результате распада молекулы инициатора:
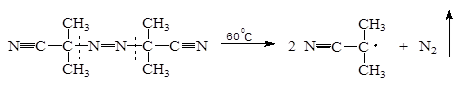
J 2 J·
б) образование активного радикала роста J - М · на базе молекулы мономера:
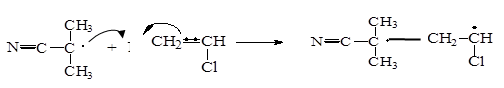 |
J· М J - М ·
Начальный этап (а) всегда требует затрат энергии активации Еаи , протекает с низкой скоростью и лимитирует весь процесс. Не все радикалы инициатора J· могут вызвать второй этап б) и образовать радикалы роста J - М ·.
Часть радикалов инициатора исчезает в результате протекания обратной реакции рекомбинации J· + J·= J 2 .
Доля активных радикалов инициатора J·, которые способны образовать радикалы роста J - М· и инициировать начало полимеризации, называется эффективностью инициирования и обозначается f .
Эффективность инициирования у разных инициаторов колеблется от 0,40 до 0,99.
С учетом f и лимитирующей роли этапа а) скорость инициирования радикальной полимеризации будет описываться уравнением:
 ,
,
где k и– константа скорости реакции инициирования на первом этапе
[J ] – концентрация инициатора.
Константа скорости инициирования k и при РП мала и составляет k и =0,8÷5,0 ×10-5с-1.
Фотохимическое инициирование используется реже, чем химическое. При фотохимическом инициировании молекулы мономера М поглощают энергию квантов (h n) излучения с длиной волны 100 нм<l< 400 нм, возбуждаются и распадаются на радикалы. Скорость фотохимического инициирования равна:
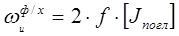
где 2 f – число активных радикалов, образовавшихся в пересчете на 1 квант поглощенного света. [Jпогл ] – интенсивность поглощенного излучения.
Энергия активации фотохимического инициирования Еаи (ф/х) значительно ниже энергии активации чисто химического инициирования Еаи : (Еаи (ф/х)<<Еаи (J )) и близка к 0 (Еаи (ф/х)» 0 кДж/моль). Вследствие этого фотохимическая радикальная полимеризация может протекать при низких и даже отрицательных температурах.
Однако скорость распада мономеров на радикалы при действии УФ-лучей или видимого излучения (ВИ) невысока. Для ускорения фотохимической полимеризации используют 2 приема:
1. Вводят в мономер вещества – фотоинициаторы
2. Вводят в мономер вещества – фотосенсибилизаторы.
Дата: 2019-02-02, просмотров: 417.