ПОЛИМЕРИЗАЦИИ
Скорость ЦП сильно зависит от типа заместителя в молекулах мономеров. Влияние заместителей в мономерах винилового ряда (1 колонка в таблице мономеров) на кинетику полимеризации обусловлено их полярностью и интенсивностью индуктивного, мезомерного (резонансного) и стерического эффектов.
В частности это влияние сказывается следующим образом:
1. Электронодонорные заместители Х виниловых мономеров*, такие как алкил (-R), алкокси (-ОR), алкенил (иначе винил – СН=СН2), фенил (-С6Н5) обладают положительным индуктивным эффектом +J , смещают электронное облако двойной связи в мономере от себя и повышают плотность на b-атоме углерода.
 |
| Пропилен * | Винил н-бутиловый эфир | Стирол | Бутадиен | Изобутилен |
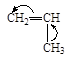
| 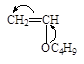
| 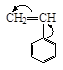
| 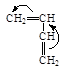
| 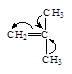
|
*- виниловые мономеры содержат ненасыщенную группу (винил) вида – СН=СН2
Благодаря этому эффекту облегчается и ускоряется присоединение катионов к b-атому углерода.
Следовательно, электронодонорные заместители способствуют протеканию катионной полимеризации с большей скоростью.
2. 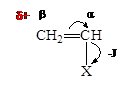 Электроноакцепторные заместители Х виниловых мономеров, такие как нитрильная группа (-CºN), карбонильная группа (-С=О), нитрогруппа обладают отрицательным индуктивным эффектом - J , оттягивают плотность электронного облака на себя, понижают электронную плотность на b-атоме углерода и облегчают протекание анионной полимеризации с большей скоростью.
Электроноакцепторные заместители Х виниловых мономеров, такие как нитрильная группа (-CºN), карбонильная группа (-С=О), нитрогруппа обладают отрицательным индуктивным эффектом - J , оттягивают плотность электронного облака на себя, понижают электронную плотность на b-атоме углерода и облегчают протекание анионной полимеризации с большей скоростью.
| Акрилонитрил | Метилакрилат | Метилметакрилат | Акриламид | Стирол | Бутадиен |

| 
| 
| 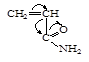
| 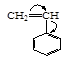
| 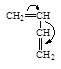
|
У таких мономеров, как стирол и бутадиен в зависимости от природы катализатора и внешней среды, заместители могут проявлять положительный и отрицательный индуктивные эффекты, поэтому эти мономеры могут участвовать и в катионной и в анионной полимеризации.
3. Заместители - атомы галогенов обладают слабым индуктивным эффектом, поэтому полимеризация винил - галогенидов преимущественно протекает по радикальному механизму.
4. Если в мономере два одинаковых заместителя расположены симметрично у a и b-атомов углерода винильной группы, то в этом случае проявляется их экранирующий эффект, и гомополимеризация вообще не протекает.
5. Это характерно для 1.2 –дихлорэтилена 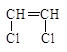 и малеинового ангидрида
и малеинового ангидрида 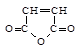 .
.
Совокупное влияние индуктивного, резонансного и стерического эффектов приводит к тому, что каждый тип мономеров может участвовать только в характерном для него виде полимеризации (смотри таблицу 9).
Таковы основные закономерности любого вида цепной полимеризации ЦП.
Мы начнем более подробное знакомство с основной разновидностью ЦП – с радикальной полимеризацией РП.
Таблица 9 - Способность ряда ненасыщенных полимеров к цепной полимеризации
| Тип инициирования | ||||
| МОНОМЕР | радикальный | катионный | анионный | ионно-кординационный |
| Этилен a- олефины 1,1-диалкилолефины Диены-1,3 Стирол и его замещенные Галогенированные олефины Сложные виниловые эфиры Акрилаты, метакрилаты Акрилонитрил, акриамид Простые виниловые эфиры Альдегиды, кетоны Изоцианаты Нитрилы Ацетиленовые соединения | + - - + + + + + + - - - - - | + - + + + - - - - + + - - - | + - - + + - - + + - + + + + | + + + + + + - - - + - - - - |
РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ
Радикальная полимеризация (РП) – это вид цепной полимеризации, т.е. это многократно повторяющийся процесс последовательного присоединения молекул мономера к растущему активному центру.
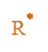 РП протекает за счет раскрытия ненасыщенных (двойной, тройной, сопряженной двойной) p -связей в мономерах и дальнейшего последовательного присоединения молекул мономера к растущему активному центру с образованием химической связи между концевым звеном растущего активного центра и молекулой мономера.
РП протекает за счет раскрытия ненасыщенных (двойной, тройной, сопряженной двойной) p -связей в мономерах и дальнейшего последовательного присоединения молекул мономера к растущему активному центру с образованием химической связи между концевым звеном растущего активного центра и молекулой мономера.
Роль активного центра в радикальной полимеризации играет свободный радикал, т.е. частица, имеющая неспаренный электрон на внешней орбитали.
Радикал при РП обладает электрофильными (электрофильный – это любящий электроны) свойствами. Он стремится завершить заполнение внешней орбитали и поэтому атакует электроны p-связи ненасыщенного мономера, оттягивает электронное облако на себя и раскрывает p-связь. Молекула мономера за счет электрона своей раскрытой p-связи и электрона радикала присоединяется к радикалу:

|
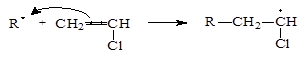
В результате генерируется (образуется) новый радикал, который называют радикал роста.
В радикальной полимеризации участвуют виниловые и диеновые мономеры (смотри в таблице 3 колонки 1, и таблицу 9):
Как любой цепной процесс радикальная полимеризация протекает в 3 стадии:
1. Образование активного центра. На этом этапе происходит образование свободного радикала роста (инициирование). Чаще всего свободный радикал получают благодаря распаду специально вводимых веществ – инициаторов J .
этап а) Распад инициатора на радикалы 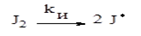
этап б) присоединение к радикалу инициатора молекулы мономера и обрахование радикала роста 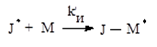
2. Рост цепи. На данной стадии наблюдается постоянное многократное раскрытие p-связи молекул мономера, присоединение их к растущему радикалу с образованием химической связи между концевым звеном растущего радикала и молекулой мономера. Молекулярная масса и размеры макромолекул увеличиваются.
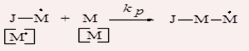
3.
 |
Обрыв цепи. На третьем этапе происходит либо исчезновение активных радикальных центров и прекращение роста макромолекул или передача активных радикальных центров на другие молекулы с прекращением роста одних макромолекул и началом роста других.
Энергия активации всего процесса Еарп включает в себя энергии активации всех трех стадий: инициирования Еаи, роста цепи Еар, обрыва цепи Еао.
Она вычисляется по формуле:
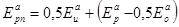
Наибольшая энергия активации Еаи, равная 112÷170 кДж/моль, требуется на 1 стадии – стадии инициирования. Итоговая величина энергии активации всех стадий РП Еарп составляет ~ 83÷90 кДж/моль.
Для виниловых мономеров, у которых в процессе полимеризации двойная p -связь с энергией связи 605,3 кДж/моль раскрывается и превращается в две простые s -связи с энергией 349,5 кДж/моль, можно рассчитать величину теплового эффекта DН:
DН = 2Еs - Е p = 2*349,5 – 605,3 = 93,7 кДж/моль
Реальный тепловой эффект при радикальной полимеризации ниже из-за стерических и кинетических факторов. Обычно тепловой эффект составляет 56-88 кДж/моль
Между величинами теплового эффекта и энергии активации радикальной полимеризации учеными Эвансом и Поляни установлена взаимосвязь:


где А-const, а a - число в пределах от 0 до 1 (0<a<1).
Из данного уравнения следует, что в ряду однотипных реакций полимеризации с ростом теплового эффекта D Н требуется меньшая величина энергии активации Еарп.
На первой стадии инициирования энергия активации Еаи необходима для распада молекул инициатора J на радикалы J × Молекулы инициаторов при распаде могут давать первичные, вторичные или третичные радикалы.
Для образования третичных и вторичных радикалов требуется меньше энергии активации, чем для образования первичных радикалов. Третичные и вторичные радикалы стабильнее (устойчивее) за счет делокализации (распределения, «размазывания») электронного облака между заместителями, по сравнению с первичными, у которых электронное облако локализовано (например, на атоме углерода) (смотри ниже).

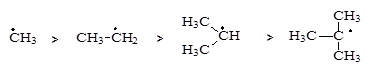
Энергия активации Еаи снижается от первичного к третичному радикалу,
стабильность радикалов растет, скорость реакции РП w р уменьшается,
регулярность присоединения звеньев повышается
В связи с этим на вторичных и третичных радикалах последующая скорость реакции роста цепи будет ниже, чем на первичных. В итоге уменьшается вероятность побочных реакций и увеличивается регулярность присоединения звеньев по типу «голова к хвосту».
Рассмотрим подробнее каждую стадию радикальной полимеризации.
Дата: 2019-02-02, просмотров: 461.