Циклин-зависимые киназы и циклины
Поможем в ✍️ написании учебной работы
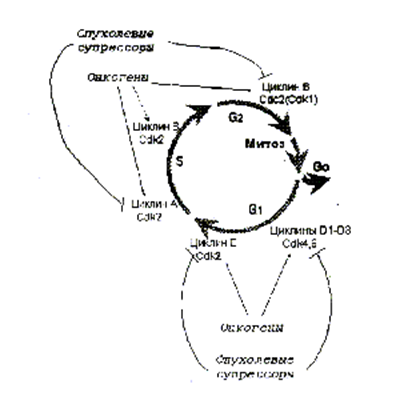 Рис. 32. Движение по клеточному циклу определяется последовательной активацией различных комплексов циклин-CdK. Большинство из них - мишени активирующего действия онкогенов или ингибирующего действия опухолевых супрессоров. Эти данные позволяют предположить, что пятиспиральный домен является ядром всех циклинов. Циклин подобные домены имеют некоторые pRb белки (р35) и фактор транскрипции TFIIB.
Рис. 32. Движение по клеточному циклу определяется последовательной активацией различных комплексов циклин-CdK. Большинство из них - мишени активирующего действия онкогенов или ингибирующего действия опухолевых супрессоров. Эти данные позволяют предположить, что пятиспиральный домен является ядром всех циклинов. Циклин подобные домены имеют некоторые pRb белки (р35) и фактор транскрипции TFIIB.
Регуляция активности Cdk
Известно по крайней мере четыре механизма регуляции активности Cdk: 1. Первичный механизм активации - связывание с субъединицей циклина. 2. Полная активация Сdk путем фосфорилирования с помощью циклин активирующей киназы CAK (cyclin activating kinase) 3. Ингибирование активной Cdk путем связывания с регуляторной субъединицей CKI (cyclin kinase inhibitor). 4. Ингибирование Cdk фосфорилированием ингибирующего сайта. Рассмотрим эти механизмы.1.Связывание с циклином. По определению, активация Cdk требует его связывания с циклином. На рис. 33 представлен такой комплекс. Ясно, что все Cdk не связывают все циклины, так как в их взаимодействии есть значительная специфичность. Биохимические свойства Cdk-циклин взаимодействия варьируют в различных комплексах. Некоторые комплексы, как например циклин В - Cdk1, циклин А - Cdk2 и циклин Е - Cdk2, взаимодействуют с высокой активностью в отсутствии каких-либо дополнительных компонентов или модификаторов. Другие, например циклин А - Cdk2 и циклин Н - Cdk7, не взаимодействуют до тех пор, пока субъединица Cdk не будет фосфорилирована по треониновому остатку. В необычных случаях требуется третья субъединица - Mat1. Рис. 33. Структура Cdk2-циклин А1-АТФ комплекса человека. Cdk2 расположена слева. Циклин А - справа. Т-петля обозначена черной стрелкой. Связывание Cdk2 и циклина А включает взаимодействие между спиралью PSTAIRE Cdk-2 и спиралями 3 и 5 циклина А, а также между спиралью N циклина А и С-терминальной областью Cdk2. Связывание циклина вызывает значительные конформационные изменения в Cdk2. Спираль 1.12 Т-петли расположена в ?-цепи, позволяя спирали PSTAIRE двигаться вовнутрь, чтобы корректировать расположение участка цепей, участвующих в ориентировке фосфата АТФ. Т-петля является уплощенной относительно ее позиции в мономере. 2.Активирующее фосфорилирование Cdk. Связывание циклина А с Cdk2 увеличивает киназную активность последней на несколько порядков. Это объясняется конформационными измененими Cdk. В основном изменения касаются Т-петли Cdk. В несвязанном состоянии Т-петля закрывает сайт связывания с белком-субстратом, что препятствует его взаимодействию с АТФ. Кроме того, небольшая спираль на конце петли (Helix L12) вызывает конформационные изменения АТФ-связывающего сайта, что не позволяет фосфату ориентироваться правильно относительно белка субстрата (Рис. 33). Образование циклин-киназного комплекса происходит благодаря взаимодействию спирали PSTAIRE киназы со спиралями 3 и 5 циклина, а также С-концевой доли киназы и спирали N циклина. При этом спираль L12 распрямляется и превращается в бета-складку, что позволяет спирали PSTAIRE переместиться ближе к АТФ связывающему центру. Перемещение спирали PSTAIRE исправляет конформацию АТФ - связывающего сайта, делая его активным, так как теперь фосфат ориентирован правильно. Кроме того, Т-петля выравнивается, становясь плоской, и сайт связывания с белком-субстратом становится доступным. Дополнительное фосфорилирование треонина-161 Т-петли CAK (cyclin activating kinase) приводит к дополнительной активации Cdk2 в 80-300 раз. Механизм этой активации следующий: фосфат треонина-161 встроен в катионный карман под Т-петлей и действует как центральный узел для сети водородных связей, стабилизирующих взаимодействие Cdk2 и циклина А. При этом Т-петля выравнивается в одной плоскости еще сильнее и приближается к циклину, что приводит к конформационным изменениям формы связывающего белок центра. Других конформационных изменений не происходит. Следовательно, фосфорилирование Cdk необходимо лишь для улучшения связывания с белковым субстратом. К CAK (cyclin activating kinase) высших эукариот относится тримерный комплекс Cdk7-циклин Н-Mat1. Он способен связываться с TFIIH - фактором репарации, а также фактором транскрипции, участвующим в работе РНК полимеразы II. Активность Cdk7 не является регулятором клеточного цикла у позвоночных. 3 Ингибиторы Cdk. Существует два основных семейства CKI (cyclin kinase inhibitor) белков, осуществляющих ингибирование Cdk. Представители первого семейства Cip/Kip (CDK inhibitory protein) - р21, р27 и р57, ингибируют Cdk2 и Cdk4/6 циклиновые комплексы, осуществляя G1 и G1/S контроль. Представители второго семейства INK4 (inhipitor of kinase 4) - р15, р16, р18 и р19, узкоспецифичны для CDK4/6-цD комплексов и осуществляют аналогичные функции. Лучше всего изучена структура молекул семейства Cip/Kip. Эти белки содержат два мотива: короткий мотив на N-конце для связывания с циклином и более сложный сегмент у С-конца для связывания с CDK. Получена кристаллическая структура комплекса Cdk2-циклин А-р27. Структура р27, связанного с комплексом Cdk2-цА, представлена на рис. 34. Малая спираль на С-конце р27 помещается в центр связывания АТФ, чем и объясняется его ингибирующая активность.
Рис. 33. Структура Cdk2-циклин А1-АТФ комплекса человека. Cdk2 расположена слева. Циклин А - справа. Т-петля обозначена черной стрелкой. Связывание Cdk2 и циклина А включает взаимодействие между спиралью PSTAIRE Cdk-2 и спиралями 3 и 5 циклина А, а также между спиралью N циклина А и С-терминальной областью Cdk2. Связывание циклина вызывает значительные конформационные изменения в Cdk2. Спираль 1.12 Т-петли расположена в ?-цепи, позволяя спирали PSTAIRE двигаться вовнутрь, чтобы корректировать расположение участка цепей, участвующих в ориентировке фосфата АТФ. Т-петля является уплощенной относительно ее позиции в мономере. 2.Активирующее фосфорилирование Cdk. Связывание циклина А с Cdk2 увеличивает киназную активность последней на несколько порядков. Это объясняется конформационными измененими Cdk. В основном изменения касаются Т-петли Cdk. В несвязанном состоянии Т-петля закрывает сайт связывания с белком-субстратом, что препятствует его взаимодействию с АТФ. Кроме того, небольшая спираль на конце петли (Helix L12) вызывает конформационные изменения АТФ-связывающего сайта, что не позволяет фосфату ориентироваться правильно относительно белка субстрата (Рис. 33). Образование циклин-киназного комплекса происходит благодаря взаимодействию спирали PSTAIRE киназы со спиралями 3 и 5 циклина, а также С-концевой доли киназы и спирали N циклина. При этом спираль L12 распрямляется и превращается в бета-складку, что позволяет спирали PSTAIRE переместиться ближе к АТФ связывающему центру. Перемещение спирали PSTAIRE исправляет конформацию АТФ - связывающего сайта, делая его активным, так как теперь фосфат ориентирован правильно. Кроме того, Т-петля выравнивается, становясь плоской, и сайт связывания с белком-субстратом становится доступным. Дополнительное фосфорилирование треонина-161 Т-петли CAK (cyclin activating kinase) приводит к дополнительной активации Cdk2 в 80-300 раз. Механизм этой активации следующий: фосфат треонина-161 встроен в катионный карман под Т-петлей и действует как центральный узел для сети водородных связей, стабилизирующих взаимодействие Cdk2 и циклина А. При этом Т-петля выравнивается в одной плоскости еще сильнее и приближается к циклину, что приводит к конформационным изменениям формы связывающего белок центра. Других конформационных изменений не происходит. Следовательно, фосфорилирование Cdk необходимо лишь для улучшения связывания с белковым субстратом. К CAK (cyclin activating kinase) высших эукариот относится тримерный комплекс Cdk7-циклин Н-Mat1. Он способен связываться с TFIIH - фактором репарации, а также фактором транскрипции, участвующим в работе РНК полимеразы II. Активность Cdk7 не является регулятором клеточного цикла у позвоночных. 3 Ингибиторы Cdk. Существует два основных семейства CKI (cyclin kinase inhibitor) белков, осуществляющих ингибирование Cdk. Представители первого семейства Cip/Kip (CDK inhibitory protein) - р21, р27 и р57, ингибируют Cdk2 и Cdk4/6 циклиновые комплексы, осуществляя G1 и G1/S контроль. Представители второго семейства INK4 (inhipitor of kinase 4) - р15, р16, р18 и р19, узкоспецифичны для CDK4/6-цD комплексов и осуществляют аналогичные функции. Лучше всего изучена структура молекул семейства Cip/Kip. Эти белки содержат два мотива: короткий мотив на N-конце для связывания с циклином и более сложный сегмент у С-конца для связывания с CDK. Получена кристаллическая структура комплекса Cdk2-циклин А-р27. Структура р27, связанного с комплексом Cdk2-цА, представлена на рис. 34. Малая спираль на С-конце р27 помещается в центр связывания АТФ, чем и объясняется его ингибирующая активность.  Рис. 34. Структура связи комплекса cdk2-циклин А1 с усеченным пептидом р27. Циклин А1 и cdk2 расположены как на рис. 33. Пептид р27 (затемнен) протянут через вершину комплекса, причем N-конец связан с циклином А1, а С-концевая область на некотором протяжении взаимодействует с субъединицей Сdk2, разрывая ?-складку малой доли и внедряя малую спираль в АТФ-связывающий сайт. Сdk2 в этом комплексе фосфорилирована киназой CAK по Thr160 Т-петли. Представленная структура иллюстрирует эффект фосфорилирования, что приводит к дальнейшему сплющиванию Т-петли относительно ее позиции в нефосфорилированном комплексе. Последовательности, близкие к циклин связывающим мотивам для р21 и р27, были найдены в факторе транскрипции E2F и pRb, которые взаимодействуют с циклином А. Таким образом, Cip/Kip, по-видимлму, ингибируют фосфорилирование этих субстратов, конкурируя с ними за связывание с циклином. Как следует из функциональных особенностей CKI, их активация происходит, когда дальнейшее продолжение клеточного цикла нежелательно. Так, например, лишение клеток питательных веществ приводит к увеличению уровня р27, а внеклеточный ингибитор роста TGF- вызывает увеличение уровня р15. Повреждения ДНК активирует транскрипцию р21 под действием белка р53. Белок p21 способен ингибировать белок PCNA, принимающий участие в репликации ДНК. Таким образом, осуществляется остановка клетки в сверочной точке G1 фазы, что позволяет клетке репарировать повреждения ДНК.
Рис. 34. Структура связи комплекса cdk2-циклин А1 с усеченным пептидом р27. Циклин А1 и cdk2 расположены как на рис. 33. Пептид р27 (затемнен) протянут через вершину комплекса, причем N-конец связан с циклином А1, а С-концевая область на некотором протяжении взаимодействует с субъединицей Сdk2, разрывая ?-складку малой доли и внедряя малую спираль в АТФ-связывающий сайт. Сdk2 в этом комплексе фосфорилирована киназой CAK по Thr160 Т-петли. Представленная структура иллюстрирует эффект фосфорилирования, что приводит к дальнейшему сплющиванию Т-петли относительно ее позиции в нефосфорилированном комплексе. Последовательности, близкие к циклин связывающим мотивам для р21 и р27, были найдены в факторе транскрипции E2F и pRb, которые взаимодействуют с циклином А. Таким образом, Cip/Kip, по-видимлму, ингибируют фосфорилирование этих субстратов, конкурируя с ними за связывание с циклином. Как следует из функциональных особенностей CKI, их активация происходит, когда дальнейшее продолжение клеточного цикла нежелательно. Так, например, лишение клеток питательных веществ приводит к увеличению уровня р27, а внеклеточный ингибитор роста TGF- вызывает увеличение уровня р15. Повреждения ДНК активирует транскрипцию р21 под действием белка р53. Белок p21 способен ингибировать белок PCNA, принимающий участие в репликации ДНК. Таким образом, осуществляется остановка клетки в сверочной точке G1 фазы, что позволяет клетке репарировать повреждения ДНК.Дата: 2019-02-02, просмотров: 1027.