Глава 4. Повреждение ДНК и репарация
Поможем в ✍️ написании учебной работы
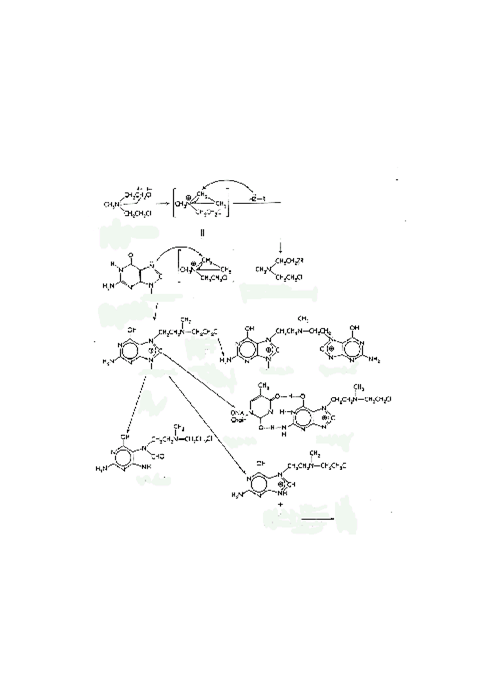 Рис. 29. Механизм действия алкилирующих соединений Полициклические ароматические углеводороды, гетероциклические амины, афлатоксины и ряд других соединений могут формировать объемные аддукты, которые не удаляются простой реакцией переноса. N2- и N7-позиции гуанина являются особенно чувствительными к атаке электрофильного углевода таких соединений, а ионы нитрониума из аминов обычно атакуют С8-позицию гуанина. В обоих случаях формирование C-N-связи предпочтительно. Независимо от позиции, такой аддукт сильно нарушает комплементарное спаривание оснований между цепями и, следовательно, нарушает спиральную структуру ДНК, причем эти искажения узнаются аппаратом репарации. Удаление объемных аддуктов путем вырезания начинается с внесения эндонуклеазного разрыва в той же самой цепи рядом с аддуктом. Затем с помощью экзонуклеазной активности, удаляется 15-20 оснований, включая поврежденное, после чего пробел застраивается ДНК-полимеразой и лигируется для удаления разрыва. С другой стороны, поврежденное основание может удаляться репарирующей гликозилазой. Как и в случае спонтанной депуринизации, утерянное основание узнается как структурное нарушение и репарируется путем вырезания. Существует несколько типов аддуктов, которые не удаляются так легко. Во-первых, кислородные радикалы могут приводить к связыванию клеточных белков с ДНК. Например, ионизирующее излучение (включая космические лучи) производят гидроксил-радикалы, которые ковалентно связывают белки друг с другом и с ДНК. Полагают, что ряд металлов, таких как никель и хром, могут восстанавливаться внутри клетки. В ходе этих процессов могут вырабатываться высоко реакционноспособные разновидности кислорода, которые повреждают мембраны, белки и ДНК. Модифицированные основания ДНК могут быть использованы в качестве маркеров окислительных процессов в клетке или окислительного стресса. Второй тип трудно репарируемых ДНК-аддуктов – это образование поперечных сшивок между цепями ДНК, так называемые «кросслинки». Бифункциональные агенты, которые вызывают такие нарушения, используются в химиотерапии рака, например, циклофосфамиды. Опасность этого типа повреждений состоит не только в разрушении нормальных водородных связей, но и в том, что затрудняется отделение двух цепей ДНК в ходе репликации. Другой класс соединений, вызывающих поперечные сшивки, представляет псорален и его производные, которые используются для экспериментального лечения псориаза. В целом, под действием таких соединений возможны как внутрицепочечные, так и межцепочечные поперечные сшивки. Кроме точечных мутаций, могут иметь место хромосомные сшивки, разрывы и сдвиг рамки считывания. Различные химические соединения, типа бромистого этидия (который используется для визуализации ДНК в ходе гель-электрофореза) и акридина, встраиваются между основаниями и искажают двойную цепь. Во время репликации происходят ошибки в работе полимеразного комплекса, приводящие к вставке или делеции оснований. Если такая ошибка произошла в кодирующей области для какого-либо белка, происходит мутация со сдвигом рамки, т. е. изменяется рамка трансляции и считывание всех аминокислот, кодируемых после сайта мутации. В целом, последствия таких мутаций более серьезны, чем последствия точечных мутаций. Замена единственной аминокислоты может быть критична, но чаще всего нет. Кроме того, приблизительно 1/3 точечных мутаций (обычно в третьей позиции кодона) не приводит к аминокислотной замене. Однако сдвиг рамки может привести к замене большого числа аминокислот, часто приводящей к денатурации или преждевременной терминации белковой цепи. Вышеописанные повреждения ДНК имеют разнообразные вредные последствия. Клетки, находящиеся в состоянии покоя, имеют больше шансов на репарацию повреждений и, следовательно, могут избегать серьезных трудностей. Если геном не может быть репарирован, клетки могут быть уничтожены, когда войдут в стадию репликации. Инактивация генов, кодирующих определенные «критические» белки, может предотвратить репликацию, совместно или нет со смертью клетки, снизить скорость клеточного роста, изменить выживаемость. Однако, в редких случаях рост клетки, напротив, стимулируется. За последние 50 лет стало известно, что повреждения ДНК ассоциированы с неоплазией. Известно, что хромосомные транслокации и даже отдельные точечные мутации способны привести к активации онкогена, а инактивация генов раковых супрессоров дает возможности неконтролируемого клеточного роста. Поэтому для анализа потенциальных канцерогенов разрабатываются специальные тесты, с помощью которых оцениваются повреждения ДНК. Прямой тест на хромосомные повреждения состоит в том, что клетки культуры в лог-фазе обрабатываются химическим соединением, а затем исследуются изменения в сестринских хроматидах. Существуют типы клеток, особенно чувствительных к хромосомным разрывам, появившимся в результате обработки. Второй тип теста состоит в измерении уровня «внеплановой» ДНК-репарации. В этом случае обработанные клетки находятся в состоянии покоя (нет репликации ДНК). Таким образом, включение [3Н]- тимидина в ДНК, возникающее в ходе репарации с вырезанием, является пропорциональным формированию ДНК-аддуктов. Большинство широко используемых методов анализа повреждений ДНК основано на измерении мутагенеза у бактерий. Первый и наиболее широко известный пример такого теста - тест Эймса, названный по имени разработчика (Dr. Bruce Ames, Berkeley, USA). Тест состоит в том, что некоторые штаммы бактерии Salmonella, ауксотрофные по гистидину, выращиваются на агаровой среде, содержащей гистидин. Бактерии растут в виде редких разбросанных колоний. Спонтанно колонии ревертантных бактерий, способных синтезировать собственный гистидин и, следовательно, расти на среде только с глюкозой, возникают редко, однако количество таких мутантов можно повысить, обработав клетки мутагенными химическими соединениями. При низких дозах, количество ревертантов, способных формировать видимые колонии, пропорционально количеству внесенного химического соединения и его эффективности. Высокие дозы мутагена приводят к возникновению столь обширных повреждений ДНК, что снижается жизнеспособность всех клеток, включая мутантные. Кривая дозового ответа является бифазной, вначале возрастающая, затем снижающаяся. Наиболее достоверные измерения эффективности химического соединения обычно получают при относительно низких дозах, нормализуя число мутантов к числу выживших клеток (измеряется параллельно на среде, содержащей гистидин). Существуют специальные штаммы Salmonella, чувствительные к мутагенам, вызывающим сдвиг рамки (интеркалирующие агенты), также как и вызывающим точковые мутации. Интересным свойством ДНК-репарации у бактерий, которое присуще некоторым штаммам Salmonella, является снижение точности репарации при высокой степени повреждения. Обширные повреждения репарируются, но точность такой репарации снижается, что приводит к увеличению скорости возникновения мутаций. Полагают, что такой ответ ведет к возникновению и эволюции белков с измененными функциями. Это может способствовать адаптации организма или выживанию в неблагоприятных условиях. Тест Эймса широко используется для первого скрининга канцерогенов. Промышленная разработка химических или фармакологических препаратов может быть приостановлена из-за высокого мутагенного потенциала, обнаруженного в этом тесте. Однако экстраполяция результатов этого теста применительно к животным и, особенно к человеку, представляется затруднительной. С одной стороны у бактерий отсутствует ферментативная система метаболизма ксенобиотиков и, следовательно, они взаимодействуют лишь с соединениями, не требующими активации цитохромами Р450. Чтобы расширить применение этой системы для широкого спектра соединений, необходимо осуществить биотрансформацию ксенобиотиков. Для этого ксенобиотики обрабатываются экстрактом печени крыс, когда они добавляются к бактериям (крысы предварительно обрабатываются мощными индукторами цитохромов Р450). К таким соединениям, требующим предварительной активации, относятся полициклические ароматические углеводороды или нитрозамины, которые иначе не обнаруживают мутагенного потенциала. Несмотря на это, защитные пути, существующие в клетках человека, не воспроизводятся полностью в этом тесте. Когда тест Эймса впервые был разработан и популяризован, 90% соединений, дающих позитивную реакцию в этом тесте, оценивалось как канцерогены для животных. По настоящим оценкам эта цифра составляет приблизительно 60% (соответствие между крысиными и мышиными канцерогенами оценивается как приблизительно 70%). Несмотря на это, тест привлекателен из-за его низкой стоимости и быстроты выполнения. Некоторые исследователи предполагают, что более точно предсказать канцерогенность соединения можно с использованием нескольких краткосрочных тестов. Например, подразумевается, что соединение является потенциальным мутагеном, если оно дает положительный ответ на бактериях, клетках дрозофилы и животных, а также вызывает высокий уровень обмена между сестринскими хроматидами. Интересно, что увеличение количества тестов лишь незначительно улучшает результаты самого по себе теста Эймса. Ранние обзоры по мутагенности с привлечением теста Эймса и последовательный анализ с использованием различных технологий показали, что мы действительно окружены мутагенами: многие продукты (пережаренное мясо) и другие продукты потребления (краски для волос), ультрафиолетовый свет, радон в болотном газе, космические лучи, количество которых удваивается при авиа перелетах на большой высоте. Таким образом, сохранение нашего здоровья напрямую зависит от эффективности процессов репарации ДНК. К сожалению, для индивидуумов, дефицитных по некоторым ферментам, важность репарации еще более усиливается. Например, при синдроме пигментации ксеродермы (Хeroderma pigmentosium syndrome) репарация повреждений от ультрафиолета нарушается. Такие люди вынуждены избегать солнечного света, у них с высокой частотой развивается рак кожи. Согласно последним исследованиям репарация настолько важна, что некоторые ее пути являются встроенными в процесс репликации.
Рис. 29. Механизм действия алкилирующих соединений Полициклические ароматические углеводороды, гетероциклические амины, афлатоксины и ряд других соединений могут формировать объемные аддукты, которые не удаляются простой реакцией переноса. N2- и N7-позиции гуанина являются особенно чувствительными к атаке электрофильного углевода таких соединений, а ионы нитрониума из аминов обычно атакуют С8-позицию гуанина. В обоих случаях формирование C-N-связи предпочтительно. Независимо от позиции, такой аддукт сильно нарушает комплементарное спаривание оснований между цепями и, следовательно, нарушает спиральную структуру ДНК, причем эти искажения узнаются аппаратом репарации. Удаление объемных аддуктов путем вырезания начинается с внесения эндонуклеазного разрыва в той же самой цепи рядом с аддуктом. Затем с помощью экзонуклеазной активности, удаляется 15-20 оснований, включая поврежденное, после чего пробел застраивается ДНК-полимеразой и лигируется для удаления разрыва. С другой стороны, поврежденное основание может удаляться репарирующей гликозилазой. Как и в случае спонтанной депуринизации, утерянное основание узнается как структурное нарушение и репарируется путем вырезания. Существует несколько типов аддуктов, которые не удаляются так легко. Во-первых, кислородные радикалы могут приводить к связыванию клеточных белков с ДНК. Например, ионизирующее излучение (включая космические лучи) производят гидроксил-радикалы, которые ковалентно связывают белки друг с другом и с ДНК. Полагают, что ряд металлов, таких как никель и хром, могут восстанавливаться внутри клетки. В ходе этих процессов могут вырабатываться высоко реакционноспособные разновидности кислорода, которые повреждают мембраны, белки и ДНК. Модифицированные основания ДНК могут быть использованы в качестве маркеров окислительных процессов в клетке или окислительного стресса. Второй тип трудно репарируемых ДНК-аддуктов – это образование поперечных сшивок между цепями ДНК, так называемые «кросслинки». Бифункциональные агенты, которые вызывают такие нарушения, используются в химиотерапии рака, например, циклофосфамиды. Опасность этого типа повреждений состоит не только в разрушении нормальных водородных связей, но и в том, что затрудняется отделение двух цепей ДНК в ходе репликации. Другой класс соединений, вызывающих поперечные сшивки, представляет псорален и его производные, которые используются для экспериментального лечения псориаза. В целом, под действием таких соединений возможны как внутрицепочечные, так и межцепочечные поперечные сшивки. Кроме точечных мутаций, могут иметь место хромосомные сшивки, разрывы и сдвиг рамки считывания. Различные химические соединения, типа бромистого этидия (который используется для визуализации ДНК в ходе гель-электрофореза) и акридина, встраиваются между основаниями и искажают двойную цепь. Во время репликации происходят ошибки в работе полимеразного комплекса, приводящие к вставке или делеции оснований. Если такая ошибка произошла в кодирующей области для какого-либо белка, происходит мутация со сдвигом рамки, т. е. изменяется рамка трансляции и считывание всех аминокислот, кодируемых после сайта мутации. В целом, последствия таких мутаций более серьезны, чем последствия точечных мутаций. Замена единственной аминокислоты может быть критична, но чаще всего нет. Кроме того, приблизительно 1/3 точечных мутаций (обычно в третьей позиции кодона) не приводит к аминокислотной замене. Однако сдвиг рамки может привести к замене большого числа аминокислот, часто приводящей к денатурации или преждевременной терминации белковой цепи. Вышеописанные повреждения ДНК имеют разнообразные вредные последствия. Клетки, находящиеся в состоянии покоя, имеют больше шансов на репарацию повреждений и, следовательно, могут избегать серьезных трудностей. Если геном не может быть репарирован, клетки могут быть уничтожены, когда войдут в стадию репликации. Инактивация генов, кодирующих определенные «критические» белки, может предотвратить репликацию, совместно или нет со смертью клетки, снизить скорость клеточного роста, изменить выживаемость. Однако, в редких случаях рост клетки, напротив, стимулируется. За последние 50 лет стало известно, что повреждения ДНК ассоциированы с неоплазией. Известно, что хромосомные транслокации и даже отдельные точечные мутации способны привести к активации онкогена, а инактивация генов раковых супрессоров дает возможности неконтролируемого клеточного роста. Поэтому для анализа потенциальных канцерогенов разрабатываются специальные тесты, с помощью которых оцениваются повреждения ДНК. Прямой тест на хромосомные повреждения состоит в том, что клетки культуры в лог-фазе обрабатываются химическим соединением, а затем исследуются изменения в сестринских хроматидах. Существуют типы клеток, особенно чувствительных к хромосомным разрывам, появившимся в результате обработки. Второй тип теста состоит в измерении уровня «внеплановой» ДНК-репарации. В этом случае обработанные клетки находятся в состоянии покоя (нет репликации ДНК). Таким образом, включение [3Н]- тимидина в ДНК, возникающее в ходе репарации с вырезанием, является пропорциональным формированию ДНК-аддуктов. Большинство широко используемых методов анализа повреждений ДНК основано на измерении мутагенеза у бактерий. Первый и наиболее широко известный пример такого теста - тест Эймса, названный по имени разработчика (Dr. Bruce Ames, Berkeley, USA). Тест состоит в том, что некоторые штаммы бактерии Salmonella, ауксотрофные по гистидину, выращиваются на агаровой среде, содержащей гистидин. Бактерии растут в виде редких разбросанных колоний. Спонтанно колонии ревертантных бактерий, способных синтезировать собственный гистидин и, следовательно, расти на среде только с глюкозой, возникают редко, однако количество таких мутантов можно повысить, обработав клетки мутагенными химическими соединениями. При низких дозах, количество ревертантов, способных формировать видимые колонии, пропорционально количеству внесенного химического соединения и его эффективности. Высокие дозы мутагена приводят к возникновению столь обширных повреждений ДНК, что снижается жизнеспособность всех клеток, включая мутантные. Кривая дозового ответа является бифазной, вначале возрастающая, затем снижающаяся. Наиболее достоверные измерения эффективности химического соединения обычно получают при относительно низких дозах, нормализуя число мутантов к числу выживших клеток (измеряется параллельно на среде, содержащей гистидин). Существуют специальные штаммы Salmonella, чувствительные к мутагенам, вызывающим сдвиг рамки (интеркалирующие агенты), также как и вызывающим точковые мутации. Интересным свойством ДНК-репарации у бактерий, которое присуще некоторым штаммам Salmonella, является снижение точности репарации при высокой степени повреждения. Обширные повреждения репарируются, но точность такой репарации снижается, что приводит к увеличению скорости возникновения мутаций. Полагают, что такой ответ ведет к возникновению и эволюции белков с измененными функциями. Это может способствовать адаптации организма или выживанию в неблагоприятных условиях. Тест Эймса широко используется для первого скрининга канцерогенов. Промышленная разработка химических или фармакологических препаратов может быть приостановлена из-за высокого мутагенного потенциала, обнаруженного в этом тесте. Однако экстраполяция результатов этого теста применительно к животным и, особенно к человеку, представляется затруднительной. С одной стороны у бактерий отсутствует ферментативная система метаболизма ксенобиотиков и, следовательно, они взаимодействуют лишь с соединениями, не требующими активации цитохромами Р450. Чтобы расширить применение этой системы для широкого спектра соединений, необходимо осуществить биотрансформацию ксенобиотиков. Для этого ксенобиотики обрабатываются экстрактом печени крыс, когда они добавляются к бактериям (крысы предварительно обрабатываются мощными индукторами цитохромов Р450). К таким соединениям, требующим предварительной активации, относятся полициклические ароматические углеводороды или нитрозамины, которые иначе не обнаруживают мутагенного потенциала. Несмотря на это, защитные пути, существующие в клетках человека, не воспроизводятся полностью в этом тесте. Когда тест Эймса впервые был разработан и популяризован, 90% соединений, дающих позитивную реакцию в этом тесте, оценивалось как канцерогены для животных. По настоящим оценкам эта цифра составляет приблизительно 60% (соответствие между крысиными и мышиными канцерогенами оценивается как приблизительно 70%). Несмотря на это, тест привлекателен из-за его низкой стоимости и быстроты выполнения. Некоторые исследователи предполагают, что более точно предсказать канцерогенность соединения можно с использованием нескольких краткосрочных тестов. Например, подразумевается, что соединение является потенциальным мутагеном, если оно дает положительный ответ на бактериях, клетках дрозофилы и животных, а также вызывает высокий уровень обмена между сестринскими хроматидами. Интересно, что увеличение количества тестов лишь незначительно улучшает результаты самого по себе теста Эймса. Ранние обзоры по мутагенности с привлечением теста Эймса и последовательный анализ с использованием различных технологий показали, что мы действительно окружены мутагенами: многие продукты (пережаренное мясо) и другие продукты потребления (краски для волос), ультрафиолетовый свет, радон в болотном газе, космические лучи, количество которых удваивается при авиа перелетах на большой высоте. Таким образом, сохранение нашего здоровья напрямую зависит от эффективности процессов репарации ДНК. К сожалению, для индивидуумов, дефицитных по некоторым ферментам, важность репарации еще более усиливается. Например, при синдроме пигментации ксеродермы (Хeroderma pigmentosium syndrome) репарация повреждений от ультрафиолета нарушается. Такие люди вынуждены избегать солнечного света, у них с высокой частотой развивается рак кожи. Согласно последним исследованиям репарация настолько важна, что некоторые ее пути являются встроенными в процесс репликации.Дата: 2019-02-02, просмотров: 744.