Органо- и тканеспецифичность в распределении токсинов
Поможем в ✍️ написании учебной работы
Печень
Печень, как основной метаболический орган тела, играет центральную роль в токсикологии. Это крупнейшая железа, составляющая приблизительно 2% массы тела взрослого человека, и выполняющая множество физиологических функций. Это и расщепление углеводов и регуляция уровня глюкозы в крови, запас витамина А, секреция альбумина и широкого спектра других экзокринных и эндокринных продуктов. Печень получает значительную фракцию (25%) сердечного выброса. 5% от этого количества поступает напрямую из артериального русла, остальные 20% - из портальной вены. Венозная кровь обогащена питательными веществами, которые всасываются из пищеварительного тракта. Они поступают в печень для обработки, прежде чем они поступят в основной круг кровообращения. Таким образом, токсические соединения, принимаемые орально, не попадают в кровяное русло, поскольку они удаляются на «первом перевале метаболизма». По этой причине у рызунов печень является главной мишенью для токсичных соединений. У более крупных животных и человека в том числе, первичный метаболизм в печени не настолько важен, поскольку мишенью могут являться и другие периферические ткани. Печень состоит из долек, так чтобы экспозиция гепатоцитов плазмой стала максимальной. Каждая из 106 долек имеет диаметр 1 мм и содержит в центре капилляр, отходящий от центральной вены, для сбора крови, после того, как она перколирует между гепатоцитами. Гепатоциты располагаются в виде связок, разделяемых синусоидальными капиллярами в которых эндотелиальные клетки формируют прерывистый барьер (в отличие от большинства других органов, где эти клетки плотно соединены). С одной стороны каждый гепатоцит омывается плазмой крови, с другой стороны имеется микровиллярная мембрана, которая формирует границу. Каналикулы (малые каналы) несут желчь, содержащую плохо растворимые продукты, назад к краю дольки, т.е. туда, где желчные канальцы локализуются вблизи ответвлений печеночной артерии и портальной вены. Среди других типов клеток, обнаруживаемых в печени, наиболее подходящими для токсикологии являются фибробласты. Клетки этого типа являются составляющими соединительной ткани, секретируют коллаген и эластин (структурные фибриллярные белки), которые поддерживают должное расположение клеток. В печени они обычно немногочисленны, однако при определенных болезнях некоторых органов, они появляются в пространстве, обычно занятом другими типами клеток. Такое патологическое состояние принято называть фиброзом. Гипоксия. Патологические эффекты кислородного голодания не ограничиваются печенью, а имеют место в большинстве тканей. Гепатоциты чувствительны к гипоксии. Среди многих случаев гипоксии, наиболее распространенным является воздействие монооксидом углерода (подобным же образом действует сульфид водорода). Этот газ хорошо связывается с гемоглобином, вытесняя кислород. В результате ткани испытывают кислородное голодание, митохондриальное дыхание замедляется или останавливается, запас АТФ в клетках истощается. Это приводит к тяжелым последствиям. Клетки способны генерировать некоторое количество энергии анаэробным гликолизом, при этом образуется молочная кислота. Тем временем ионные насосы, необходимые для поддержания надлежащего ионного состояния, инактивируются, что приводит к разбуханию клетки, нарушению рН регуляции и остановке белкового синтеза. Уровень кальция в цитоплазме (в норме 0,1 µМ) достигает 1мМ, активируя ферменты деградации. Происходит утечка содержимого лизосом. Результатом длительного кислородного голодания является смерть клетки (некроз). Отметим, что критическим признаком патологической гипоксии является потеря надлежащего ионного состояния. Действие ряда токсинов, направленное на ионные каналы, может приводить к такому же результату. Цианиды. Основной макромолекулярной мишенью для цианидов является цитохром оксидаза, компонент митохондриальной цепи транспорта электронов. Ингибирование этого фермента приводит к остановке клеточного дыхания и синтеза АТФ, и в результате к гибели клетки. Летальность для организма имеет место при относительно низких дозах (LD50 для человека LD50 1мг/кг). Человек может подвергнуться воздействию различными способами, включая диету (высвобождение из цианогенных гликозидов, содержащихся в миндале). Цианид выделяли из фруктовых косточек, который являлся активным веществом в малоэффективном, но некогда популярном антираковом препарате – “Laetrile”. Эффект воздействия цианидов можно наблюдать и в дикой природе, например в нескоординированном поведении малиновки, после съедания определенных ягод. Организм человека способен детоксифицировать низкую дозу цианидов путем превращения в тиоцианат, который легко экскретируется. Это происходит с помощью фермента роданазы, который переносит серу тиосульфата на цианид. Хотя эндогенный запас этого соединения быстро истощается, он может быть восполнен инъекцией тиосульфата в кровь. Такие инъекции действительно применяются при отравлениях цианидами. Однако, митохондрии выдерживают блокаду лишь в течение очень короткого времени, а затем клетки погибают. Таким образом, необходим способ удаления цианида из цитохром оксидазы, до того как родазана закончит его превращение в тиоцианат. Этого можно достичь путем инъекции жертве нитрита натрия одновременно с тиосульфатом натрия. Нитрит реагирует с оксигемоглобином (содержащим гем с окисленным атомом железа) превращая его в метгемоглобин (атом железа в восстановленном состоянии). Метгемоглобин связывается с цианидом и удаляет его из цитохром оксидазы. Более чем 40% гемоглобина может быть превращено в метгемоглобин без последствий (хотя для обычной терапии это 25%). Известны случаи, когда простая инъекция нитрита помогала вернуть сознание жертве. Однако, поскольку метгемоглобин способен быстро превратиться обратно в оксигемоглобин и вновь связаться с цитохром оксидазой, инъекции тиосульфата имеют большое значение для более интенсивного удаления цианида. Сообщалось, что эта комбинация увеличивает LD50 для овецв 16 раз. Фактором, ограничивающим лечение, является эффективность удаления цианида из центральной нервной системы. Холестазия. Желчь служит основным источником выведения плохо растворимых продуктов отхода, включая продукты реакции II- фазы метаболизма. Желчь содержит соли и глюкозу приблизительно в той же концентрации, что и плазма, а концентрация производных холестерола с функциональными группами карбоксильных кислот является в 100 раз выше, чем в крови. В желчи они оказывают эффекты подобные детергентам, и в кишечнике (где желчные протоки пустые) они эмульгируют жиры и способствуют усвоению гидрофобных витаминов. Время жизни эритроцитов составляет приблизительно 120 дней, после чего их содержимое деградирует. Это приводит к образованию значительного количества плохо растворимого гемина (из гемоглобина), который удаляется с желчью. Гемин окисляется с образованием билирубина, который связывается с альбумином и в таком виде переносится кровью и откладывается в печени. В гепатоцитах происходит конъюгация билирубина с глюкуроновой кислотой и секреция в желчные каналы. Конъюгаты деградируют с помощью кишечной микрофлоры и в основном (80-90%) экскретируются. Остаток вновь всасывается в кровяное русло через портальную вену (некоторые ксенобиотики также подвергаются такой энтеропеченочной циркуляции). Застой желчного потока приводит к ухудшению распределения билирубина, который начинает накапливаться и откладываться в селезенке, костном мозге, почках и коже. Последнее приводит к появлению желто-оранжевого цвета кожи, указывающего на желтуху. Причиной желтухи может стать усиление выработки билирубина (как при гемолитической анемии) либо слабая конъюгация с глюкуроновой кислотой (желтуха новорожденных). Токсичные соединения часто вызывают холестазию, нарушая секреторный процесс в каналикулярной мембране и выведение конъюгатов из гепатоцитов в желчь. Секреция желчных солей также нарушается, что приводит к внутриклеточному накоплению этих детергентоподобных соединений и в дальнейшем к повреждению клеточных мембран. Как сообщалось, в число соединений, вызывающих холестазию, входят некоторые анаболики и стероиды-контрацептивы. Накопление триглицеридов в печени само по себе не опасно и этот процесс легко обратим. Это неспецифический симптом неспособности гепатоцитов секретировать липопротеины такие как VLDL (липопротеины очень низкой плотности) в силу различных причин. Например, ингибирование (специфическое или вторичное) белкового синтеза может вызвать дефицит белковых компонентов этого комплекса, предотвращая секрецию липидов. Аналогично, холин-дефицитная диета может привести к дефициту фосфолипидных компонентов комплекса. Ряд соединений (оротовая кислота) ослабляют секрецию, которая очевидно является очень чувствительной к токсичному инсульту. Основной причиной ожирения печени является усиление всасывания или образования жирных кислот. Например, повышенное потребление этанола приводит к избытку ацетата и NADH благодаря действию алкогольдегидрогеназы и альдегиддегидрогеназы. CH3CH2OH --> CH3CHO --> CH3COOH --> АцетилКоА (ЦТК) НAД+ + H+ --> НAДH При поступлении в цикл трикарбоновых кислот ацетат увеличивает образование жирных кислот, а НAДH замедляет превращение жирных кислот в ацетат. Заметим, что образование карбоксикислот может также иметь место в этой цепочке. Микробы потенциально являются полезными в распределении жира, катализируя первоначальное гидроксилирование алканов, на которые затем действуют алкоголь- и альдегиддегидрогеназы. Кровь освобождается от этилового спирта в основном (75%) при помощи его метаболизма в печени. У индивидов с высокой концентрацией крови скорость метаболизма универсальна и составляет порядка 10гр/час, независимо от концентрации алкоголя. Метаболизм других соединений может происходить двумя способами. С одной стороны этанол индуцирует активность цитохромов Р450. С другой стороны – этанол является предпочтительным субстратом для некоторых изоферментов, особенно в высоких концентрациях, приводя к снижению скорости метаболизма некоторых фармацевтических препаратов и вызывая эффект передозировки. Например, исследования показали, что при потреблении пережаренного мяса в крови у добровольцев регистрировался диметилнитрозоамин только лишь при употреблении мяса совместно с алкоголем. Иначе нитрозоамины удаляются в печени за одну стадию метаболизма. Цирроз. Долговременное действие этанола на печень может привести к хроническому состоянию, когда свойственные печени функции угнетаются. В основе этой болезни лежит ослабление гепатоцитов, вероятно из-за накопления ацетальдегида, который является продуктом действия алкогольдегидрогеназы. Это высоко реакционноспособное соединение, которое может формировать основание Шиффа с аминогруппами белков и возможно с ДНК, что приводит к некрозу. Недавно было показано, что ацетальдегид в присутствии избытка этанола ускоряет формирование как долгоживущих ацетатов c основаниями ДНК, что, возможно, объясняет корреляцию между потреблением алкоголя и случаями рака. В ответ на это стимулируется регенерация и деление выживших гепатоцитов для восстановления их количества. Однако когда эти процессы происходят хронически, тонкая архитектура долек теряется. Фибробласты являются относительно устойчивыми к токсическим эффектам алкоголя и могут замещать гепатоциты, нарушая поток крови и желчи, образуя полосу рубцовой ткани (расположение коллагена). Печеночные клетки регенерируют в узелки, которые не столь хорошо перфузируются. Таким образом, они не могут эффективно удалять токсичный материал и выполнять нормальные регуляторные и гомеостатические функции. Цирроз характеризуется некрозом и фиброзом с узелковой регенерацией. Когда повреждения накапливаются в достаточном количестве, это состояние приводит к фатальному исходу. При низком уровне всасывания этанола, образование ацетальдегида не является серьезной проблемой. Однако, у некоторых индивидов, особенно в определенных этнических группах, активность ацетальдегид дегидрогеназы очень низка, так что даже всасывание небольшой дозы алкоголя приводит к болезненному состоянию. Этот синдром часто наблюдался в индустриальных районах. Исследования показали, что некоторые рабочие подвергались воздействию соединения, которое является ингибитором алкоголь дегидрогеназы. Это антиоксидант («Disulfirame» или “Antabuse”), который ранее использовался для лечения алкоголиков, чтобы предотвратить всасывание этанола и, следовательно, вредные последствия его действия (т.е. цирроз). Пациенты должны находиться под наблюдением, поскольку прием алкоголя во время лечения весьма опасен. Канцерогенез печени. В отсутствие убедительных эпидемиологических доказательств, химическое соединение может быть отнесено к классу канцерогенов, если оно вызывало рак у подопытных животных. Не все соединения, дающие положительную реакцию в бактериальных тестах на мутагенность, оказываются канцерогенами животных. Проведение стандартных тестов на животных требует больших затрат ($0.5 млн. и более) и занимает около 2-х лет. Чтобы снизить затраты и ускорить получение результатов, разрабатывают тесты по инициации/ промоции. В таких тестах обычно использовали кожу мышей, но полезно также использование печени крыс, поскольку этот орган является основной мишенью для химических соединений. Когда тесты на животных только начинали применяться, в дозо-зависимых экспериментах на крысах, получавших единственную дозу канцерогена, например диэтилнитрозоамина, было продемонстрировано, что число случаев рака является нелинейной функцией от дозы канцерогена. Обычно число случаев рака пропорционально дозе в степени n, где n=3 и более. Оказалось, что вероятность развития рака выше, если дозы канцерогена достаточно чтобы вызвать некроз органа-мишени. Таким образом, повреждение клеток и клеточная смерть дает некоторое преимущество редким раковым клеткам и способствует развитию опухоли. Предполагалось, что некроз стимулирует процессы регенерации клеток, в которых выжившие клетки размножаются, чтобы заполнить образовавшиеся пробелы. В печени, где в норме клетки не делятся, этот процесс позволяет нестабильным клеткам, с мутациями в ДНК, увеличивать степень отклонения от нормы, приобретать черты агрессивного роста, и окончательно формировать опухоль. Эти наблюдения привели к разработке модели, основанной на крысиных гепатоцитах, для тестирования соединений, способствующих инициации и промоции опухолей. Крысы подвергались частичной гепатоэктомии, при которой половина или более печени удалялась. Это стимулировало синтез ДНК в оставшихся гепатоцитах. Спустя 12 часов крысы получали низкую дозу канцерогена, которая сама по себе не приводила к развитию опухоли. Этот шаг являлся «инициацией». Поскольку синтез ДНК продолжался, полученные повреждения с большей вероятностью приводили к появлению мутаций, чем в неделящихся клетках. В отсутствии частичной гепатоэктомии, клетки способны успешно репарировать большее количество повреждений ДНК, и количество возникающих опухолей будет значительно ниже. Как только повреждение ДНК зафиксировано (т.е. индуцированы мутации), следующим шагом является стимулирование (промотирование) опухолей печени. Подопытные крысы получали тетрахлорид углерода (CCl4) с питьевой водой. Это соединение подвергается восстановлению в печени при участии цитохрома Р450, с образованием хлорид-иона (безвредного) и трихлорметил радикала (.CCl3). Последний очень токсичен, атакует ненасыщенные липиды, удаляя радикал .Н. Липидные радикалы связываются с О2, приводя к формированию пероксидов липидов, которые в свою очередь формируют радикалы в цепной реакции. В тех клетках, где защита недостаточна, это приводит к смерти. Крысы продолжают пить воду с CCl4 в течение 10-12 недель, что обеспечивает условия, стимулирующие клеточное деление и восполнение потерь от некроза. Использование опухолевых промоторов, таких как CCl4, иллюстрирует «устойчивость гепатоцитарной модели». Используемый промотор для проявления токсичных свойств нуждается в метаболизме цитохромом Р450. Модель имеет ряд преимуществ, характерных для инициированных гепатоцитов. По неясным причинам в инициированных гепатоцитах экспрессия цитохромов Р450 значительно снижается, а экспрессия ферментов 2-й фазы увеличивается. В таких клетках не происходит эффективный, с образованием радикалов, метаболизм CCl4, в отличие от неинициированных клеток, а сами клетки будут иметь селективное преимущество. Они будут расти лучше, чем окружающие клетки, которые постепенно повреждаются под действием активности цитохромов Р450. Не все промоторы действуют таким образом. Вместо добавления CCl4 в воду, стимулировать опухоли можно при помощи холин- или метионин-дефицитной диеты. Это затрудняет метилирование ДНК и, следовательно, изменяет экспрессию генов, возможно благоприятным образом для генов, ответственных за стимуляцию роста. ТХДД также является соединением, стимулирующим канцерогенез в печени крыс. Он не метаболизируется, но изменяет экспрессию генов, опосредованную Ah-рецептором. Механизм его действия малопонятен. Конечным результатом схемы инициации/промоции является рак печени, который можно наблюдать у подопытных животных через несколько месяцев. Можно наблюдать за постепенным развитием опухолей. Спустя несколько недель после стимулирования, в дольках печени крыс обнаруживаются очаги в количестве 1000 и более на печень. Центрами очагов являются группы клеток, предположительно одного происхождения, которые отличаются от нормальных клеток обычно по размеру, но могут отличаться и по другим критериям. Например, в этих клетках может быть значительно увеличена или снижена активность определенных ферментов. С увеличением времени обработки канцерогеном размер очагов увеличивается, однако лишь небольшой процент (около 1%) со временем развивается в опухоль. Клетки очагов, особенно на поздних стадиях развития, обнаруживают черты типичных раковых клеток, таких как абнормальное число хромосом, абберантные или поврежденные хромосомы или митозы. Иногда внутри большого очага можно обнаружить малый участок, причем клетки малого очага более абнормальны, чем окружение. Окончательно некоторые очаги перерастают в автономные узелки, продолжая рост уже без дополнительных внешних стимулов, приобретая злокачественный характер. Модель с использованием печени крыс может быть использована для тестирования химических соединений по их действию в качестве инициатора или промотора рака. Потенциальные инициаторы могут быть также проверены в бактериальных тестах на генотоксичность, однако эти тесты менее определенны. Предположим, кто-либо хочет проверить является ли соединение Х промотором рака в этой системе. Крыс можно обработать низкой дозой известного инициатора рака, например диэтилнитрозоамина (после соответствующей гепатоэктомии), а затем добавить соединение Х в питьевую воду. Спустя месяц подсчитывается число очагов или опухолей в печени (заметим, что таким образом было показано, что эстроген стимулирует опухолеобразование в печени крыс). Во время появления первых противозачаточных таблеток, у некоторых женщин наблюдалось развитие доброкачественной аденомы печени, которое прекращалось после отмены таблеток. В таких тестах важно подобрать подходящий контроль. Обычно крысы обрабатываются либо известным инициатором, либо известным промотором или же соединением Х высокой, но толерантной дозы (что обычно определяется заранее) вместе или без известного инициатора или промотора, в зависимости от целей теста. В целом полагают, что доза инициатора влияет на число очагов, а длительность применения промотора определяет, насколько сильно эти очаги будут развиваться. Применение промотора позволяет обнаружить очаги, а изучение дозо-зависимости позволяет достичь линейности. Модель устойчива к развитию некрозов, которые обычно имеют место при высокой дозе инициатора. Ограничением применения моделей на основе печени крыс и кожи мышей является то, что соединения могут обнаруживать тканеспецифичность действия. Так бензо[а]пирен и эфиры форбола могут использоваться в модели только с мышиным эпителием. Диэтилнитрозоамин и тетрахлорид углерода не метаболизируются клетками эпидермиса мышей, в отличие от печени крыс. Понимание тканеспецифичности помогает глубже понять механизм действия соединений и область их применения. В качестве примера можно привести развитие карциномы слизистой оболочки носа крыс под действием фенацетина (производное ацетаминофена, образуется in vivo). Фенацетин метаболизируется клетками эпителия с образованием токсичного иминохинона. Высокая доза фенацетина приводит к некрозу клеток и усилению деления выживших клеток, что предположительно является причиной возникновения рака. Проблема экстраполяции результатов, полученных на одном виде животных на другой вид (или на человека), далеко не тривиальна. Например, более 25 лет назад было замечено, что некоторые соединения способствуют увеличению внутриклеточного содержания пероксисом в печени крыс с 2 до 25% объема. Эти органеллы связаны с мембраной клетки и содержат окислительные ферменты, импортируемые из цитоплазмы. В отличие от митохондрий они не содержат ДНК, РНК или рибосом и не реплицируются автономно. Пероксисомы включают ферменты катализирующие окисление липидов, Р450, которые катализируют окисление алканов, определенные оксидазы (Д-амино кислот), образующие пероксид. Некоторые соединения (клофибрат) индуцируют пролиферацию пероксисом в печени крыс, и их применение в количестве 1 грамма в день снижает уровень липидов в крови. Другой класс соединений включает пластмассы типа ди-(2-этилгексилфталата),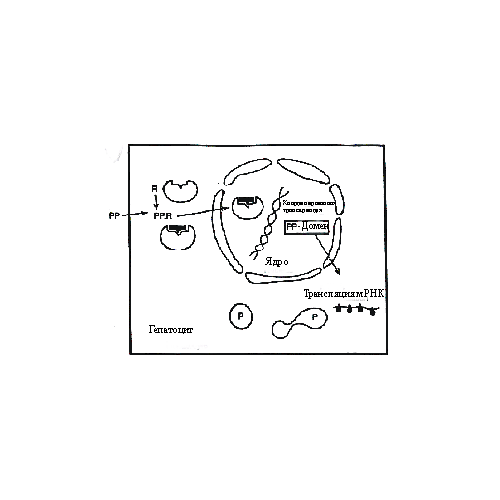 Рис. 10. Предположительный механизм индукции пролиферации пероксисом ксенобиотиками. широко распространенного в окружающей среде. Содержание фталата в пластмассе может доходить до 40%, и это соединение легко вымывается в воде. Соединение дает отрицательный ответ в тесте на генотоксичность, однако действует как промотор рака в печени крыс. Согласно одной из гипотез, фтален стимулирует пролиферацию пероксисом, что приводит к увеличению уровня пероксида. В подтверждение этой теории показано, что назначение антиоксидантов может ингибировать развитие рака под действием фталена. Несмотря на стимулирование пероксисомной пролиферации у крыс, эти соединения неэффективны в отношении других видов (собак, морских свинок, резус-макак, человека). Поэтому результаты тестов, основанных на использовании крысиной печени неприменимы для человека. Недавние исследования показали, что эффект пероксисомной пролиферации опосредован рецептором, который действует в ядрах клеток, стимулируя пролиферацию органелл. Рис. 10 иллюстрирует механизм действия, который аналогичен действию Ah-рецептора или семейства стероидных рецепторов, стимулирующих транскрипцию генов. Соединение, стимулирующее пролиферацию пероксисом (пероксисомный пролифератор, РР) попадая в клетку путем диффузии через плазменную мембрану, связывается со специфическим белком-рецептором (R), который в свою очередь обладает высокой аффинностью к специфичным сайтам ДНК. Это означает, что пероксисомный пролифератор запускает транскрипцию батареи генов (РР-домен или плейотропный ответ). Показано, что такие пероксисомные пролифераторы как клофибрат, ципрофибрат и ди-(2-этилгексил)-фталат увеличивают скорость транскрипции генов, кодирующих ферменты, отвечающие за β-окисление жирных кислот. Увеличение уровня специфичных мРНК ведет к усилению синтеза специфичных ферментов, которые накапливаются в каналах гладкого ЭПР, что приводит к формированию многочисленных пероксисом. Структура соединений (рис. 11), стимулирующих пролиферацию пероксисом, настолько различна, что трудно допустить, что их действие опосредовано рецептором. Рецепторы обычно обнаруживают значительную стереоспецифичность по отношению к лигандам. Сейчас полагают, что с рецептором связываются метаболиты, которые более сходны по свойствам. Возможно, эти соединения имеют сходство с некими эндогенными лигандами (липидами), взаимодействие которых с рецептором приводит к модулированию дифференциации и функций клеток. Возникает также предположение, что стимуляторы пролиферации могут нарушать функции клеток каким-то иным способом, а не стимулированием пролиферации пероксисом.
Рис. 10. Предположительный механизм индукции пролиферации пероксисом ксенобиотиками. широко распространенного в окружающей среде. Содержание фталата в пластмассе может доходить до 40%, и это соединение легко вымывается в воде. Соединение дает отрицательный ответ в тесте на генотоксичность, однако действует как промотор рака в печени крыс. Согласно одной из гипотез, фтален стимулирует пролиферацию пероксисом, что приводит к увеличению уровня пероксида. В подтверждение этой теории показано, что назначение антиоксидантов может ингибировать развитие рака под действием фталена. Несмотря на стимулирование пероксисомной пролиферации у крыс, эти соединения неэффективны в отношении других видов (собак, морских свинок, резус-макак, человека). Поэтому результаты тестов, основанных на использовании крысиной печени неприменимы для человека. Недавние исследования показали, что эффект пероксисомной пролиферации опосредован рецептором, который действует в ядрах клеток, стимулируя пролиферацию органелл. Рис. 10 иллюстрирует механизм действия, который аналогичен действию Ah-рецептора или семейства стероидных рецепторов, стимулирующих транскрипцию генов. Соединение, стимулирующее пролиферацию пероксисом (пероксисомный пролифератор, РР) попадая в клетку путем диффузии через плазменную мембрану, связывается со специфическим белком-рецептором (R), который в свою очередь обладает высокой аффинностью к специфичным сайтам ДНК. Это означает, что пероксисомный пролифератор запускает транскрипцию батареи генов (РР-домен или плейотропный ответ). Показано, что такие пероксисомные пролифераторы как клофибрат, ципрофибрат и ди-(2-этилгексил)-фталат увеличивают скорость транскрипции генов, кодирующих ферменты, отвечающие за β-окисление жирных кислот. Увеличение уровня специфичных мРНК ведет к усилению синтеза специфичных ферментов, которые накапливаются в каналах гладкого ЭПР, что приводит к формированию многочисленных пероксисом. Структура соединений (рис. 11), стимулирующих пролиферацию пероксисом, настолько различна, что трудно допустить, что их действие опосредовано рецептором. Рецепторы обычно обнаруживают значительную стереоспецифичность по отношению к лигандам. Сейчас полагают, что с рецептором связываются метаболиты, которые более сходны по свойствам. Возможно, эти соединения имеют сходство с некими эндогенными лигандами (липидами), взаимодействие которых с рецептором приводит к модулированию дифференциации и функций клеток. Возникает также предположение, что стимуляторы пролиферации могут нарушать функции клеток каким-то иным способом, а не стимулированием пролиферации пероксисом. 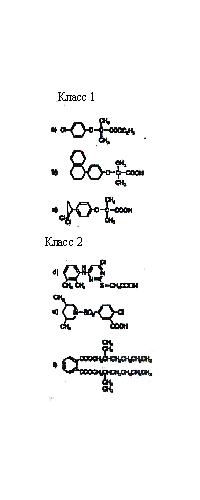 Рис. 11 Химическая структура некоторых соединений, стимулирующих пролиферацию пероксисом. (a) клофибрат: (этил-а-р-хлорфеноксиизобутарат), (b) нафенопин: (2-метил-2-[р-(1,2,3,4-тетрагидро-1-нафтил)- фенокси]-пропионовая кислота, (с) ципрофибрат: (2-[4-(2,2-дихлорциклопропил)фенокси]-2-метил пропионовая кислота, (d) Wy-14643: ([4-хлор-6-(2,3-ксилидино)2-пиримидинилтио] уксусная кислота, (е) тибриковая кислота: (2-хлор-5-(3,5- метилпипердиносульфонил)бензойная кислота, (f) ди(2-этилгексил)фталат. Клофибрат и его структурные аналоги условно обозначены как класс 1 или клофибрат-подобные пролифераторы пероксисом. Пероксисомные пролифераторы, подобные Wy-14643, тибриковой кислоте и ди(2-этилгексил)фталату, которые не обладают структурными сходствами с клофибрат- подобными соединиями, классифицированы как класс 2.
Рис. 11 Химическая структура некоторых соединений, стимулирующих пролиферацию пероксисом. (a) клофибрат: (этил-а-р-хлорфеноксиизобутарат), (b) нафенопин: (2-метил-2-[р-(1,2,3,4-тетрагидро-1-нафтил)- фенокси]-пропионовая кислота, (с) ципрофибрат: (2-[4-(2,2-дихлорциклопропил)фенокси]-2-метил пропионовая кислота, (d) Wy-14643: ([4-хлор-6-(2,3-ксилидино)2-пиримидинилтио] уксусная кислота, (е) тибриковая кислота: (2-хлор-5-(3,5- метилпипердиносульфонил)бензойная кислота, (f) ди(2-этилгексил)фталат. Клофибрат и его структурные аналоги условно обозначены как класс 1 или клофибрат-подобные пролифераторы пероксисом. Пероксисомные пролифераторы, подобные Wy-14643, тибриковой кислоте и ди(2-этилгексил)фталату, которые не обладают структурными сходствами с клофибрат- подобными соединиями, классифицированы как класс 2.
Почки
Функции. Основной функцией почек является очищение крови от продуктов жизнедеятельности, в основном от малых водорастворимых молекул. Функциональной единицей почки является нефрон, небольшая трубка, связанная с кровеносной системой, для образования и выделения мочи. Почка состоит приблизительно из миллиона нефронов (S-образных трубок), которые совместно фильтруют около 180 литров плазмы в день, образуя около литра мочи. Нефрон начинается капсулой Боумена, покрытой сетью капилляров, образующих так называемый мальпигиев клубочек. Из мальпигиева клубочка в верхние отделы почечного канальца фильтруется первичная моча, которая собирается при помощи гломерул, которые представляют собой воронки, препятствующие всасыванию белков с молекулярной массой более 60 кДа (например, альбумин). Малые молекулы (также как и небольшие белки) проходят через это сито, если только они не связаны с альбумином или другими белками большого размера, которые удерживаются в крови. Дополнительно к удалению отходов жизнедеятельности, клетки окаймляющие трубку, должны восстанавливать существенные компоненты плазмы, такие как вода, глюкоза, соли и аминокислоты. Малые белки реабсорбируются или деградируют до аминокислот, которые также всасываются назад в плазму. Позади гломерул располагается проксимальный каналец. Внутри канальца из фильтрованной жидкости реабсорбируются некоторые соединения, а также вода, что приводит к уменьшению объема жидкости на 80%. Здесь же происходит обратный процесс – секреция органических кислот и оснований. Заметим, что органические кислоты типа гербицида 2, 4-D секретируются, тогда как аминокислоты (которые тоже являются органическими) реабсорбируются. Реабсорбция и секреция являются энергозависимыми процессами. Клетки проксимального канальца отличаются высоким содержанием митохондрий, для обеспечения требуемого количества АТФ. Кроме того, в почках, в основном в проксимальных канальцах, наблюдается высокий уровень экспрессии цитохрома Р450, составляющий приблизительно 10-20% от того количества, которое экспрессируется в печени. Таким образом, этот орган также участвует в реакциях биотрансформации. Эти признаки помогают вычислить чувствительность проксимального канальца к токсическим эффектам. Дистальные канальцы, напротив, реже являются мишенью для токсических соединений. Однако существуют два хорошо известных соединения, которые воздействуют на них – это этанол и кофеин. В результате их действия снижается реабсорбция воды и усиливается секреция мочи. Заметим, что объем жидкости, входящей в нефрон, к времени выхода из него снижается на 99%. Эта цифра существенна, поскольку почки являются мишенью для некоторых соединений. Например, антигрибковый препарат амфотерицин В имеет очень узкий диапазон концентраций, при которых он эффективен, но еще не токсичен для клеток животных. Этот препарат применяется лишь в случаях тяжелых инфекций, поскольку у 80% пациентов после его применения развивается почечная токсичность. Аминогликозидные антибиотики. Применение больших доз антибиотиков при бактериальных инфекциях является обычной практикой. Поскольку эти соединения могут накапливаться, почки подвергаются воздействию высоких концентраций. Это может привести к серьезным побочным эффектам. По оценкам, антибиотики являются причиной приблизительно 10% острых почечных нарушений. Токсический потенциал антибиотиков пропорционален содержанию аминогрупп. Тогда наиболее нежелательным является неомицин, который содержит 6 аминогрупп. Следующим является гентамицин с 5 аминогруппами, каннамицин с 4 и стрептомицин с 3. Предположительным объяснением токсического ответа является то, что положительный заряд облегчает связывание антибиотиков с клеточной мембраной, из-за присутствия фосфолипидов обладает отрицательным зарядом. Антибиотики поглощаются эндоцитозом и переносятся в лизосомы. Там они не только не деградируют, но и напротив, накапливаются, что ведет к утечке ферментов деградации из лизосом и в итоге к клеточной смерти. Другим возможным объяснением состоит в том, что мишенью антибиотиков являются бактериальные рибосомы. Несмотря на то, что в ходе эволюции митохондрии отделились от прокариотических организмов достаточно давно, их рибосомы могли сохранить остаточную чувствительность к антибиотикам. Таким образом, воздействие высоких концентраций антибиотиков на почки ведет к потере функций митохондрий, прекращению выработки энергии и нарушениях проходимости ионных каналов. Конечным результатом этого процесса является некроз проксимальных канальцев. Тяжелые металлы. Ртуть, свинец, цинк, кадмий, золото, цис-платина (антираковое химиотерапевтическое соединение) и барий (используется в радиоконтрастной смеси для рентгеновских лучей) являются примерами металлов, которые вызывают некроз почек. Тяжелые металлы атакуют сульфгидрильные группы белков и таким образом инактивируют ключевые ферменты и структурные белки. Это вызывает повреждения как в поверхностных клеточных мембранах (включая конститутивные ионные каналы), так и во внутриклеточных структурах, таких как митохондрии, приводя к нарушениям в транспорте электронов и образовании энергии. Свободные сульфгидрильные группы, например глутатиона, являются защищенными. Известен белок, металлотионин, который парадоксальным образом усиливает токсическое действие тяжелых металлов на почки. Это небольшой белок размером около 10кДа, индуцируется в печени под действием некоторых металлов, таких как кадмий и цинк. Белок секретируется в кровь, где и взаимодействует с металлами, уменьшая их воздействие на клетки. Однако из-за малого размера белок свободно проходит сквозь гломерулы и поступает в проксимальный каналец. Там он всасывается эндоцитозом и деградирует в лизосомах, высвобождая связанные ионы металлов, которые повреждают клетку. Углеводороды нефти. Стратегии, направленные на оптимизацию тестов на токсичность, часто фокусируются на соединениях, под воздействие которых человек попадает особенно часто. Множество людей подвергаются воздействию углеводородов, поэтому с начала 1970-х г. для нефтеперерабатывающей промышленности разрабатывались и внедрялись тестирующие программы. В середине 1970-х существовало множество краткосрочных тестов, с применением различных видов животных, и эти тесты давали разные результаты. Однако в конце 1970-х результаты тестирований на канцерогенез у мышей и крыс показали, что бензин вызывает рак почек у самцов крыс. Этот эффект не был обнаружен у самок крыс и мышей обоих полов. В состав бензина входит более чем 200 углеводородов (алканы, парафины, нафталены, ароматика и т.д.). Оказалось, что насыщенные алканы, особенно изооктановые, оказывают вредное воздействие. Начальные симптомы воздействия изооктанов на почки самцов крыс включали накопление белковых глобул (так называемых гиалиновых капель) в клетках проксимальных канальцев, некроз, отшелушивание и регенерацию клеток. Оказалось, что критическую роль в этом ответе играет небольшой белок, секретируемый печенью, α2-микроглобулин. Синтез этого белка стимулируется андрогенами, поэтому его концентрация в крови самцов много выше, чем у самок. Этот белок имеет размер около 20кДа и легко входит в гломерулы, после чего реабсорбируется в проксимальном канальце и обычно деградирует с высвобождением аминокислот, которые могут быть использованы вновь. При экспозиции самцов крыс бензином, белок, по-видимому, связывается с изооктанами в крови и становится устойчивым к деградации в лизосомах клеток проксимальных канальцев. Это ведет к накоплению гиалиновых капель, нарушениям функций лизосом и гибели клеток. Если при экспозиции самок крыс бензином ввести α2-микроглобулин, то в клетках проксимальных канальцев у них начнут накапливаться гиалиновые капли, что ведет к аналогичным последствиям. Исследование канцерогенеза почек на самцах крыс закономерно привело к возникновению вопроса, является ли реакция человека на экспозицию бензином фактором риска? Такая оценка требует внимательного рассмотрения механизмов канцерогенеза. В результате действия одних элементов этого процесса возникает некроз, что приводит к усилению регенерации. Этот процесс можно рассматривать как общий для развития рака, поскольку он ведет к значительному увеличению скорости клеточного цикла. Клетки большинства материнских тканей, таких как почечная ткань, в норме имеют низкую скорость роста. Но некроз и последующий рост выживших клеток увеличивают эту скорость. Чем быстрее клетки растут, особенно если это поврежденные клетки, тем выше вероятность ошибок репликации ДНК, что является предрасположенностью к неопластическому росту. Действительно, у самцов крыс подвергавшиеся последовательному воздействию некоторых нитрозаминов, а затем бензина, значительно увеличивались темпы развития рака почек. Таким образом, если почки человека (или теоретически другой ткани) отвечает на экспозицию бензином усилением некроза и регенерации, то это может быть фактором риска развития рака. Однако этого не наблюдается. Мыши, морские свинки, собаки и обезьяны также обнаружили устойчивость к подобному исходу. Мы можем объяснить устойчивость у самок крыс более низким уровнем α2-микроглобулина, чем у самцов, но как объяснить это явление у самцов других видов? Возможно, лишь у самцов крыс уровень этого белка настолько высок, причем α2-микроглобулин у других видов обладает низкой аффинностью к изооктану, или же у других видов комплекс не является устойчивым к деградации. В таком случае бензин является фактором риска развития рака почек только для самцов крыс. Подобное явление касается риска развития рака мочевого пузыря под действием сахарина. Обнаружено, что самцы крыс являются чувствительными, а самки крыс и оба пола других видов резистентными. Дальнейшие эксперименты показали, что инъекции большой дозы натриевых (но не калиевых) солей сахарина ведет к формированию кристаллов с α2-микроглобулином, которые высаливаются в моче. Эти кристаллы вызывают абразию эпителия мочевого пузыря, что в свою очередь провоцирует усиление клеточного роста. Таким образом, сахарин натрия действует как промотор опухолеобразования у самцов крыс. Анальгетики. Обезболивающие средства, такие как ацетаминофен широко используются в медицинской практике и в норме являются безопасными. Однако иногда они назначаются в больших количествах в течение длительного срока (годы). В таких случаях может наблюдаться почечная токсичность и даже развиваться рак почек. В ходе метаболизма обычно осуществляется конъюгация по фенол-гидроксильной группе, такие метаболиты легко выводятся. Существует минорный путь метаболизма, это гидроксилирование аминогруппы с последующим восстановлением. При этом образуется иминохинон, электрофильное соединение, способное формировать аддукты с ДНК или белками. Таким образом, введение больших доз анальгетика может вызвать некроз, усиление регенерации и спровоцировать неоплазию. Исследования показали, что повышенная (по сравнению с крысами) чувствительность мышей к токсическим эффектам ацетаминофена может быть связана с двумя факторами. Во-первых, изофермент цитохрома Р450, ответственный за гидроксилирование аминогруппы, у мышей экспрессируется на более высоком уровне, что приводит к образованию большего количества иминохинона. Во-вторых, клетки крыс содержат большее количество глутатиона, который может реагировать по двойной углевод-углеводной связи, устраняя электрофильность молекулы иминохинона. β-лиаза. Определенные углеводороды могут стать причиной некроза почек в результате реакций биотрансформации, которые происходят в этом органе (хроническая экспозиция может приводить к катаракте хрусталика, где также экспрессируется β-лиаза. Детали реакции зависят от специфики соединения и вовлекаемого атома галогена. Например, существует 2 пути метаболизма перхлорэтилена (рис.12). Слева – окислительный путь (формирование эпоксида), в результате образуется ацилхлорид, соединение способное формировать аддукты с нуклеофилами. Справа – тиол глутатиона замещает хлорид на концевом углероде, образуя глутатионовый конъюгат, из которого глутаминовая кислота и глицин удаляются в результате пептидазной активности. Но не вся меркаптуровая кислота образуется при помощи ацетилирования. Неацетилированная форма реабсорбируется клетками проксимального канальца и служит субстратом для β-лиазы. Этот фермент отрезает серу от цистеина, давая молекулу перхлорэтилена, кроме того, что хлорид замещен на сульфгидрильную группу (-SH). Результирующая молекула теряет HCl образуя электрофил, способный к образованию аддуктов с макромолекулами. Ацетилированная меркаптуровая кислота активно секретируется в проксимальных канальцах, после чего деацетилируется и расщепляется β-лиазой.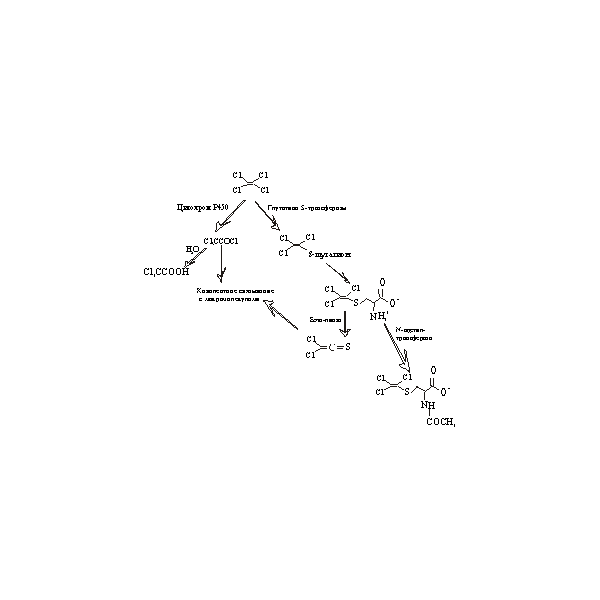 Рис. 12. Метаболизм перхлорэтилена2.1.3. Кожа Кожный покров является важным барьером, защищающим нас от влияния окружающей среды и токсичных веществ. Этот орган является объектом для разнообразных неблагоприятных эффектов. Воздействия на кожу могут быть очень сильными и длиться продолжительный период. Для понимания этих эффектов полезно рассмотреть гистологию кожного покрова. Защитную функцию кожного покрова главным образом выполняет эпидермис. Эпидермис – это внешние дифференцированные (мертвые) клетки, содержащие нерастворимый белок – кератин, окруженный слоем гидрофобного липида. Это обеспечивает превосходный барьер от водо-растворимых веществ, но этот барьер не является совершенным. Гидрофобные вещества способны растворяться в липиде и медленно диффундировать через мертвые клетки, достигая нижний слой живых клеток. Затем они быстро диффундируют через слой живых клеток, попадая в кровяные сосуды, которые располагаются между эпидермисом и дермисом. Небольшие молекулы диффундируют быстрее, чем большие молекулы, поэтому проникают внутрь намного быстрее. Обычно малое количество вещества может быть опасным. Способность небольших гидрофобных молекул проникать через кожу также может быть использовано в фармацевтике для нашей пользы. Медленная диффузия через кожный покров обеспечивает низкий уровень воздействия. Разрушение ороговевшего слоя может происходить из-за физической травмы, либо из-за воздействия химикатов. К последним относятся органические растворители, которые растворяют липидный барьер, едкие вещества, которые разрушающие мертвые клетки, а также моющие вещества, которые могут действовать по обоим механизмам. После повреждения кожного покрова, проникновение через барьер может значительно возрасти, вызвав опасную ситуацию. Химические соединения, проникнувшие через ороговевший слой, могут наносить вред живым клеткам. Тесное взаимодействие этих клеток может разрушаться под таким воздействием, что приводит к накоплению жидкости. Важное свойство кожного покрова заключается в наличии потовых желез. Насчитывается порядка 3 млн. таких маленьких насосов в нашем кожном покрове, которые помогают нам охлаждаться при испарении пота. Соленая вода, выступающая из потовых желез, воздействует на токсичные вещества. Во-первых, пот может растворять сухие вещества, с которыми мы контактируем. Например, может происходить выщелачивание краски из нашей одежды или разрушение полимеров в резине. Во-вторых, продолжительное воздействие влаги на ороговевший слой приводит к разбуханию мертвых клеток, тем самым, увеличивая проникновение гидрофильных веществ через эпидермис. Это работает не в нашу пользу, когда мы купаемся или моемся в загрязненной воде. В разбавленном растворе акваионов скорость, с которой органические растворители проникают в кожу, пропорциональна их концентрации в воде. Эпидермис является наиболее распространенным местом для возникновения рака у людей. Статистические данные на наиболее часто встречающиеся формы рака кожи такие же неполные, как и для других типов рака, которые часто бывают фатальными. Типы рака кожи Карцинома основных клеток. Это наиболее часто встречающаяся форма (60-70% от общей встречаемости рака кожи). Повреждения не метастатические, несмотря на то, что являются опасными. Предположительно, некоторые патологии в значительной степени развиваются из волосяных фолликул, сальных и потовых желез. Карцинома чешуйчатых клеток. Насчитывается порядка 30% от общей встречаемости. Как правило, повреждения заключаются в расхождении клеток по размеру и в видоизменении структуры, что приводит к изменению формы. Разрушения являются агрессивными, но с медленным метаболизмом, обычно требующие нескольких лет, возможно из-за того, что они плохо растут как индивидуальные клетки или являются сильно зависимыми от взаимодействия с соседним дермисом. Этот тип раковых клеток может встречаться в других анатомических органах, покрытых наслоившимися чешуйками эпителия (пищевод, ротовая полость) или в тканях с метаплазией без физиологического контроля (шейка матки). Меланома. Этот тип раковых клеток, развивающихся из меланоцитов, обычно 10%), чем приведенные ранее, но является более опасным. Некоторыевстречается реже ( формы быстро метастазируют, плохо подвергаются прогнозированию. Однако за долгие годы детекция на ранних стадиях была улучшена. Число случаев с 1950 года ежегодно возрастает на 6%, вероятно, отражая увеличивающееся воздействие солнца на население. Химиотерапия рака часто основывается на специфических свойствах раковых клеток, из-за которых клетки делаются чувствительными для уничтожения. Предложенное лечение меланомы иллюстрирует стратегию и ограничения. Предполагаемые клетки меланомы обрабатываются тригидроксифенилаланином. Клетки поглощают это соединение через транспорт ароматических аминокислот. Тригидроксисоединения являются объектом легкого автоокисления, в результате которого образуются супероксиды и хиноны:
Рис. 12. Метаболизм перхлорэтилена2.1.3. Кожа Кожный покров является важным барьером, защищающим нас от влияния окружающей среды и токсичных веществ. Этот орган является объектом для разнообразных неблагоприятных эффектов. Воздействия на кожу могут быть очень сильными и длиться продолжительный период. Для понимания этих эффектов полезно рассмотреть гистологию кожного покрова. Защитную функцию кожного покрова главным образом выполняет эпидермис. Эпидермис – это внешние дифференцированные (мертвые) клетки, содержащие нерастворимый белок – кератин, окруженный слоем гидрофобного липида. Это обеспечивает превосходный барьер от водо-растворимых веществ, но этот барьер не является совершенным. Гидрофобные вещества способны растворяться в липиде и медленно диффундировать через мертвые клетки, достигая нижний слой живых клеток. Затем они быстро диффундируют через слой живых клеток, попадая в кровяные сосуды, которые располагаются между эпидермисом и дермисом. Небольшие молекулы диффундируют быстрее, чем большие молекулы, поэтому проникают внутрь намного быстрее. Обычно малое количество вещества может быть опасным. Способность небольших гидрофобных молекул проникать через кожу также может быть использовано в фармацевтике для нашей пользы. Медленная диффузия через кожный покров обеспечивает низкий уровень воздействия. Разрушение ороговевшего слоя может происходить из-за физической травмы, либо из-за воздействия химикатов. К последним относятся органические растворители, которые растворяют липидный барьер, едкие вещества, которые разрушающие мертвые клетки, а также моющие вещества, которые могут действовать по обоим механизмам. После повреждения кожного покрова, проникновение через барьер может значительно возрасти, вызвав опасную ситуацию. Химические соединения, проникнувшие через ороговевший слой, могут наносить вред живым клеткам. Тесное взаимодействие этих клеток может разрушаться под таким воздействием, что приводит к накоплению жидкости. Важное свойство кожного покрова заключается в наличии потовых желез. Насчитывается порядка 3 млн. таких маленьких насосов в нашем кожном покрове, которые помогают нам охлаждаться при испарении пота. Соленая вода, выступающая из потовых желез, воздействует на токсичные вещества. Во-первых, пот может растворять сухие вещества, с которыми мы контактируем. Например, может происходить выщелачивание краски из нашей одежды или разрушение полимеров в резине. Во-вторых, продолжительное воздействие влаги на ороговевший слой приводит к разбуханию мертвых клеток, тем самым, увеличивая проникновение гидрофильных веществ через эпидермис. Это работает не в нашу пользу, когда мы купаемся или моемся в загрязненной воде. В разбавленном растворе акваионов скорость, с которой органические растворители проникают в кожу, пропорциональна их концентрации в воде. Эпидермис является наиболее распространенным местом для возникновения рака у людей. Статистические данные на наиболее часто встречающиеся формы рака кожи такие же неполные, как и для других типов рака, которые часто бывают фатальными. Типы рака кожи Карцинома основных клеток. Это наиболее часто встречающаяся форма (60-70% от общей встречаемости рака кожи). Повреждения не метастатические, несмотря на то, что являются опасными. Предположительно, некоторые патологии в значительной степени развиваются из волосяных фолликул, сальных и потовых желез. Карцинома чешуйчатых клеток. Насчитывается порядка 30% от общей встречаемости. Как правило, повреждения заключаются в расхождении клеток по размеру и в видоизменении структуры, что приводит к изменению формы. Разрушения являются агрессивными, но с медленным метаболизмом, обычно требующие нескольких лет, возможно из-за того, что они плохо растут как индивидуальные клетки или являются сильно зависимыми от взаимодействия с соседним дермисом. Этот тип раковых клеток может встречаться в других анатомических органах, покрытых наслоившимися чешуйками эпителия (пищевод, ротовая полость) или в тканях с метаплазией без физиологического контроля (шейка матки). Меланома. Этот тип раковых клеток, развивающихся из меланоцитов, обычно 10%), чем приведенные ранее, но является более опасным. Некоторыевстречается реже ( формы быстро метастазируют, плохо подвергаются прогнозированию. Однако за долгие годы детекция на ранних стадиях была улучшена. Число случаев с 1950 года ежегодно возрастает на 6%, вероятно, отражая увеличивающееся воздействие солнца на население. Химиотерапия рака часто основывается на специфических свойствах раковых клеток, из-за которых клетки делаются чувствительными для уничтожения. Предложенное лечение меланомы иллюстрирует стратегию и ограничения. Предполагаемые клетки меланомы обрабатываются тригидроксифенилаланином. Клетки поглощают это соединение через транспорт ароматических аминокислот. Тригидроксисоединения являются объектом легкого автоокисления, в результате которого образуются супероксиды и хиноны: 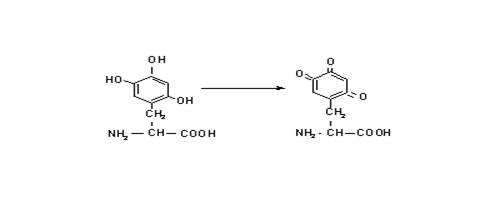 Образовавшиеся электофилы могут быть объектом для атаки внутриклеточными нуклеофилами. Недостатком является то, что тригидроксифенилаланин может подвергаться ферментативному декарбоксилированию и, как аналог допамина – нейропереносчика, может быть включен в нейрон:
Образовавшиеся электофилы могут быть объектом для атаки внутриклеточными нуклеофилами. Недостатком является то, что тригидроксифенилаланин может подвергаться ферментативному декарбоксилированию и, как аналог допамина – нейропереносчика, может быть включен в нейрон: 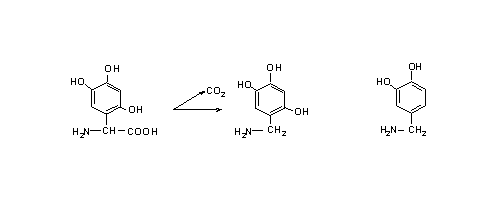 Поэтому было бы более эффективно использовать соединение, которое позволило бы решить эту проблему. Другим подходом является использование реакции, которая происходит в меланоцитах: гидроксилирование тирозина до 3,4-гидроксифенилаланина тирозин-гидроксилазой. Это является начальной стадией в синтезе меланина. Синтез некоторых других соединений, например антоцианов в цветах растений, происходит также по этому механизму.
Поэтому было бы более эффективно использовать соединение, которое позволило бы решить эту проблему. Другим подходом является использование реакции, которая происходит в меланоцитах: гидроксилирование тирозина до 3,4-гидроксифенилаланина тирозин-гидроксилазой. Это является начальной стадией в синтезе меланина. Синтез некоторых других соединений, например антоцианов в цветах растений, происходит также по этому механизму. 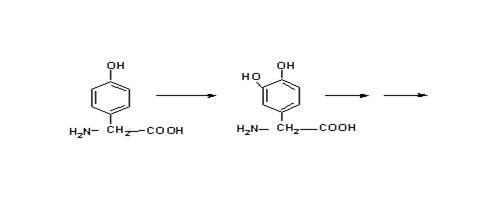 Клетки можно обрабатывать 2,4-дигидроскифенилаланином. Это соединение, захваченное меланоцитами через транспорт ароматических аминокислот, затем может быть гидроксилировано тирозиназой с образованием 2,4,5-тригидроскифенилаланина, который может автоокисляться и убивать клетки. Отмечено, что другие клетки, испытывающие недостаток этого фермента, не могут быть разрушены. Пока еще этот метод не используется в практике. Эксперименты на культуре клеток показали, что 2,4-дигидроксифенилаланин селективно убивает клетки меланомы. К сожалению, пока не показано, что произойдет с нормальными меланоцитами. Их уничтожение может привести к серьезной проблеме. Подобный вопрос возникает касательно меланин-продуцирующих клеток в надпочечниках и мозге. Разрушение последних химическими веществами вызывает болезнь Паркинсона. В химиотерапии цель специфична, но избежать побочных эффектов и рецидивов, к несчастью, не удается. Некоторые химиотерапевтические вещества сами являются канцерогенами. Лечение ими молодых пациентов может вызывать рак через много лет, даже при успешном излечении. Агенты вызывающие рак кожи. Ионизирующая радиация. С открытием радиоактивных элементов стало понятно, что рентгеновские лучи могут вызывать карциномы кожного покрова. Однако через несколько лет ионизирующая радиация была использована для лечения разнообразных кожных заболеваний. К несчастью, исследователи натолкнулись на неоплазию, как на побочный эффект. Вторым побочным эффектом была атрофия дермиса, называющая радиодерматит. Ультрафиолетовый свет. В наши дни наиболее часто встречающейся формой радиации является солнечный свет. Считается, что это главная причина рака кожного покрова по всему миру, вызывающая образование пиримидиновых димеров в ДНК. В США случаи возникновения рака кожи у белого населения выше, чем у афроамериканцев. К тому же, рак кожи чаще встречается у населения тропических стран и риск выше у тех, кто загорает больше. Люди, у которых наблюдается дефекты в репарации ДНК, должны избегать воздействия солнечных лучей, чтобы не было рака кожи. Даже если солнечные лучи не вызывают рак, то их воздействие приводит к преждевременному старению кожи. Полициклические ароматические углеводороды (ПАУ). Отмечено, что эти соединения метаболизируются цитохромом Р4501А1, который является наиболее важной формой цитохромов в эпидермисе. ПАУ являются основными продуктами сгорания. О том, что они вызывают рак кожи известно уже на протяжении двух столетий. В начале 20-го столетия ученые стремились идентифицировать вещества в продуктах сгорания, которые вызывают рак. Точно такой же подход применили к табаку с целью выяснения таких веществ и создания безопасных сигарет. Для идентификации активных компонентов использовали кожный покров мышей и кроликов. Этот подход позволил идентифицировать несколько соединений, относящихся к ПАУ, которые являлись канцерогенами для кожи мышей и кроликов. При моделировании канцерогенеза мыши подвергались воздействию ПАУ. Опухоль не развивалась, пока не была произведена серия воздействий через определенный интервал времени (например, два раза в неделю). Отмечено, что относительно большая доза ПАУ увеличивает риск рака кожи после соответствующего периода воздействия (несколько месяцев), а маленькая доза не увеличивает. Ответная реакция на величину дозы не всегда линейна. Одним из объяснений этого феномена является то, что большая доза сильнее повреждает ДНК в клетках, предназначенных для формирования опухоли. Также этот токсин убивает и другие клетки, чем стимулирует регенерацию поврежденных клеток, что может стимулировать клетки, дестабилизированные повреждением исходной ДНК. Это общепринятая концепция, однако, она оставляет без ответа многие вопросы о специфике развития опухоли. С возникновением в 1970-х годах исследований мутагенеза у бактерий появилась надежда на искоренение мутагенов и канцерогенов. Однако, к огромному сожалению мутагены были найдены везде, где только возможно. Некоторые исследователи надеются, что изучение механизмов действия этих веществ сделает эту цель реальной.
Клетки можно обрабатывать 2,4-дигидроскифенилаланином. Это соединение, захваченное меланоцитами через транспорт ароматических аминокислот, затем может быть гидроксилировано тирозиназой с образованием 2,4,5-тригидроскифенилаланина, который может автоокисляться и убивать клетки. Отмечено, что другие клетки, испытывающие недостаток этого фермента, не могут быть разрушены. Пока еще этот метод не используется в практике. Эксперименты на культуре клеток показали, что 2,4-дигидроксифенилаланин селективно убивает клетки меланомы. К сожалению, пока не показано, что произойдет с нормальными меланоцитами. Их уничтожение может привести к серьезной проблеме. Подобный вопрос возникает касательно меланин-продуцирующих клеток в надпочечниках и мозге. Разрушение последних химическими веществами вызывает болезнь Паркинсона. В химиотерапии цель специфична, но избежать побочных эффектов и рецидивов, к несчастью, не удается. Некоторые химиотерапевтические вещества сами являются канцерогенами. Лечение ими молодых пациентов может вызывать рак через много лет, даже при успешном излечении. Агенты вызывающие рак кожи. Ионизирующая радиация. С открытием радиоактивных элементов стало понятно, что рентгеновские лучи могут вызывать карциномы кожного покрова. Однако через несколько лет ионизирующая радиация была использована для лечения разнообразных кожных заболеваний. К несчастью, исследователи натолкнулись на неоплазию, как на побочный эффект. Вторым побочным эффектом была атрофия дермиса, называющая радиодерматит. Ультрафиолетовый свет. В наши дни наиболее часто встречающейся формой радиации является солнечный свет. Считается, что это главная причина рака кожного покрова по всему миру, вызывающая образование пиримидиновых димеров в ДНК. В США случаи возникновения рака кожи у белого населения выше, чем у афроамериканцев. К тому же, рак кожи чаще встречается у населения тропических стран и риск выше у тех, кто загорает больше. Люди, у которых наблюдается дефекты в репарации ДНК, должны избегать воздействия солнечных лучей, чтобы не было рака кожи. Даже если солнечные лучи не вызывают рак, то их воздействие приводит к преждевременному старению кожи. Полициклические ароматические углеводороды (ПАУ). Отмечено, что эти соединения метаболизируются цитохромом Р4501А1, который является наиболее важной формой цитохромов в эпидермисе. ПАУ являются основными продуктами сгорания. О том, что они вызывают рак кожи известно уже на протяжении двух столетий. В начале 20-го столетия ученые стремились идентифицировать вещества в продуктах сгорания, которые вызывают рак. Точно такой же подход применили к табаку с целью выяснения таких веществ и создания безопасных сигарет. Для идентификации активных компонентов использовали кожный покров мышей и кроликов. Этот подход позволил идентифицировать несколько соединений, относящихся к ПАУ, которые являлись канцерогенами для кожи мышей и кроликов. При моделировании канцерогенеза мыши подвергались воздействию ПАУ. Опухоль не развивалась, пока не была произведена серия воздействий через определенный интервал времени (например, два раза в неделю). Отмечено, что относительно большая доза ПАУ увеличивает риск рака кожи после соответствующего периода воздействия (несколько месяцев), а маленькая доза не увеличивает. Ответная реакция на величину дозы не всегда линейна. Одним из объяснений этого феномена является то, что большая доза сильнее повреждает ДНК в клетках, предназначенных для формирования опухоли. Также этот токсин убивает и другие клетки, чем стимулирует регенерацию поврежденных клеток, что может стимулировать клетки, дестабилизированные повреждением исходной ДНК. Это общепринятая концепция, однако, она оставляет без ответа многие вопросы о специфике развития опухоли. С возникновением в 1970-х годах исследований мутагенеза у бактерий появилась надежда на искоренение мутагенов и канцерогенов. Однако, к огромному сожалению мутагены были найдены везде, где только возможно. Некоторые исследователи надеются, что изучение механизмов действия этих веществ сделает эту цель реальной.
Легкие
Легкое – орган идеально подходящий для выполнения главной функции – аэрации крови. На вершине воздухоносных путей трахея раздваивается, и легкие разделяются на 2 доли. Внутри каждой доли разветвление происходит еще 23 раза, причем с каждым разом уменьшается диаметр воздухоносных путей, окончательно образуя 10-20 х 106 респираторных бронхиол. К каждому из них прикреплено около десятка альвеол (воздушных мешочков) с диаметром приблизительно 0,25мм. Для сравнения – печень состоит из 106 функциональных единиц, почки – из 106 нефронов, кожа содержит около 3х106 потовых желез. Легкие содержат 300х106 альвеол, общая поверхность которых составляет 70м2 (площадь поверхности кожи – 1м2). Процесс аэрации крови требует постоянной вентиляции легких. Обычно мы вдыхаем около 1.5 литра воздуха 4 раза в минуту, в день это составляет 10-20 х103 литров. Таким образом, даже низкая концентрация токсинов в воздухе может приводить к значительной экспозиции при вдохе. Заметим, чтобы получить эквивалентное количество соединения из питьевой воды (из расчета 2 литра воды в день), концентрация веществ должна быть в 10 000 раз выше. От эластичности легких зависит эффективность удаления воздуха при выдохе. Потеря эластичности поддерживающих тканей, например из-за фиброза, приводит к пропорциональному ухудшению вентиляции и газообмена. Свойство аэрации подразумевает свободную диффузию газов (О2, СО2) между кровью и альвеолами. Барьер между ними обычно составляет от 1 до 0.1 μм. Повреждения и утолщения барьера приводят к ухудшению газообмена. Другим критическим параметром является капиллярная перфузия. Скорость потока крови, который прокачивается через легкие, составляет около 60 л/мин. Воздухоносные пути на всем протяжении погружены в жидкость. По этой причине, место токсичного действия газов сильно зависит от его растворимости в воде. Поскольку NH3 и HCl хорошо растворимы, то они проникают в окружающую жидкость в верхних отделах дыхательной системы, вскоре после вдоха и повреждают клетки, с которыми контактируют, изменяя локальный рН. Оксид серы и хлор умеренно растворимы и реагируют с терминальными бронхиолами и альвеолами. Каждый из них может соединяться с водой с образованием сильной кислоты, как показано ниже. Аналогично сульфат фтора (SO2F2), пестицид, соединяясь с водой, образует H2SO4 и HF. Хлор может образовывать слабую гипохлористую кислоту, ионной формой которой является гипохлорит, оксидант (в бытовых целях применяется для отбеливания). SO2 + H2O → H2SO3 Cl2 + H2O → HCl + HOCl SO2F2 + 2H2O → H2SO4 + 2HF Озон и оксида азота слаборастворимы, поэтому они достигают альвеол и могут вызвать окислительный стресс. Повреждения эпителиальных клеток, особенно в нижних отделах ослабляет плотность их соединения. Значительная экспозиция приводит к разрушению межклеточных контактов и к кровоизлияниям. Химически инертные газы не повреждают эпителий, однако, вызывают асфиксию. Газы типа N2 могут делать это пассивно, просто в отсутствии кислорода, а H2S и CO вытесняют кислород из гемоглобина, поэтому вызывают асфиксию в более низких концентрациях. Распределение вдыхаемых частиц зависит от их аэродинамических характеристик (форма, размер, вязкость). Большие частицы удаляются еще в верхних отделах дыхательного тракта, включая носовые пазухи и зев, а мелкие (менее 1μм в диаметре) могут проходить по воздухоносным путям и попадать в альвеолы. Удлиненные частицы (волокна) застревают в бифуркациях бронхов. Гигроскопичные частицы могут увеличиваться в размере. Существует 2 пути удаления оседающих в легких частиц. Это образование слизи в верхних отделах. У человека слизь экскретируется клетками, окаймляющими трахеи и верхние отделы бронхов, и транспортируется по направлению ко рту с помощью мерцающих ресничек со скоростью около 5см/час. Частицы, впечатанные в слизь, окончательно отхаркиваются и/или попадают в желудочно-кишечный тракт. Этот процесс могут затормозить вещества, парализующие мерцательное движение (цианид) или вещества, стимулирующие выработку слизи (раздражители). Табачный дым содержит и цианиды, и раздражители и препятствует выведению частиц. Эксперименты показали, что время полувыведения частиц красного железняка (гематит, Fe3O4) из легких некурящих индивидов составляет около 2 месяцев, а из легких курящих 11 месяцев. Второй способ выведения – с помощью макрофагов. Эти клетки покрывают до 1% поверхности альвеол. Они поглощают частицы фагоцитозом и затем мигрируют в верхние дыхательные пути, где и отхаркиваются. Для повседневной жизни этих способов оказывается достаточно, чтобы сохранять легкие чистыми и стерильными. Однако большое количество вдыхаемых частиц может сокрушить эту защиту. Известно три болезненных состояния, связанных с профессиональной деятельностью: черное легкое (уголь), белое легкое (асбест), коричневое легкое (хлопок). Некоторые вещества являются вредоносными не только потому, что встречаются в большом количестве, но и потому что повреждают механизм удаления. Примерами могут служить песок и асбест, причем последний является волокнистым кремнеземом. Вдыхаемые частицы песка могут проникнуть глубоко в легкие, а асбест обычно оседает в местах бифуркаций в бронхах. В каждом случае макрофаги пытаются удалить частицы, однако минералы оказываются токсичными для этого типа клеток, вызывая их лизис. В результате высвобождаются токсичные производные кислорода, такие как супероксид радикал, которые являются более токсичными для эпителиальных клеток, чем для подстилающих их фибробластов. Кроме этого высвобождаются факторы роста фибробластов, и факторы, привлекающие фибробласты к данному участку. Если повреждения происходят продолжительное время, это может привести к усилению роста фибробластов (фиброз) и к потере эластичности легких. Повреждения легких минеральной пылью (например, кремниевой) являлось профессиональной болезнью более столетия. Асбест способствует возникновению не только бронхогенной карциномы, но и мезотелиомы. Широкое использование асбестовой изоляции вело к эпидемии мезотелиомы среди тех, кто по роду занятий подвергал себя воздействию, а иногда и среди членов семей, на которых действовала пыль, принесенная домой с рабочей одеждой. Окислительный процесс способствует индукции фиброза. Примером может служить гербицид паракват (используется для уничтожения марихуаны), который селективно откладывается в альвеолярных клетках, даже если экспозиция продолжается месяц. Это органическое основание подвергается процессу циклического восстановления и окисления, генерируя супероксид радикал, как показано на рис. 13. В результате этого процесса альвеолярные клетки погибают, а свободные места заполняются активно пролиферирующими фибробластами, а фатальный итог наступает спустя несколько недель.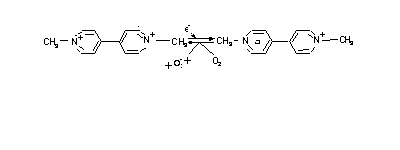 Рис. 13. Цикл окисления-восстановления параквата Озон является намного менее специфичным, чем паракват, но встречается более часто. Он генерируется в нижних слоях атмос- феры под действием солнечных лучей и оксидов азота на углеводороды. Известно, что значительная часть популяции (около 25%) является чувствительной к эффектам озона, обычно это люди с предшествующими болезнями – астмой, эмфиземой, бронхиты, или даже люди, вдыхающие большое количество воздуха через рот (заметим, что большинство лабораторных животных обладают облигатным носовым дыханием). Эпидемиологические исследования продемонстрировали эффект загрязнения воздуха на чувствительных индивидов, включая приступы астмы, снижение легочной функции у детей. Хронически низкий уровень экспозиции озоном ведет к утолщению тканей подстилающих эпителий нижних путей. В легких также осуществляются реакции биотрансформации, что в некоторых случаях приводит к токсичным эффектам. Доля активности цитохромов Р450, приходящейся на ткани легких, невелика по сравнению с печенью (хотя это орган наиболее активный после почек). Большая часть активности приходится на клетки Клара. Эти клетки являются мишенью для 2-х типов соединений – CCl4 и 4-ипомеанола. Первое, так же как и в печени, активируется восстановлением, а последнее – эпоксидированием с участием Р450 (рис. 14).
Рис. 13. Цикл окисления-восстановления параквата Озон является намного менее специфичным, чем паракват, но встречается более часто. Он генерируется в нижних слоях атмос- феры под действием солнечных лучей и оксидов азота на углеводороды. Известно, что значительная часть популяции (около 25%) является чувствительной к эффектам озона, обычно это люди с предшествующими болезнями – астмой, эмфиземой, бронхиты, или даже люди, вдыхающие большое количество воздуха через рот (заметим, что большинство лабораторных животных обладают облигатным носовым дыханием). Эпидемиологические исследования продемонстрировали эффект загрязнения воздуха на чувствительных индивидов, включая приступы астмы, снижение легочной функции у детей. Хронически низкий уровень экспозиции озоном ведет к утолщению тканей подстилающих эпителий нижних путей. В легких также осуществляются реакции биотрансформации, что в некоторых случаях приводит к токсичным эффектам. Доля активности цитохромов Р450, приходящейся на ткани легких, невелика по сравнению с печенью (хотя это орган наиболее активный после почек). Большая часть активности приходится на клетки Клара. Эти клетки являются мишенью для 2-х типов соединений – CCl4 и 4-ипомеанола. Первое, так же как и в печени, активируется восстановлением, а последнее – эпоксидированием с участием Р450 (рис. 14). 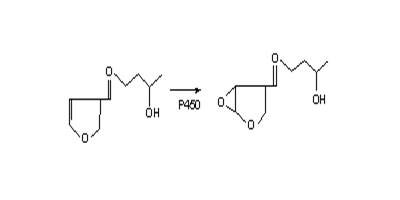 Рис. 14. Реакция окисления 4-ипомеанола 4-ипомеанол является микотоксином, присутствующим в некоторых сортах сладкого картофеля, вызывающим респираторные отравления. В экспериментах на мышах была показана специфичная деструкция Клара клеток. Когда действие подобных соединений только начинали изучать, было неясно, в печени или в легких локализованы цитохромы Р450, отвечающие за их активацию. Полагали, что соединения активируются в печени, а затем переносятся в легкие, где их эффекты оказываются токсичными, в то время как печень имеет адекватную защиту. Однако ряд экспериментов подтверждал, что легкие обладают собственной метаболической активностью. Во-первых, препараты цитохромов Р450 из легких способны метаболизировать 4-ипомеанол. Во-вторых, при введении животным радиоактивного 4-ипомеанола, его аддукты регистрировались в клетках Клара. В-третьих, индукторы цитохромов Р450 печени, фенобарбитал или 3-метилхлорантрацен снижали токсичность для легких. Кроме того, показано, что у птиц отсутствует легочный метаболизм 4-ипомеанола и отсутствует легочная токсичность, тогда как метаболизм в печени приводит к токсическому эффекту. В настоящее время охарактеризовано несколько изоформ цитохромов Р450 легких человека и лабораторных животных
Рис. 14. Реакция окисления 4-ипомеанола 4-ипомеанол является микотоксином, присутствующим в некоторых сортах сладкого картофеля, вызывающим респираторные отравления. В экспериментах на мышах была показана специфичная деструкция Клара клеток. Когда действие подобных соединений только начинали изучать, было неясно, в печени или в легких локализованы цитохромы Р450, отвечающие за их активацию. Полагали, что соединения активируются в печени, а затем переносятся в легкие, где их эффекты оказываются токсичными, в то время как печень имеет адекватную защиту. Однако ряд экспериментов подтверждал, что легкие обладают собственной метаболической активностью. Во-первых, препараты цитохромов Р450 из легких способны метаболизировать 4-ипомеанол. Во-вторых, при введении животным радиоактивного 4-ипомеанола, его аддукты регистрировались в клетках Клара. В-третьих, индукторы цитохромов Р450 печени, фенобарбитал или 3-метилхлорантрацен снижали токсичность для легких. Кроме того, показано, что у птиц отсутствует легочный метаболизм 4-ипомеанола и отсутствует легочная токсичность, тогда как метаболизм в печени приводит к токсическому эффекту. В настоящее время охарактеризовано несколько изоформ цитохромов Р450 легких человека и лабораторных животных
Нервная система
Нервная система является также мишенью токсичных веществ. Американским институтом гигиены подсчитано, что из 588 токсичных соединений 28% главным образом действуют на нервную систему. Эта чувствительность возникает из-за сложного строения нервной системы и ее первостепенной функции для всего организма. Повышенная чувствительность в период развития плода отражает продолжительный период, требующийся для сортирования клеток, запланированного истощения и создания соответствующего взаимодействия. К тому же, так как клетки нервной системы существенным образом не размножаются после рождения, повреждение, приводящее к гибели клетки или потери функции, является кумулятивным и может вызвать появление симптомов через много лет после незначительного воздействия. Открытие веществ, которые могут вызывать появление симптомов Паркинсонизма, привели к размышлению о том, что хроническое воздействие веществ из окружающей среды является причиной увеличения встречаемости этих симптомов и других заболеваний нервной системы. На сегодняшний день произведена оценка влияния 70000 коммерческих химических соединений на нервную систему. Центральная нервная система (головной и спиной мозг) управляют периферической нервной системой и управляет ее функциями. Периферическая нервная система является запутанной сетью, содержащей в себе большое разнообразие потенциальных сайтов для воздействия токсичных веществ. Центральная нервная система защищается от заурядных воздействий с помощью специализированных, тесно соединенных эндотелиальных клеток, выстилающих кровяные капилляры. Сетчатка глаза и некоторые компоненты периферической нервной системы также защищены. Этот барьер более эффективен для заряженных соединений и менее эффективен для липофильных веществ. При рождении этот барьер формируется не полностью, и у недоношенных детей может быть разрушен с помощью веществ, которые позднее проникнуть не смогут. Нейроны выполняют основные функции нервной системы. Найдено большое разнообразие нейронов, которые выполняют специализированные функции. Основные биосинтетические функции клетки, такие как синтез белков, происходят в теле клетки. Передаваемая информация принимается дендритами. Когда эта информация достигает достаточного уровня, она передается по- средством электрического импульса по аксону. Аксоны формируют разветвления на конце, которые соединяются с другими нейронами или мышечными клетками, которые принимают этот импульс. Нейроны обычно имеют избыток отрицательного заряда на внутренней стороне. Этот заряд нейрона поддерживается благодаря ионным насосам, для работы которых необходима энергия (АТФ). Самым важным насосом является натрий-калиевый АТФ-зависимый насос, который поддерживает концентрацию калия снаружи клетки приблизительно в 20 раз выше, чем внутри, а концентрация натрия внутри составляет только одну десятую концентрации снаружи. Концентрация хлорида снаружи выше, чем внутри. Из-за дифференцированного заряда возникает электрический потенциал, равный приблизительно 70 мВ. Так как разноименные заряды разделены маленьким расстоянием, то электрическое поле достаточно велико, порядка 100 кВ/см. Особенностью аксона является высокая частота натриевых канальцев в плазматической мембране. Конформация этих белков (канальцев) зависит от электрического поля. При обычном потенциале они находятся в закрытом состоянии и не дают ионам натрия входить и выходить из клетки. Однако когда вольтаж возрастает до критического уровня (~30 мВ), обеспечивается движение катионов через каналец, белок которого находится в открытой конформации. Когда в клетку поступает достаточная концентрация натрия, полярность в данном натриевом канальце изменяется на противоположную. Каналец закрывается и остается короткое время в инактивированном состоянии. Тем временем, изменившееся напряжение открывает калиевый каналец, позволяющий ионам калия выходить из клетки, таким образом, помогая восстанавливать первоначальный потенциал, а затем он закрывается. В пределах короткого промежутка времени, миллисекунды или около того, каналец восстанавливает способность передавать потенциал действия. Это означает, что аксон способен передавать тысячу импульсов в секунду. Абсолютное количество ионов, переносимых во внутрь и наружу, мало по сравнению с общим количеством в клетке. Аксоны очень разнообразны по длине: они могут быть короткими (менее 1 мм) или очень длинными (более 1 м). Когда потенциал достигает разветвления на конце аксона, импульс может перейти на другой нейрон или на мышечные клетки посредством синапса. Эта передача происходит с использованием ионных канальцев, конформация которых зависит от лиганда. Канальцы являются рецепторами для маленьких молекул – нейропереносчиков. Связывание лиганда заставляет их перейти от закрытого в открытое состояние. Активированные нейропередатчиками ионные канальцы в синапсах в открытом состоянии позволяют перемещаться ионам, тем самым, изменяя потенциал мембраны. Хорошо изученный вид синапса, когда он выполняет роль нейромышечного соединения, используя для этого ацетилхолин как нейропередатчик. В соединении на плазматической мембране (постсинаптическом терминале) мышечных клеток найдено огромное количество ацетилхолиновых рецепторов, расположенных напротив пресинаптического терминала аксона. Когда потенциал достигает конца аксона, открываются потенциал-зависимые кальциевые канальцы на плазматической мембране, позволяя ионам кальция устремляться в цитоплазму. Концентрация кальция снаружи клетки 1-2 мМ, а в цитоплазме 0,1 мкМ. Ионы кальция индуцируют миграцию маленьких цитоплазматических пузырьков, каждый из которых содержит порядка 10 тыс. молекул ацетилхолина, к пресинаптической мембране. Молекулы ацетилхолина, высвободившись из пузырька, быстро диффундируют в постсинаптическую область и в течение 0,1 мсек активируют рецепторы. Ацетилхолиновые рецепторы быстро открываются (1 млсек), способствуя движению катионов (особенно натрия), которые деполяризуют постсинаптическую мембрану и затем закрываются. еполяризация открывает натриевые канальцы, распространяющие потенциал, который деполяризует целую плазматическую мембрану мышечной клетки. Это открывает кальциевые канальцы в плазматической мембране, а затем в саркоплазматической сети. Затем ионы кальция вызывают сокращение мускулатуры. Эта система предназначена не только для превращения сигнала из нейрона в мышечную активность, но также для предотвращения сверхактивности. Ацетилхолин, производимый потенциалом нейрона, обычно не вызывает продолжительную стимуляцию мышечной ткани, так как он быстро удаляется из синаптической трещины. Однако нейроны имеют специализированные транспортеры, предназначенные для возращения освобожденных нейропередатчиков, так как большинство из них могут быть возвращены в пузырьки и снова участвовать в цикле. Этот процесс может иметь затруднения, когда в нейрон может попадать токсикант, близкий по структуре с нейропередатчиком, что впоследствие может привести к нарушению нейрона. В случае ацетилхолина, нейромышечное соединение также содержит ацетилхолинэстеразу, которая гидролизует сложный эфир, образуя ацетат и холин.Функцию нейромедиаторов выполняют многие маленькие молекулы, включая аминокислоты, пептиды и другие разнообразные соединения. Нейропередатчик связывается с ионным канальцем в постсинаптической мембране, тем самым, обеспечивая движение ионов. Ацетилхолиновые рецепторы также найдены в синапсе между нейронами и центральной не рвной системой. Как уже было сказано ранее, ацетилхолиновым рецептором в нейромышечном соединении является катионовый каналец, который обеспечивает деполяризацию мембраны в открытом состоянии. Это приводит к открыванию натриевых канальцев, которые распространяют деполяризацию. Катионовые канальцы, которые связываются с другими нейропередатчиками, такими как серотонин или глутамат, обладают такой же функцией. Но некоторые лиганд-зависимые канальцы специфичны для перемещения хлорид-ионов. Когда они открыты, хлорид-ионы заходят в клетку в результате градиента концентрации и таким образом увеличивают поляризацию. Если открыто несколько катионовых канальцев, но их недостаточно для достижения порога, потенциал не будет перемещаться. Хлоридные канальцы являются ингибиторами, и если эти канальцы будут блокированы стрихнином, то могут возникнуть конвульсии и смерть. Рецепторы нейропередатчиков обычно не функционируют как отдельная молекула белка. Они являются специфичными мультисубъединичными комплексами, чаще всего из неодинаковых мономеров. Более того, каждый вид субъединиц может существовать в нескольких формах, образованных отличающимися генами или в результате альтернативного сплайсинга. Показательным примером является ацетилхолиновый рецептор. Рецепторы, располагающиеся в постсинаптической мембране нейромышечншго соединения, являются чувствительными к никотину, поэтому они известны как никотиновый субтип. Другой вид ацетилхолинового рецептора является намного более чувствительным к искусственному лиганду, мускариновой кислоте, поэтому он известен как мускариновый субтип. Такое разнообразие помогает объяснить различающуюся чувствительность рецепторов к токсичным агентам. Например, яд курраре инактивирует никотиновые рецепторы, в то время как атропин инактивирует мускариновые рецепторы. Токсины, влияющие на возбуждение. Глутаминовая кислота является важнейшим передатчиком возбуждения в нервной системе. Некоторые субтипы глутаминовых канальцев обнаруживались в экспериментах с искусственными аналогами глутаминовой кислоты. Около 30 лет назад было обнаружено, что введение глутаминовой кислоты или некоторых ее аналогов новорожденным крысам может привести к смерти некоторых нейронов. Последующие исследования показали, что когда эти нейропередатчики были введены в мозг, близлежайшие нейроны погибли, хотя аксонам, берущим начало из клеток, находящихся снаружи этого окружения, не был причинен вред. Эта работа породила идею о том, что высокие уровни стимуляторов возбуждения могут быть вредоносными. Эти исследования привели также к размышлению о том, что хроническое воздействие агентов окружающей среды, аналогов нейропереносчиков, может приводить к заболеваниям, связанным с разрушением нервной системы, таким как болезнь Паркинсона и болезнь Альцгеймера. Нейролатеризм, известный с давних времен и характеризующийся частичным параличем, является результатом воздействия токсинов возбуждения. Эта болезнь обнаружена по всему миру, включая Европу, но сейчас в большинстве случаев она встречается в очень бедных странах, в частности в Индии, Бангладеш и Эфиопии. Причина заболевания заключается в горохе из бобовых Lathyrus savita. Это выносливое, дикорастущее растение, буйно растущее независимо от погодных условий. Их зерна содержат (порядка 0,5% от веса) необычную аминокислоту β-оксалиламиноаланин, которая является потенциальным лигандом для АМРА субтипа глутаминового рецептора. Побеги, которые содержат такой же уровень аминокислоты, также употребляются в пищу. После употребления порядка 100 г/день зерен в течение нескольких лет, у некоторых людей обнаруживаются ранние симптомы латиризма. Последующее употребление приводит к необратимой слабости в ногах с болями и судоргами, а так же с последующими трудностями при хождении. Продолжительное употребление в пищу приводит к смерти, но механизм этого не известен. Другим аналогом нейропереносчика, содержащимся в пищевых продуктах и разрушающим нервную систему, является домоиковая кислота. Большие дозы этого вещества, введенные крысам или обезьянам, вызывают апоплексический удар. У людей это вещество в низких дозах вызывает диарею и потерю памяти. Домоиковая кислота аккумулируется в ракообразных, которые питаются диатомовыми водорослями, синтезирующими это вещество во время цветения. Поэтому перед употреблением в пищу ракообразные проходят тестирование на содержание домоиковой кислоты. Это является предупредительной мерой. Такими анализами занимается аналитическая химия, но это достаточно сложная задача, так как существует одиннадцать изомеров этого соединения. Недавно для анализа стали применять биохимические методы с использование клонированных рецепторов. Это позволило определять активность образца без определения отдельных изомеров. Многие высокотоксичные вещества, вызывающие невропатологии у людей, синтезируются водорослями и могут аккумулироваться в рыбах и моллюсках. Некоторые из них подавляют возбуждение в результате связывания с ионными канальцами аксонов, которые обеспечивают передачу электрических импульсов и их инактивацию. Однако некоторые из таких веществ могут использоваться в фармакологии, вызывая гиперполяризацию и ингибируя передачу электрических импульсов. Бензодиазопины являются популярными транквилизаторами, подавляющими беспокойство. Они связываются с GABA рецепторами, хлоридными канальцами и увеличивают ионный поток, таким образом, увеличивая натуральное ингибирование активности. Эти соединения являются эффективными, имеют высокий терапевтический индекс и не вызывают привыкания. Однако некоторые вещества в этом классе имеют высокую гипнотическую активность и могут вызывать кратковременную потерю памяти. Одним из таких веществ является флунитразепам, который не одобрен в США к использованию по этой причине. Тяжелые металлы. Ртуть попадает в окружающую среду по нескольким механизмам. Существенное количество попадает из минералов. Такое же количество (порядка 5 млрд г в год) поступает в результате горения ископаемого топлива, которое содержит ртуть в концентрации 1ppm. Ионы ртути могут метилироваться микроорганизмами и накапливаться в липидах. Недавно внимание заострилось на содержании ртути в организме человека. Ртуть может воздействовать в виде ионной и метилированной формы, а также в виде паров. Соли ртути являются растворимыми, поэтому они чаще всего воздействуют на почки. Вдыхание паров ртути вызывает воспаление легких. Ранние симптомы включают: усталость, уменьшение концентрации внимания, потеря аппетита и тахикардия. Сильное воздействие может приводить к спазмам, потери памяти, повышенной возбудимости, депрессии и галлюцинациям. Метилированная ртуть накапливается в коре головного мозга. У плода метилированная форма ртути накапливается в 20 раз интенсивнее, чем ионы ртути, что было показано воздействием ртутью на беременных животных. К тому же концентрация ртути у плода в два раза выше, чем у матери, а ртуть нарушает функции мозга у новорожденных. Воздействие ртути в зрелом возрасте приводит к целому спектру симптомов, включая потерю чувствительности, слуха и зрения, а в некоторых случаях даже к смерти. Воздействие ртути на человека является вездесущим. Горение и добыча ископаемых приводит к выбросам ртути в воздух. Некоторые люди получают высокую концентрацию через краску (особенно дети) или пищу, приготовленную в керамической посуде, покрытой глазурью, которая содержит ртуть. У старых людей порядка 95% ртути в организме сосредоточено в костях, где в течение жизни накапливается 200-500 мг ртути. Основная часть находится в красных кровяных тельцах, что укорачивает их жизнь. Почки также накапливают ртуть, в результате чего разрушаются проксимальные трубочки, что приводит к фиброзу. Уменьшение выделения уриковой кислоты является результатом ослабления функций почек. Уриковая кислота кристаллизуется и вызывает подагру. Ртуть также может приводить к нарушению репродуктивной функции, включая стерилизацию, а также может вызывать смерть новорожденных. Нервная система является наиболее серьезной мишенью воздействия ртути. Сильное воздействие приводит к разрушению мозга (энцефалопатии), характеризующееся раздражительностью, вялостью, потерей аппетита, атаксией и даже эпилепсией. Наиболее чувствительными являются дети. Исследования показали линейное уменьшение коэффициента IQ от содержания ртути в крови в диапазоне 0,05-0,35 мкг/мл. Токсины микроорганизмов. Люди подвергаются воздействию огромного количества токсинов, вырабатываемых бактериями, которые специфично воздействуют на разнообразные ткани. Токсины холеры, столбняка, дифтерии и ботулизма имеют схожие механизмы воздействия. Они все синтезируются как одинарные полипептидные цепи, которые способны формировать димеры, связанные дисульфидными мостиками. Тяжелая цепь в димере отвечает за тканеспецифичность и за проникновение токсина в клетку. Внутри клетки дисульфидные мостики разрушаются, после чего легкая цепь становится активированной. Легкие белковые цепи у столбняка и ботулизма являются цинк-зависимыми. Они приводят к нарушению секреции нейропереносчиков, которые обеспечивают взаимодействие с плазматической мембраной в синапсе. В случае ботулизма отсутствие секреции нейропереносчиков приводит к частичной парализации конечностей, так как токсин действует на спинной мозг. Для сравнения, при столбняке возникает спастическая парализация. Известно семь изоформ токсина ботулизма, которые различаются по протеолитической специфичности. Однако три изоформы взаимодействуют с одним и тем же белком, но разрезают его в разных местах. Видовые различия в чувствительности к ботулизму (человек и мышь в 1000 раз более чувствительны, чем крыса) определяются аминокислотными последовательностями в белках. Яды. Хищники должны обладать методами поимки и обездвиживания своих жертв. Многие используют для этой цели яды. Змеи вводят своим жертвам различные деградирующие ферменты, включая фосфолипазы, протеазы и нуклеазы. Наиболее эффективными обездвиживающими жертву компонентами являются небольшие белковые токсины (порядка 7 кДа), которые связывают и инактивируют ацетилхолиновые рецепторы в нейромышечных соединениях. Соединения этого класса имеют очень высокое сродство к рецептору в диапазоне 0,01-1 нМ. Вместо ингибирования ацетилхолинового рецептора, яд африканской древесной змеи содержит пептидный компонент, который связывает и инактивирует ацетилхолинэстеразу. Этот яд также содержит токсин, инактивирующий ворота калиевых канальцев, которые деполяризуют аксон между импульсами. Яды, которые воздействуют на ионные канальцы, часто состоят из смеси компонентов, одни из которых блокируют определенные канальцы в открытом состоянии, а другие - в закрытом. Яды актиний и пчел содержат пептиды, которые действуют на калиевые канальцы, а так же пептиды, которые действуют на натриевые канальцы. Морские улитки обездвиживают своих жертв (включая рыб по размерам больших, чем они сами) концентратами пептидов, которые содержат компоненты действующие на калиевые, натриевые и кальциевые канальцы, а так же другие пептидные ингредиенты, являющиеся нейротоксинами. Многие токсины ядов достаточно специфичны и поэтому нашли широкое применение для использования в экспериментах по изучению активностей ионных канальцев нервной системы млекопитающих, включая человека. Инсектициды. При производстве достаточного количества пищи для растущего населения мы стали зависимыми от разнообразных инсектицидов. Они, как правило, воздействуют на нервную систему и, следовательно, их действие протекает быстро. Главной целью инсектицидов являются хлоридные канальцы (γ-аминобутариковая кислота, циклодиены), натриевые канальцы (ДДТ) и ацетилхолинэстераза (органофосфаты). Широкое применение этих веществ привело к развитию устойчивости насекомых. Одиночные точечные мутации, повышающие устойчивость к циклодиенам, найдены у некоторых видов (тараканы, москиты, комнатные мухи, плодовые мушки, алейродиды, хрущак каштановый). Точечные мутации, повышающие устойчивость натриевых канальцев к ДДТ, найдены у шести видов (комнатные мухи, москиты, тараканы, тля персиковая, моль капустная, табачная листовертка-почкоед). Одна из нескольких дополнительных точечных мутаций может также привести к суперустойчивости. К счастью для нас, наша нервная система является нечувствительной к действию таких инсектицидов как циклодиены и ДДТ. Однако мы очень чувствительны к органофосфатам, которые первоначально разрабатывались как отравляющие вещества для ведения войны. Органофосфаты синтезируются в виде тиоформы (R3P=S), которая является относительно стабильной. Когда это соединение попадает в насекомое (или в человека), оно переходит в оксоформу (R3P=O), которая быстро взаимодействует с ацетилхолинэстеразой. Эти соединения вызывают смерть не только при вдыхании, но и при взаимодействии с кожным покровом. Изучение биохимии ацетилхолинэстеразы демонстрирует, что активные сайты остатков серина участвуют в гидролизе ацетилхолина, образуя интермедиат О-ацетилсерин, который быстро гидролизуется. Таким образом, органофосфаты инактивируют ферменты, тем самым, замедляя гидролиз. Злоупотребление наркотиками. Ядра accumbens были открыты как своего рода центры удовольствия в мозге, где рост уровня допамина-нейропереносчика воспринимался как удовольствие (эйфория, блаженство). Множество признаков указывает на злоупотребление наркотиками (включая никотин), как на стимуляторы уровня допамина в организме, который (уровень) отвечает за чувства удовольствия, вызываемые наркотиками. Экспериментальные животные будут добровольно сами принимать эти наркотики, что говорит о взникновении привыкания к наркотическим препаратам. У людей и животных привыкание или уменьшение чувствительности к таким агентам происходит так, что требуются для получения соизмеримого удовольствия большие дозы. Дозы наркотика могут стократно возрастать, что выходит далеко за пределы того, что изначально являлось летальным воздействием. Окончательное прекращение потребления наркотиков впоследствие вызывает дисфорию (в противоположность эйфории), так как тело реадаптируется к нехватке экзогенных агентов. Наркоманы в это время идут на то, чтобы продолжать принятие наркотиков в еще больших дозах. Реабилитация наркоманов – это долгий процесс, обычно длящийся долгие годы. Наркотическая зависимость была сравнима в масштабах с хроническими заболеваниями, такими, как: диабет, астма и повышенное кровяное давление. Многие исследования в области злоупотребления наркотиками направлены на понимание молекулярной основы действия наркотика, толерантности организма и реакцию отказа от наркотиков на их воздействие. Один из подходов к пониманию действия наркотиков был направлен на поиск их рецепторов. Это первый шаг в понимании путей сигнальной трансдукции. Последние работы указывают на важность серотониновых путей в возбуждении при наркотическом воздействии, а также на важность глутаматовых путей, особенно рецепторов NMDA, в развитии тяги к большему количеству наркотиков. Фармакологические свойства опиоидов известны с древних времен. Выделение наиболее активного компонента - морфина было впервые описано в 1803. Героин (диацетилморфин), который имеет более высокую скорость проникновения в мозг, был синтезирован в 1874. Морфин и его активные природные аналоги, такие как кодеин, вызывают не только эйфорию, но также являются хорошими анальгетиками и высоко эффективны в борьбе с диареей. Много усилий было положено на попытки сделать производные этих соединений, которые вызывают только обезболивание без эйфории, но до сих пор только с ограниченным успехом. Однако был разработан эффективный антагонист (для лечения передозировок), такой же долгоживущий, хотя гораздо менее эффективный, производное (метадон), которое полезно в реабилитации. Несмотря на то, что он не вызывает эйфории (преимущество в лечении), он достаточно силен, чтобы избежать синдромов ломки. Допустимо прописывать его для раковых больных в целях облегчения боли, что также устраняет потребность в марихуане. Изучение рецепторов привело к выявлению трех основных подтипов рецепторов морфия, которыми оказались G-белки (Gi). Они сдерживают образование аденил-циклазы в целевых нейронах, таким образом, увеличивая проводимость каналов калия, уменьшая проводимость каналов кальция и вызывая гиперполяризованное состояние. Как именно это приводит к обезболиванию неясно; пациенты, находящиеся на лечении для избавления от наркотической зависимости, говорят, что боль не ушла и даже не уменьшилась, они просто больше не воспринимают ее как нечто, вызывающее отвращение. Эндогенные лиганды для рецепторов, два из которых являются пентопептидами, выведенными из предшественников, были обнаружены и названы эндорфинами (эндогенный морфин). Амфетамин был впервые синтезирован в 1887. Он относится к фармокологически активным компонентам некоторых растений Восточной Африки и Китая и известен своими целебными свойствами. Раньше этот препарат прописывался в таблетках для лечения нарколепсии (внезапный сон) в 1935 и был отдан военным в 1940-ых для поддержания боевой готовности. В 50-ые и 60-ые годы он принимался студентами и дальнобойщиками для поддержания активности без сна и отдыха. Препарат медленно поглощается при оральном принятии, но когда вводится внутривенно или (особенно метамфетамин) ингаляцией, то вызывает чувство удовольствия, ведущее к злоупотреблению «скоростными чудачествами». Агенты класса амфетамина перемещаются допаминергическими нейронами, препятствуя реабсорбции допамина и ускоряя выбрасывание допамина из внутриклеточных пазух. Так как действие препарата проходит быстро, то лица, злоупотребляющие наркотиками, могут принимать дозы с двух часовыми интервалами в течение нескольких дней, а потом «ломаются» (спят в течение долгого периода). Привыкание возникает быстро, требуя увеличения доз, а последующее воздержание характеризуется вялостью, депрессией и, в основном, неприятными чувствами. Продолжительное употребление может вызвать галлюцинации и психозы, напоминающие параноидную шизофрению. Амфетамины запрещены для занятий спортом, потому что они улучшают исполнение. Но его производные все еще используются для борьбы с потерей веса для улучшения аппетита (включая фенолпропаноламин в Дексатриме и в Риталине) и для лечения гиперактивного дефицита внимания у детей.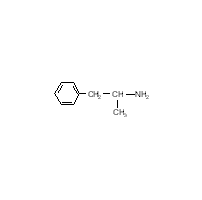 Амфетамин
Амфетамин 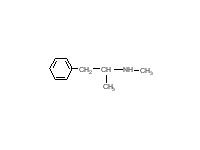 Метамфетамин Кокаин впервые был обнаружен в кустарнике Южной Америки. В период завоевания этого континента, испанцы впервые наложили запрет на привычку местных жителей жевать листья этого растения, но затем заметили, что рабы работали усерднее и дольше, когда им позволили жевать листья. Кокаин был добавлен в Кока-колу, производимую в 1886 г., пока он не был устранен в 1906 г. Позднее напитки с кокаином продавались в качестве альтернативы алкоголю как часть движения за трезвость. В 1914 г. федеральное правительство США установило запрет на продажу кокаина и опиума, как составляющих лекарственных препаратов, в аптеках. Такая практика ни к чему хорошему не привела. По оценкам экспертов в США насчитывается около полмиллиона наркоманов. Для достижения желаемого эффекта важен способ введения, обычно это ингаляции или внутривенные инъекции. Эйфория от кокаина длится в течение получаса, гораздо меньшее время, чем от амфетамина, а с увеличе нием дозы ведет к агрессии. Так же, как и с амфетамином, основа достижения удовольствия заключается в уменьшении реабсорбции допамина через дофаминергические нейроны. Недавно также было сообщено о роли серотонина в развитии наркотического эффекта. В больших концентрациях, однако, кокаин может также подавлять определенный рецепторы нейропереносчиков и даже блокировать аксонные натриевые каналы. Это способность была задействована в разработке производных, таких как прокаин и лидокаин, которые широко используются как местные анастетики. Ниже даны их структуры:
Метамфетамин Кокаин впервые был обнаружен в кустарнике Южной Америки. В период завоевания этого континента, испанцы впервые наложили запрет на привычку местных жителей жевать листья этого растения, но затем заметили, что рабы работали усерднее и дольше, когда им позволили жевать листья. Кокаин был добавлен в Кока-колу, производимую в 1886 г., пока он не был устранен в 1906 г. Позднее напитки с кокаином продавались в качестве альтернативы алкоголю как часть движения за трезвость. В 1914 г. федеральное правительство США установило запрет на продажу кокаина и опиума, как составляющих лекарственных препаратов, в аптеках. Такая практика ни к чему хорошему не привела. По оценкам экспертов в США насчитывается около полмиллиона наркоманов. Для достижения желаемого эффекта важен способ введения, обычно это ингаляции или внутривенные инъекции. Эйфория от кокаина длится в течение получаса, гораздо меньшее время, чем от амфетамина, а с увеличе нием дозы ведет к агрессии. Так же, как и с амфетамином, основа достижения удовольствия заключается в уменьшении реабсорбции допамина через дофаминергические нейроны. Недавно также было сообщено о роли серотонина в развитии наркотического эффекта. В больших концентрациях, однако, кокаин может также подавлять определенный рецепторы нейропереносчиков и даже блокировать аксонные натриевые каналы. Это способность была задействована в разработке производных, таких как прокаин и лидокаин, которые широко используются как местные анастетики. Ниже даны их структуры:  Кокаин
Кокаин  Лидокаин Один из наиболее часто употребляемых наркотиков получен из растения марихуаны. Основным составляющим марихуаны является Δ9-тетрагидроканнабинол (ТНС):
Лидокаин Один из наиболее часто употребляемых наркотиков получен из растения марихуаны. Основным составляющим марихуаны является Δ9-тетрагидроканнабинол (ТНС): 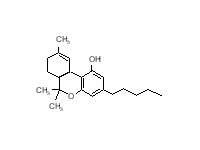 Поглощение достаточного количества ТНС обычно вызывает чувство эйфории, которое может длиться несколько часов. Оно может сопровождаться беспорядочными мыслительными процессами и психомоторными проявлениями (координация, время реакции), которые длятся полдня, так что следует воздержаться от вождения автомобиля. Уменьшение чувствительности к доставляющим удовольствие эффектам приходит с повторяющимися высокими дозами за короткие интервалы времени. Однако невозможно продемонстрировать психическую зависимость на животных или людях в соответствии с условиями обычного употребления. Употребление сильных антагонистов показало, что могут появиться симптомы ломки, однако такие симптомы обычно незаметны, потому что время полужизни ТНС в крови достаточно высоко (приблизительно день). Недавно с помощью радиоактивного лиганда рецепторы для ТНС были определены как члены надсемества G-белков. Это привело к идентификации эндогенного лиганда, названного анандамидом (санскрит для «блаженства»), который оказался производным арахидоновой кислоты – компонента липидной мембраны. Любопытно, что анандамид является растворимым липидом, он не хранится в везикуле, подобно другим нейропереносчикам. Это позволяет предположить существование другого класса лигандов. Рецепторы ТНС обнаружены в двух изоформах, одни – в центральной нервной системе, и другие – в клетках иммунной системы, такие как макрофаги, потенциально обеспечивающие основу для некоторых реакций, которые могут влиять на иммунные функции из-за употребления марихуаны. Связанный с рецепторами ТНС уменьшает производство сАМР в нейронах, приводя к уменьшению активности кальциевых и калиевых каналов. Как именно это приводит к возникновению удовольствия неясно, но недавно было показано, что введение ТНС крысам приводит к высвобождению допамина в ядрах accumbens, подобно высвобождению эндрофинов.
Поглощение достаточного количества ТНС обычно вызывает чувство эйфории, которое может длиться несколько часов. Оно может сопровождаться беспорядочными мыслительными процессами и психомоторными проявлениями (координация, время реакции), которые длятся полдня, так что следует воздержаться от вождения автомобиля. Уменьшение чувствительности к доставляющим удовольствие эффектам приходит с повторяющимися высокими дозами за короткие интервалы времени. Однако невозможно продемонстрировать психическую зависимость на животных или людях в соответствии с условиями обычного употребления. Употребление сильных антагонистов показало, что могут появиться симптомы ломки, однако такие симптомы обычно незаметны, потому что время полужизни ТНС в крови достаточно высоко (приблизительно день). Недавно с помощью радиоактивного лиганда рецепторы для ТНС были определены как члены надсемества G-белков. Это привело к идентификации эндогенного лиганда, названного анандамидом (санскрит для «блаженства»), который оказался производным арахидоновой кислоты – компонента липидной мембраны. Любопытно, что анандамид является растворимым липидом, он не хранится в везикуле, подобно другим нейропереносчикам. Это позволяет предположить существование другого класса лигандов. Рецепторы ТНС обнаружены в двух изоформах, одни – в центральной нервной системе, и другие – в клетках иммунной системы, такие как макрофаги, потенциально обеспечивающие основу для некоторых реакций, которые могут влиять на иммунные функции из-за употребления марихуаны. Связанный с рецепторами ТНС уменьшает производство сАМР в нейронах, приводя к уменьшению активности кальциевых и калиевых каналов. Как именно это приводит к возникновению удовольствия неясно, но недавно было показано, что введение ТНС крысам приводит к высвобождению допамина в ядрах accumbens, подобно высвобождению эндрофинов.
Репродуктивная система
Известно, что многочисленные химические вещества оказывают влияние на репродуктивные функции мужчин и женщин. В некоторых случаях репродуктивная система поражается механизмами, которые не специфичны, а относятся к другим тканям (например металлы, которые связывают белки или разрушают клеточные мембраны). В других случая репродуктивная система является первоначальной мишенью, но точный механизм не известен. Подход в этом представлении концентрируется на гормональных механизмах токсичности, корые более изучены. Для некоторых соединений будет проиллюстрировано влияние метаболизма, хотя они действуют не через гормональный механизм. Взгляд на физиологию и эндокринологию процесса репродукции помогает рационализировать действие многих токсикантов, влияющих на репродукцию. Главный участник в поддержании гормонального баланса – гипофиз, расположенный в основании мозга. Эта главная эндокринная железа секретирует разнообразные гормоны, которые регулируют секрецию других желез. Например, стероидный стимулирующий гормон (FSH) стимулирует тиреоидную железу для производства стероидного гормона Т3. Адренокортикотропный гормон (АСТН) стимулирует надпочечники для производства гидрокортизона. Пролактин стимулирует молочную железу для производства составных частей молока. Гормон роста стимулирует печень для производства соматомединов. Одной из важнейших частей репродукции является секреция гипофизом фолликуло-стимулирующего гормона и LH-гормона, которые действуют на гонады для стимулирования созревания клеток зародыша и половых стероидов, соответственно. Гипоталамус является центральной частью «гипоталамо-гипофизарно-гонадной цепи». Гипоталамус, реагирующий на сигналы мозга, секретирует разнообразные гормоны, которые взаимодействуют со специфичными типами клеток в гипофизе для высвобождения других гормонов. Гонадотропный гормон (GnRH) стимулирует центральные клетки гипоталамуса для секреции FSH и LH. Далее FSH стимулирует клетки в семяносных канальцах мужской половой железы, поддерживая, таким образом, производство спермы. Тем временем LH стимулирует клетки в мужской половой железе для синтеза тестостерона. Этот гормон входит в цикл и влияет на функции вторичных мужских половых органов (простаты, семенного пузырька). Он также участвует в петле негативной обратной связи, которая регулирует секрецию гормонов из гипоталамуса и гипофиза, так что уровни половых стероидов поддерживаются на нормальном уровне. Сценарий у женщин аналогичен. У женщин матка и молочные железы являются вторичными половыми органами, на которые действуют эстроген и прогестерон. Цепь обратной связи, включающая в себя гипофиз и гипоталамус, точно такая же, но более сложная. Овуляция. При рождении у новорожденной содержится 3-4*105 незрелых фолликул, но к половой зрелости половина теряется самопроизвольно и к 30 годам их количество составляет порядка 25 тысяч. В течение репродуктивного времени жизни женщины 200-300 из них созревает. В каждом цикле несколько фолликул разрушается, но обычно только одна из них выпускается в яйцеклетку (рис 30-15). После освобождения, остаток фолликул секретируют прогестерон для приготовления слизистой оболочки матки к беременности. Если яйцеклетка оплодотворяется, эмбрион секретирует хорион-гонадотропный гормон (hCG). Это стимулирует оставшиеся фолликулы продолжать секретирование прогестирона до тех пор пока плацента сможет принять на себя эту функцию. Для понимания естественного цикла овуляции и того, как он может быть нарушен токсичными веществами или умышленно контрацептическими веществами было сделано исследование гормональных влияний на этот процесс. В начале цикла FSH ведет к созреванию нескольких фолликул в яичнике и к увеличению эстрогена. Когда уровень эстрогена возрастает до критического уровня, гипофизом секретируется LH, который вызывает овуляцию, продолжая значительно увеличивать уровень прогестерона. Если оплодотворение не происходит, то уровень полового стероидного гормона уменьшается до начального значения. Отмечено, что гормональные сигналы являются эффективными. Ткани у женщин и мужчин должны чувствовать уровни половых стероидов и других гормонов по средством их соответственных рецепторов на поверхности клеток, для таких полипептидов как FSH и LH, или цитоплазматических рецепторов для стероидов. Контрацепция. В прошлом веке ученые подтвердили, что секреция из яичника предотвращает овуляцию в течение беременности. Согласно с этим в 1927г было опубликовано, что кормление грызунов экстрактами яичников и плаценты вызывало временное бесплодие. К 1937г прогестерон был изолирован из яичника. Также было обнаружено, что он может быть контрацептивом для кроликов и крыс. В 1950-х годах была показана способность прогестерона прекращать овуляцию у людей при проведении клинических испытаний. В 1970-х годах доза была понижена для избежания побочных эффектов. Также было обнаружено, что эстроген действует совместно с прогестероном, так что маленькая доза синтетического эстрогена была включена в производстве таблеток. Это давало эффективное подавление FSH и LH маленькой дозой стероидов. Более поздняя работа в 1981г по синтезу половых стероидов привела к разработке вещества под названием RU484. Это вещество является лигандом для прогестеронового рецептора, блокирующим его функцию (антогонист). Таким образом, если принимать его в период первых девяти недель беременности, то это изменяет подготовку утробного содержимого и вызывает отчуждение эмбриона. RU484 используется во Франции с 1988г для терапевтических абортов. Продолжаются попытки ввести это вещество в применение в США. Терапевтические эстрогены. Обычно после менопаузы уменьшение эстрогена приводит к ощущению дискомфорта. Уменьшение эстрогена также приводит к остеопорозу (утоньшению костей) в 25% случаев у женщин после менопаузы, поэтому они имеют высокую вероятность перелома бедра при незначительном происшествии. Для смягчения этих симптомов предпринимается эстроген-замещающая терапия, которая имеет выгодную сторону, понижая сердечно-сосудистые заболевания. Первоначально использовались чрезмерно большие дозы, однако это влекло за собой повышение риска внутриматочной карциномы в 5-15 раз. Сейчас используется комбинированная гормон-замещающая терапия, которая обеспечила понижение эстрогеновых доз и включает низкие дозы прогестина, который ингибирует размножение внутриматочных клеток.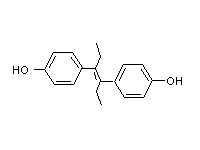 Диэтилстилбестрол Синтетический эстроген DES (диэтилстилбестрол) является примером терапевтического гормона,который при употреблении беременными женщинами вызывает серьезные разрушающие эффекты в половых органах младенцев обоих полов. Он также вызывает редкие случаи рака половых органов у младенцев женского пола. Это обстоятельство повлекло за собой запрет на использование этого гормона в течение беременности. Эстрогены из окружающей среды. Примерно с середины 20-го века известно, что растения содержат имитаторы гормонов млекопитающих, которые могут нарушать репродукцию у домашних животных. Первые заключались в том, что определенный тип клевера, растущий в Австралии, содержит по крайней мере пять фитоэстрогенов, влияние которых при употреблении в пищу мешает репродукции овец. Подобные наблюдения были сделаны и у других домашних животных и у диких видов, употребляющих клевер в пищу. Тестирование экстрактов растений на активность первоначально показало способность эстрогеновых соединений вызывать увеличение половых путей у грызунов женского пола. После биоисследования грызунов, позволившего идентифицировать такие соединения (коуместрол), аналитические тестирования показали, что большенство жидких белковых концентратов, содержащих фитоэстрогены, не вызывают проблем.
Диэтилстилбестрол Синтетический эстроген DES (диэтилстилбестрол) является примером терапевтического гормона,который при употреблении беременными женщинами вызывает серьезные разрушающие эффекты в половых органах младенцев обоих полов. Он также вызывает редкие случаи рака половых органов у младенцев женского пола. Это обстоятельство повлекло за собой запрет на использование этого гормона в течение беременности. Эстрогены из окружающей среды. Примерно с середины 20-го века известно, что растения содержат имитаторы гормонов млекопитающих, которые могут нарушать репродукцию у домашних животных. Первые заключались в том, что определенный тип клевера, растущий в Австралии, содержит по крайней мере пять фитоэстрогенов, влияние которых при употреблении в пищу мешает репродукции овец. Подобные наблюдения были сделаны и у других домашних животных и у диких видов, употребляющих клевер в пищу. Тестирование экстрактов растений на активность первоначально показало способность эстрогеновых соединений вызывать увеличение половых путей у грызунов женского пола. После биоисследования грызунов, позволившего идентифицировать такие соединения (коуместрол), аналитические тестирования показали, что большенство жидких белковых концентратов, содержащих фитоэстрогены, не вызывают проблем. 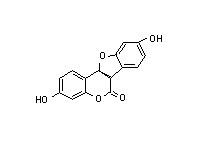 Коуместрол В начале изучения рецепторов для гормонов исследователи были поражены совершенной стереоселективностью этих белков: малейшие изменения в структуре лиганда обычно вызывали драматические эффекты, влияющие на их свойства и последующую активность. Удивительно было обнаружить, что химические соединения из окружающей среды, которые не были близко похожи на эстроген, были способны связываться с этими рецепторами, хотя и слабо, а также имели незначительное гормональное действие.
Коуместрол В начале изучения рецепторов для гормонов исследователи были поражены совершенной стереоселективностью этих белков: малейшие изменения в структуре лиганда обычно вызывали драматические эффекты, влияющие на их свойства и последующую активность. Удивительно было обнаружить, что химические соединения из окружающей среды, которые не были близко похожи на эстроген, были способны связываться с этими рецепторами, хотя и слабо, а также имели незначительное гормональное действие.  o, p’-DDT Среди первых пестицидов это качество было открыто у о, р’-DDT. Позднее у таких веществ была обнаружена способность вызывать губительные эффекты на дикую природу (включая птиц и рыб), а также и у людей в случаях высокого уровня воздействия. После этого, для многих веществ была показана способность быть слабыми лигандами для эстрогенового рецептора. В многочисленных поселениях Европы, благодаря индустриальным загрязнителям речных вод, мужские особи рыб аккумулируют в печени белки, называемые вителлогенинами, которые являются компонентами яйцеклеток женских особей. Эти белки появляются в результате стимулирования эстрогеном. Были замечены гормональные нарушения у мужских особей пантер во Флориде, которые предположительно вызываются загрязняющими веществами, состав которых остается невыясненным. Такие наблюдения повысили тревогу среди некоторых ученых, которые считают, что эстрогены из окружающей среды являются вероятной причиной ежегодного увеличения рака грудной железы приблизительно на 1% в США с 1940-х годов, а также случаев раннего полового созревания у девушек. Другие ученые скептичны и считают, что низкие уровни эстрогенов в окружающей среде являются достаточными для вызывания эффектов у всего населения, хотя чувствительные индивиды и те, кто живет в сильно загрязненных регионах, наиболее подвержены риску. Мишени в мужских половых органах. Семенные канальцы мужских половых желез генерируют порядка 106 сперматозоидов в день. Этот процесс требует надлежащую функцию клеток, расположенных между канальцами. Эти клетки стимулируются LH-гормоном для синтеза тестостерона, который необходим для стимулирования клеток Сертоли и других органов вне мужских половых желез. Надлежащая функция этих клеток, найденных на внутренней части канальцев, требует FSH-гормона. Клетки Сертоли – это оберегающие клетки для сперматогоний, помогающие им разделяться и созревать. По этой причине вещества, которые уменьшают количество этих клеток, вызывают сопутствующее уменьшение количества спермы. Два токсина, n-гексан и 1,3-динитробензол, влияют на репродуктивные функции мужчин. Мишенями для этих токсинов являются клетки Сертоли, но причины этого не ясны. Оба соединения становятся токсичными в результате реакций метаболизма. Для каждого случая возможно появление нескольких метаболитов. При метаболизме 1,3-динитробензола происходит удаление одной из его нитрогрупп с образованием нитрозил-анион радикала. Затем образуется нитрозопроизводное, затем гидроксиламин, и в конце образуется амин. Считается, что нитрозил-радикал и гидроксиламин неустойчивы и могут окисляться, образуя супероксиды. При высоких уровнях воздействия, цикл удаления и окисления производит больше супероксидов, чем клетка может подвергнуть детоксикации, в результате чего происходит разрушение.
o, p’-DDT Среди первых пестицидов это качество было открыто у о, р’-DDT. Позднее у таких веществ была обнаружена способность вызывать губительные эффекты на дикую природу (включая птиц и рыб), а также и у людей в случаях высокого уровня воздействия. После этого, для многих веществ была показана способность быть слабыми лигандами для эстрогенового рецептора. В многочисленных поселениях Европы, благодаря индустриальным загрязнителям речных вод, мужские особи рыб аккумулируют в печени белки, называемые вителлогенинами, которые являются компонентами яйцеклеток женских особей. Эти белки появляются в результате стимулирования эстрогеном. Были замечены гормональные нарушения у мужских особей пантер во Флориде, которые предположительно вызываются загрязняющими веществами, состав которых остается невыясненным. Такие наблюдения повысили тревогу среди некоторых ученых, которые считают, что эстрогены из окружающей среды являются вероятной причиной ежегодного увеличения рака грудной железы приблизительно на 1% в США с 1940-х годов, а также случаев раннего полового созревания у девушек. Другие ученые скептичны и считают, что низкие уровни эстрогенов в окружающей среде являются достаточными для вызывания эффектов у всего населения, хотя чувствительные индивиды и те, кто живет в сильно загрязненных регионах, наиболее подвержены риску. Мишени в мужских половых органах. Семенные канальцы мужских половых желез генерируют порядка 106 сперматозоидов в день. Этот процесс требует надлежащую функцию клеток, расположенных между канальцами. Эти клетки стимулируются LH-гормоном для синтеза тестостерона, который необходим для стимулирования клеток Сертоли и других органов вне мужских половых желез. Надлежащая функция этих клеток, найденных на внутренней части канальцев, требует FSH-гормона. Клетки Сертоли – это оберегающие клетки для сперматогоний, помогающие им разделяться и созревать. По этой причине вещества, которые уменьшают количество этих клеток, вызывают сопутствующее уменьшение количества спермы. Два токсина, n-гексан и 1,3-динитробензол, влияют на репродуктивные функции мужчин. Мишенями для этих токсинов являются клетки Сертоли, но причины этого не ясны. Оба соединения становятся токсичными в результате реакций метаболизма. Для каждого случая возможно появление нескольких метаболитов. При метаболизме 1,3-динитробензола происходит удаление одной из его нитрогрупп с образованием нитрозил-анион радикала. Затем образуется нитрозопроизводное, затем гидроксиламин, и в конце образуется амин. Считается, что нитрозил-радикал и гидроксиламин неустойчивы и могут окисляться, образуя супероксиды. При высоких уровнях воздействия, цикл удаления и окисления производит больше супероксидов, чем клетка может подвергнуть детоксикации, в результате чего происходит разрушение.
Токсикокинетика
Четырьмя главными факторами, описывающими взаимодействие организма с токсичными веществами, являются абсорбция, распределение, метаболизм и выведение. Взаимодействие между этими свойствами схематически показаны на рис.15. При рассмотрении в кинетике токсичного воздействия, эти факторы часто анализировались в моделях, целью которых являлось дать возможность лучшей экстраполяции результатов среди видов, доз и химических соединений (смесей). Первые разработанные концепции, связанные с терапевтическими веществами, создают основу для фармакокинетического и токсико-кинетического моделирования. Множество примеров, встречающихся в литературе, касаются терапевтических лекарств, но легко могут быть отнесены к токсичным веществам. Действительно, избежание токсичных эффектов лекарственной передозировки является важным аспектом фармакокинетики. Изучение ферментативной кинетики в биохимических реакциях обеспечило полезную умозрительную основу возможности удаления токсичных веществ. Выражение Михаэлиса-Мэнтона [2] устанавливает связь первоначального темпа или скорости реакции (v) фермента (Е), производимого продукт (P) и концентрации субстрата [S] для простой биохимической реакции [1], как показано ниже. Vmax - максимальная скорость образования продукта. KM - мера сродства фермента к субстрату. [1] E+S-->ES-->EP-->E+P [2] v/Vmax=[S]/(Km+[S])Эти константы характеризуют внутренние свойства фермента. Из этих формул следует, что, когда [S] много больше, чем Km, то v приблизительно равно Vmax. Это означает, что ферменты производят продукты с максимальной скоростью, когда концентрация субстрата велика (фермент, так сказать, насыщен). Это имеет интуитивный характер. С другой стороны, заметим, что, если [S] меньше KM, то v=(Vmax/KM)[S]. В этом режиме скорость реакции пропорциональна концентрации субстрата. Это также имеет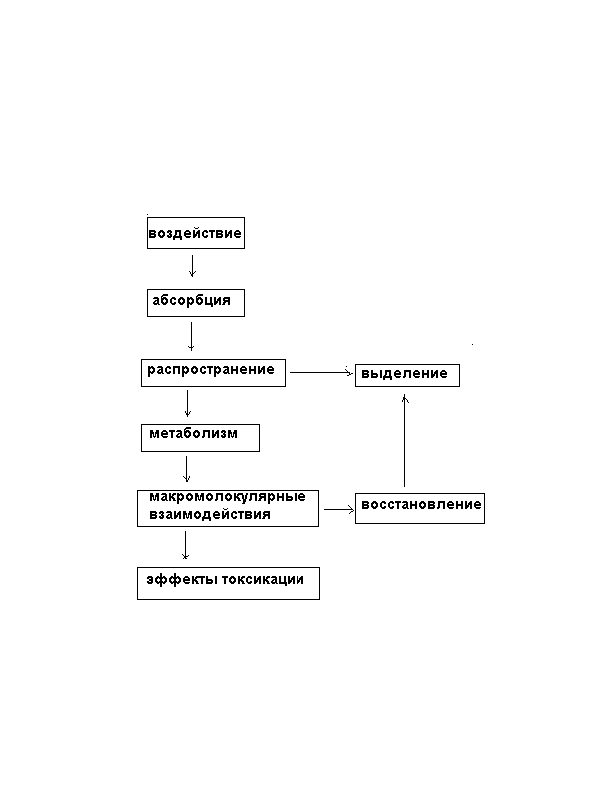 Рис. 15. Распределение токсинов смысл, когда фермент находится в большом избытке. Эти соотношения показаны на рис. 16, который также иллюстрирует, что скорость реакции равна половине максимальной, когда концентрации субстрата равна Km.
Рис. 15. Распределение токсинов смысл, когда фермент находится в большом избытке. Эти соотношения показаны на рис. 16, который также иллюстрирует, что скорость реакции равна половине максимальной, когда концентрации субстрата равна Km. 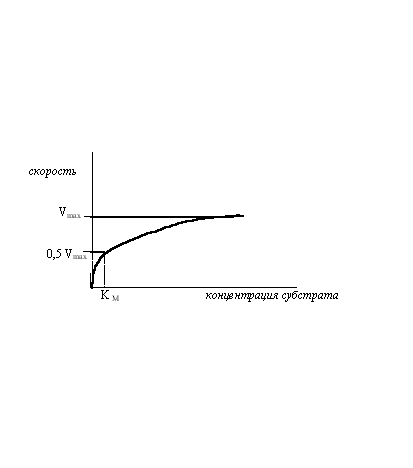 Рис. 16 Ферметативная кинетика Михаэлиса-Ментена. Гиперболическое взаимодействие между скоростью ферментативной реакции и концентрацией субстрата (М), описываемое ферментативной кинетикой Михаэлиса-Ментена. КМ – концентрация субстрата (М), при которой скорость реакции равна 0,5 Vmax Исключение токсичных веществ из организма может включать в себя некоторое количество процессов, а не только единственную биохимическую реакцию. Вопреки возможным, лежащим в основе, сложностям, скорость выведения обычно может быть описана кинетикой Михаэлиса-Мэнтона. Простейший случай, названный «нулевым порядком», соответствует режиму с высокой концентрацией, когда происходит насыщение ферментами метаболизма, и другие процессы удаления также работают с наивысшей скоростью. При этом условии, выведение является постоянной величиной, как функция, зависящая от времени. Таким образом, график концентрации в крови линеен все время. Часто встречающимся примером является этанол, который имеет максимальную скорость выведения, приблизительно равную 10мл/час. Как показано в таблице 3, выведение 50 мл этанола из человеческой кровеносной системы занимает около 5 часов. Таким образом, человек, который быстро выпьет два глотка крепкого спиртного напитка и затем по глотку каждые 2 часа, будет оставаться в умеренном интоксикационном состоянии. Отмечается, что 50 мл алкоголя распределяется по всему организму, создавая уровень в крови порядка 1 мг/мл (или 0,1%), при этом вождение транспорта является опасным.
Рис. 16 Ферметативная кинетика Михаэлиса-Ментена. Гиперболическое взаимодействие между скоростью ферментативной реакции и концентрацией субстрата (М), описываемое ферментативной кинетикой Михаэлиса-Ментена. КМ – концентрация субстрата (М), при которой скорость реакции равна 0,5 Vmax Исключение токсичных веществ из организма может включать в себя некоторое количество процессов, а не только единственную биохимическую реакцию. Вопреки возможным, лежащим в основе, сложностям, скорость выведения обычно может быть описана кинетикой Михаэлиса-Мэнтона. Простейший случай, названный «нулевым порядком», соответствует режиму с высокой концентрацией, когда происходит насыщение ферментами метаболизма, и другие процессы удаления также работают с наивысшей скоростью. При этом условии, выведение является постоянной величиной, как функция, зависящая от времени. Таким образом, график концентрации в крови линеен все время. Часто встречающимся примером является этанол, который имеет максимальную скорость выведения, приблизительно равную 10мл/час. Как показано в таблице 3, выведение 50 мл этанола из человеческой кровеносной системы занимает около 5 часов. Таким образом, человек, который быстро выпьет два глотка крепкого спиртного напитка и затем по глотку каждые 2 часа, будет оставаться в умеренном интоксикационном состоянии. Отмечается, что 50 мл алкоголя распределяется по всему организму, создавая уровень в крови порядка 1 мг/мл (или 0,1%), при этом вождение транспорта является опасным. | Время, час | Остаток этанол, мл | Устраненный этанол, мл | Устраненный этанол от оставшегося, мл |
| 0 | 50 | 0 | 0 |
| 1 | 40 | 10 | 20 |
| 2 | 30 | 10 | 25 |
| 3 | 20 | 10 | 33 |
| 4 | 10 | 10 | 50 |
| 5 | 0 | 10 | 100 |
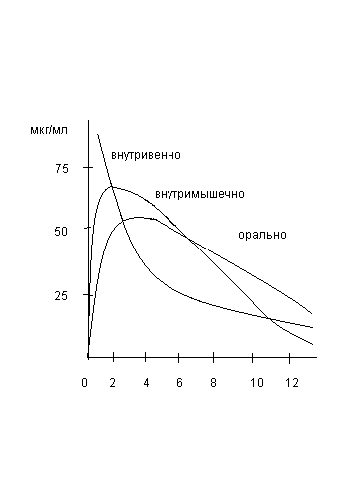 Рис. 16. Концентрация лекарства в плазме после внесения различными путями одинаковой концентрации. Оральное введение может также понизить эффективность дозы, доставленной в кровеносную систему в случае, если вещество значительно инактивировано первой стадией метаболизма в печени. Вещества, введенные в мышечную ткань, часто абсорбируются в кровеносную систему с низкой скоростью, в зависимости от их растворимости, которая может оказаться быстрее, чем при оральном введении, как показано на рис. 15., или медленнее. Ингаляционное введение газообразных веществ быстрее обеспечивает их попадание в кровеносную систему и помогает избежать первой стадии метаболизма. Кожное нанесение применимо для веществ, для которых медленное и равномерное введение является преимущественным. На сегодняшний день появилось большое количество лекарств в виде кожных повязок. Для токсичных веществ наиболее уместными способами введения, конечно, являются оральный, ингаляционный и кожный. Скорость абсорбции и распределения в организме является важным фактором в достижении фармакологической эффективности лекарств в определенных тканях. Соответствующая фармацевтическая терапия может быть проиллюстрирована на рис. 17, где лекарства, о которых идет речь, принимались орально и достигали минимально эффективной концентрации (МЭК) в крови за 8-9 часов. В данном случае приема, как показано, не достигается критическая минимальная концентрация токсинов (МКТ). Для лекарств, которые принимаются в течение долгого времени, периодическое введение соответственной дозы будет достигать терапевтического уровня, но не токсичного. На рис. 17 показана зависимость концентрации в крови от времени для гипотетического лекарства, принимаемого периодическими дозами. Отмечено, что лекарство накапливается в организме до тех пор, пока удаляемая доля не становится равной вводимой дозе во временной интервале. Отмечено, что наиболее часто повторяющийся интервал изменяется меньше. Если двойная доза вводится в двойном интервале, то изменения уровней в крови между максимальной и минимальной концентрацией будут удвоены; однако, передозировки для части интервала возможно избежать. Если очень важно поддержать постоянный уровень в крови (минимальная концентрация токсинов близка к минимально эффективной концентрации), то может быть использовано влияние лекарств путем внутривенного введения. Устранение значительного отставания времени достигается постоянством состояния, это может быть названо «дозой насыщения».
Рис. 16. Концентрация лекарства в плазме после внесения различными путями одинаковой концентрации. Оральное введение может также понизить эффективность дозы, доставленной в кровеносную систему в случае, если вещество значительно инактивировано первой стадией метаболизма в печени. Вещества, введенные в мышечную ткань, часто абсорбируются в кровеносную систему с низкой скоростью, в зависимости от их растворимости, которая может оказаться быстрее, чем при оральном введении, как показано на рис. 15., или медленнее. Ингаляционное введение газообразных веществ быстрее обеспечивает их попадание в кровеносную систему и помогает избежать первой стадии метаболизма. Кожное нанесение применимо для веществ, для которых медленное и равномерное введение является преимущественным. На сегодняшний день появилось большое количество лекарств в виде кожных повязок. Для токсичных веществ наиболее уместными способами введения, конечно, являются оральный, ингаляционный и кожный. Скорость абсорбции и распределения в организме является важным фактором в достижении фармакологической эффективности лекарств в определенных тканях. Соответствующая фармацевтическая терапия может быть проиллюстрирована на рис. 17, где лекарства, о которых идет речь, принимались орально и достигали минимально эффективной концентрации (МЭК) в крови за 8-9 часов. В данном случае приема, как показано, не достигается критическая минимальная концентрация токсинов (МКТ). Для лекарств, которые принимаются в течение долгого времени, периодическое введение соответственной дозы будет достигать терапевтического уровня, но не токсичного. На рис. 17 показана зависимость концентрации в крови от времени для гипотетического лекарства, принимаемого периодическими дозами. Отмечено, что лекарство накапливается в организме до тех пор, пока удаляемая доля не становится равной вводимой дозе во временной интервале. Отмечено, что наиболее часто повторяющийся интервал изменяется меньше. Если двойная доза вводится в двойном интервале, то изменения уровней в крови между максимальной и минимальной концентрацией будут удвоены; однако, передозировки для части интервала возможно избежать. Если очень важно поддержать постоянный уровень в крови (минимальная концентрация токсинов близка к минимально эффективной концентрации), то может быть использовано влияние лекарств путем внутривенного введения. Устранение значительного отставания времени достигается постоянством состояния, это может быть названо «дозой насыщения». 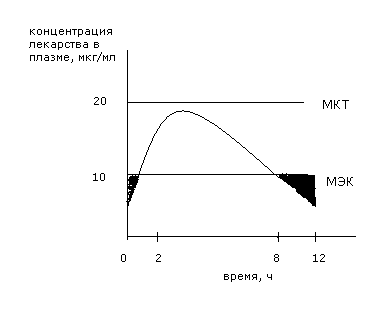 Рис. 17. Зависимость концентрации лекарства в крови от времени Ее можно сосчитать из объема распределения (Vd) для лекарства и желаемой концентрации в плазме крови (Cp), что показывает, какое количество лекарства может быть введено путем инъекции (напомним, что Vd=доза/Cp). Многочисленные фармацевтические и токсичные вещества (например, этанол) без труда распространяются по организму, который можно рассматривать как изолированную систему. С другой стороны, многие вещества накапливаются в определенных органах или тканях. Для таких веществ удобно, может быть, смоделировать организм, в котором содержатся две системы с концентрациями С1 и С2, как показано ниже. Доза --> Центральная система С1 --> Периферическая система С2 Центральная система обычно состоит из крови и органов, с которыми быстро уравновешивается вещество на том же уровне, что и в крови. Периферическая система состоит из тканей, в которых концентрируется вещество или, где уравновешивание происходит медленно. Это обычно жировые ткани для липидо-растворимых веществ, костная ткань для стронция или ткани щитовидной железы для йода. После внутривенной дозы вещества, концентрация в центральной системе падает быстрее, нежели после инъекции. Концентрация в периферической системе растет и может превышать концентрацию в центральной системе. Затем вещество выводится с одинаковой скоростью из обеих систем. Для веществ, которые накапливаются, выведение обычно лимитируется скоростью, с которой вещество перераспределяется из периферической в центральную систему. Отмечено, что фактическая кривая концентрации в крови в зависимости от времени может быть принята как 1/2, чемпроцесс первого порядка выведения (распределения) с более коротким в более поздних процессах первого порядка, которые могут доминировать в результате перераспределения. Главной целью моделирования является помощь в прогнозировании фармакологических и токсических эффектов. Сюда также включено обеспечение большей точности и систематичности. Заложенные в основе физиологические модели более непонятны. В различных моделях системы различаются (например, система для бензола включает легкие для выделения) и потоки жидкости приспосабливаются к важным особенностям процесса для каждого вещества. Ключевой особенностью таких моделей является включение разделительных коэффициентов, которые обеспечивают приспособление для различающихся способностей задерживания веществ каждой системой. В принципе, эти модели могут позволять экстраполяцию эффектов от одной начальной дозы до другой или от одного вида к другому. Важность разделительных коэффициентов можно увидеть на рис. 18. Отмечается, что вдыхаемые газы с большими разделительными коэффициентами кровь/воздух хорошо аккумулируются в крови. Более того, вещества, имеющие высокий коэффициент, например, жировая ткань/кровь хуже аккумулируются в крови, т.к. требуется больше времени, чтобы их концентрация стала максимальной.
Рис. 17. Зависимость концентрации лекарства в крови от времени Ее можно сосчитать из объема распределения (Vd) для лекарства и желаемой концентрации в плазме крови (Cp), что показывает, какое количество лекарства может быть введено путем инъекции (напомним, что Vd=доза/Cp). Многочисленные фармацевтические и токсичные вещества (например, этанол) без труда распространяются по организму, который можно рассматривать как изолированную систему. С другой стороны, многие вещества накапливаются в определенных органах или тканях. Для таких веществ удобно, может быть, смоделировать организм, в котором содержатся две системы с концентрациями С1 и С2, как показано ниже. Доза --> Центральная система С1 --> Периферическая система С2 Центральная система обычно состоит из крови и органов, с которыми быстро уравновешивается вещество на том же уровне, что и в крови. Периферическая система состоит из тканей, в которых концентрируется вещество или, где уравновешивание происходит медленно. Это обычно жировые ткани для липидо-растворимых веществ, костная ткань для стронция или ткани щитовидной железы для йода. После внутривенной дозы вещества, концентрация в центральной системе падает быстрее, нежели после инъекции. Концентрация в периферической системе растет и может превышать концентрацию в центральной системе. Затем вещество выводится с одинаковой скоростью из обеих систем. Для веществ, которые накапливаются, выведение обычно лимитируется скоростью, с которой вещество перераспределяется из периферической в центральную систему. Отмечено, что фактическая кривая концентрации в крови в зависимости от времени может быть принята как 1/2, чемпроцесс первого порядка выведения (распределения) с более коротким в более поздних процессах первого порядка, которые могут доминировать в результате перераспределения. Главной целью моделирования является помощь в прогнозировании фармакологических и токсических эффектов. Сюда также включено обеспечение большей точности и систематичности. Заложенные в основе физиологические модели более непонятны. В различных моделях системы различаются (например, система для бензола включает легкие для выделения) и потоки жидкости приспосабливаются к важным особенностям процесса для каждого вещества. Ключевой особенностью таких моделей является включение разделительных коэффициентов, которые обеспечивают приспособление для различающихся способностей задерживания веществ каждой системой. В принципе, эти модели могут позволять экстраполяцию эффектов от одной начальной дозы до другой или от одного вида к другому. Важность разделительных коэффициентов можно увидеть на рис. 18. Отмечается, что вдыхаемые газы с большими разделительными коэффициентами кровь/воздух хорошо аккумулируются в крови. Более того, вещества, имеющие высокий коэффициент, например, жировая ткань/кровь хуже аккумулируются в крови, т.к. требуется больше времени, чтобы их концентрация стала максимальной.  Рис. 18. Эффект разделительного коэффициента на концентрацию в крови у крыс. Уровень изучаемого вещества в крови в зависимости от времени часто является критерием, по которому судят об успешности модели. Уровень вещества в крови является наиболее доступным для измерения, но реальной целью часто являются другие ткани или молекулярный рецептор где-нибудь еще. Остается актуальным, что уровень вещества в крови будет пропорционален уровню в какой-нибудь данной ткани. Вдобавок, уровень в ткани затем будет пропорционален концентрации доступной клеткам-мишеням или рецепторам. Если вещество подвергается метаболизму, частично лимитирующего его стабильность, то ситуация более сложная. Но, в принципе, в этом случае можно применить ту же линию рассуждений, учитывая скорость и метаболические процессы, распространение, время жизни и разделительный коэффициент. В итоге можно было бы предсказывать концентрацию дозы основного токсина в конкретной ситуации, затем провести межвидовую экстраполяцию
Рис. 18. Эффект разделительного коэффициента на концентрацию в крови у крыс. Уровень изучаемого вещества в крови в зависимости от времени часто является критерием, по которому судят об успешности модели. Уровень вещества в крови является наиболее доступным для измерения, но реальной целью часто являются другие ткани или молекулярный рецептор где-нибудь еще. Остается актуальным, что уровень вещества в крови будет пропорционален уровню в какой-нибудь данной ткани. Вдобавок, уровень в ткани затем будет пропорционален концентрации доступной клеткам-мишеням или рецепторам. Если вещество подвергается метаболизму, частично лимитирующего его стабильность, то ситуация более сложная. Но, в принципе, в этом случае можно применить ту же линию рассуждений, учитывая скорость и метаболические процессы, распространение, время жизни и разделительный коэффициент. В итоге можно было бы предсказывать концентрацию дозы основного токсина в конкретной ситуации, затем провести межвидовую экстраполяцию
Токсикология развития
Феномен рождения людей с дефектами озадачивал людей с древности. Влияние генетических факторов и факторов окружающей cреды стали рассматриваться в эмбриологии приблизительно за последние два столетия. В конце 19-го века работа с цыплятами, как главным предметом исследования дефектов глаз, сердца, нервной системы и скелета, вызывало недовольство у физиков и химиков. Поэтому работа проводилась на рыбах, амфибиях и рептилиях. Эмбрионы млекопитающих, обладающих пороками, стали рассматриваться для таких манипуляций не раньше 1930-х годов. Затем были предложены к рассмотрению существенные недостатки в питании (например, недостаток витамина А) и различные химические соединения как причины анатомических дефектов. В данное время найдено приблизительно около тысячи химических соединений, которые вызывают развитие аномалий у лабораторных животных. Первое убедительное доказательство того, что рождение людей с дефектами могло быть вызвано влиянием окружающей среды, появилось в 1940-х годах. Эпидемия инфекции вируса Рубелла в Австрии совпала с увеличением случаев дефектов глаз, сердца, ушей и с увеличением умственных отклонений среди детей, матери которых были инфицированы в течение беременности. Корреляция типа дефекта со временем инфицирования в течение беременности показала, что аномалии сердца и глаз появлялись главным образом в результате инфицирования в течение первых двух месяцев беременности, тогда как аномалии слуха и речи, а также умственные отклонения появлялись в результате инфицирования в течение третьего месяца беременности. Также незначительный относительный риск аномалий существует при инфицировании на более поздних стадиях беременности. Только в США насчитывается 20 000 детей, страдающих дефектами, которые вызваны вирусом Рубелла, что стимулирует программу иммунизации для предотвращения распространения этого потенциального бедствия. В конце 1950-х годов в Японии стало ясно, что воздействие метилированной ртути из окружающей среды может вызывать серьезные нарушения человеческого здоровья. Загрязнение залива Минамата этим веществом в промышленных стоках привело к высокой концентрации метилированной ртути в рыбах и моллюсках и высокому потреблению метилртути неподозревающими семьями, проживающими вблизи, для которых рыба была главным ингредиентом в рационе. В 1956 г. были описаны симптомы внутриутробных аномалий, таких как нарушения нервной системы (нарушение чувствительности и координации, общий паралич, после чего может наступить смерть). В тоже время, было зарегистрироны 7% случаев “идиотизма” среди новорожденных, получивших метилртуть посредством передачи через плаценту от матерей, подвергавшихся влиянию этого соединения. Полученная доза затем пополнялись новой дозой новорожденным через материнское молоко. Обследование школьников через несколько лет в старших группах, которые подвергались сильному внутриутробному воздействию, показало широкое распространение серьезного умственного отставания (18-30%). Последующие эпизоды с другими веществами показали, что некоторые химические соединения вызывали серьезное развитие проблем в случае доз, безопасных для матерей. Коварная проблема появления токсичных свойств у лекарств вышла в свет после трагедии, связанной с лекарством салидомидом, шокировавшей мир в начале 1960-х годов. Салидомид был разработан немецкой компанией и прописывался в Европе для предотвращения тошноты во время беременности. Этот препарат не продавался в США, так как FDA официально предупредила, что он обладает случайным побочным эффектом на периферическую нервную систему и поэтому нуждается в более глубоком изучении. В 1959 г. клиника в Гамбурге столкнулась с одним случаем, который был впоследствие назван салидомидный синдром (отсутствие конечностей или их сильное повреждение, часто происходящее при сопутствии дефектов сердца, глаз, ушей, почек, кишечника). В 1960 г. наблюдалось уже 30 случаев, а в 1961 г. в этой клинике зарегестрировано 154 случаев. Хотя до этого, в 1948-1958 годах не было зарегестрировано ни одного случая. Когда была обнаружена причина происходящего, лекарство было немедленно изъято, и синдром исчез, оставив 5850 жертв по всему миру. Ретроспективный анализ показал, что риск неправильного формирования плода был высоким, в частности, потому, что критический период (6-7 недель беременности) был сильно близок ко времени использования препарата. Эта эпидемия привела к развитию тестирования вторичного токсического влияния, принятого на федеральном уровне. Было посчитано количество инцидентов неправильного развития у детей в США. Большая доля эмбрионов, порядка 31%, погибла. Среди рожденных детей 4% имели серьезные дефекты при рождении. Картина изменялась до 6-7% к концу первого года. Незначительные дефекты составляли 14%, низкий вес у младенцев был в 7% случаев, нарушения в функциях нервной системы в 16-17%. Смертность младенцев в течение первого года жизни, обусловленная неправильным развитием, была меньше 1%. Эта картина показывает, что дефекты при рождении являются серьезной проблемой в обществе. Причины дефектов при рождении вызывают интенсивный интерес. Предполагается, что приблизительно 20% таких случаев вызвано генетическими причинами, возникающими либо при наследовании от родителей, либо из-за ошибок в репликации ДНК в прериод развития. Неустойчивость в материнской среде окружающей плод, возникающая из-за неправильного питания, приводит к 4% случае, а инфицирование матерей к 3% случаев. Низкая доля (1-2%) деформаций может возникать из-за физических причин (например, ампутация пуповины). Менее чем один процент случаев дефектов вызван химическими соединениями, а оставшиеся 65% или более случаев возникают из-за неизвестных причин. Устанавливать механизм действия яда в человеческом организме достаточно сложно, фактически известно только около 50 таких веществ. Главной проблемой является то, как вычесть фоновое увеличение дефектов. Поэтому характерный пример высокого риска возникновения дефектов после лечения, как в случае с салидомидом, облегчает идентификацию. Для нового вещества можно обнаружить случайное увеличение специфичных дефектов или синдромов, которые могут быть связаны с лечением в течение ранних стадий беременности. Дальнейшее исследование развития дефектов у животных может дать ясное представление в будущем. Для предотвращения рождения детей с аномалиями, тестирование животных на развитие дефектов сейчас является частью стандартной программы исследования новых химических соединений. Однако ранние исследования соответствующих моделей на млекопитающих показали, что разные виды значительно различаются по своей чувствительности. Последние исследования изотретинона (производного витамина А) показали, что люди в 25 раз более чувствительны к его тератогенному действию, чем кролики и в 250 раз чувствительнее мышей. Обезьяны приблизительно в 10 раз менее чувствительны, чем мы. Наблюдается также различие в чувствительности в зависимости от ткани. Даже среди приведенных видов наблюдаются разительные различия в чувствительности. В случае триамциполона (производное гидрокортизона), резистентная линия мышей продемонстрировала более быстрый метаболизм вещества, чем чувствительная линия, так что эмбриону досталось намного меньше вещества, которое приводит к формированию характерного дефекта вкуса. Можно представить, таким образом, большое влияние полиморфизма ферментов на индивидуальную чувствительность. В виду больших и часто непрогнозируемых видовых различий в чувствительности, приближение результатов тестирования животных к человеку является трудной задачей. Последний обзор тестирования животных показал, что из 38 известных человеческих тератогенов, только 20% были положительны для тестируемых лабораторных животных. Из 165 соединений считающихся нетератогенами для человека, 40% дало положительный результат при тестировании в более чем одном виде лабораторных животных. Все это свидетельствует о серьезности проблемы. Было отмечено, что даже если бы программа тестирования была сделана вовремя, когда разрабатывали салидомид, этот препарат все равно могли бы разрешить использовать. Трудности при интерпретации результатов для разных видов важно учитывать при изучении механизмов действия токсикантов, хотя это нелегкая задача. Механизм действия салидомида, например, до сих пор неизвестен. Как отмечалось ранее, внутриматочная cреда может быть источником проблем. Двумя важными примерами являются диабет и фенилкетонурия. Инсулин-зависимые диабетики могут адаптироваться к содержанию глюкозы в крови в пределах 150-250 мг/дл, но они могут не осозновать, что уровень сахара должен быть в значительной степени понижен до 95-120 мг/дл для предотвращения дефектов при рождении. В противном случае ребенок может страдать дефектами сердца и нервной системы. В идеальном случае уровень сахара в крови проверяется 4-8 раз в сутки, в том числе и ночью. Фенилкетонурия была выявлена в 1934 г., тем самым была найдена причина умственного отставания детей. Эта болезнь вызывается отсутствием фермента фенилаланин гидроксилазы. Когда фенилаланин не превращается в тирозин, создается его высокая концентрация в крови, что является токсичным для мозга новорожденного. Специальная диета с низким содержанием фенилаланина была разработана в 1953 г., в результате чего появилась возможность избежать умственного отставания, если начать вовремя ее применять. Проверка новорожденных началась в 1963г., так что младенцы с этой болезнью могут немедленно начать получать специальный рацион. Этот подход был настолько успешен, что сейчас люди, страдающие фенилкетонурией, имеют семьи. К несчастью, женщины с этим синдромом, которые не контролировали свою диету, рождают детей с врожденным умственным отставанием и аномалиями сердца. Фенилаланин передается от матери к ребенку через плаценту, так что плод может подвергаться воздействию. Симптомы могут быть значительно уменьшены тщательным контролем за диетой матери, но и это не гарантирует избежание эффекта. Экспериментальные исследования пороков развития на животных и эпидемиологические исследования на человеческой популяции показали, что определенное время воздействия в период беременности, особенно начало средней стадии, было критическим для формирования дефектов. Эти наблюдения могут быть рационализированы путем рассматривания стадий эмбрионального развития. На восьмой клеточной стадии, если произошло изолирование от других клеток, каждая клетка проявляет способность образовать эмбрион. Последующие деления дают увеличение бластоцисты, содержащей жидкость, заполняющей впадины тысячами клеток, большинство из которых предназначены для формированя поддерживающих тканей и только небольшая доля будет формировать плод. За малым исключением, обработка токсичным веществом на ранних стадиях обычно наносит вред жизнеспособности эмбриона или понижает темп роста, но не дает анатомических дефектов. В течение следующей фазы развития, внутренняя клеточная масса проходит гаструляцию, что предполагает формирование трех эмбриональных слоев (эктодермы, эндодермы, мезодермы), из которых развиваются различные ткани. Избирательная часть клеток имеет высокий темп размножения и формирует структуры, которые обнаруживаются в системах главных органов. Некоторые группы клеток мигрируют по эмбриону и участвуют в формировании различных структур. Зачатки органов формируются в течение первых 3-х – 8-ми недель. Клетки могут проявлять очень различающуюся чувствительность к токсичным веществам. Если определенные клетки селективно утрачены или даже если не происходит их миграции, то возникает большая вероятность развития порока, часто даже более чем в одной ткани. К восьмой недели беременности система органов в основном оказывается сформированной. После этого, главным образом, происходит быстрое увеличение числа клеток и полное развитие тонкой структуры ткани. Таким образом, воздействие токсичными химическими соединениями на определенные типы клеток в течение этого времени, как правило, вызывает морфологические аномалии и функциональные дефициты. Важнейшим примером могут быть изменения взаимодействия нервных окончаний. Когда нервные окончания запускают процесс, они связываются с нервными и многими другими клетками. Некоторые из этих взаимосвязей усиливались в течение последующего развития, в то время как другие взаимодействия были утеряны за ненадобностью. Этот процесс может быть изменен химическими соединениями, в результате чего могут даже возникать дефекты поведения. Эти дефекты могут не проявляться до определенного времени после рождения. Функциональные изменения иммунной системы, сердца, легких и печени также могут не проявляться сразу после рождения. Задержка роста и смертность являются главными явлениями в течение первых двух недель, до тех пор, пока клетки подвергаются специализации и происходит формирование зачатков эмбриональных органов. Последующее время, когда разнообразные системы органов являются восприимчивыми, проявляются значительные и незначительные дефекты. Воздействие в более позднее время ведет к функциональным изменениям. Отмечено, что нервная система имеет более долгий чувствительный период. Подобные зависимости могут существовать и для других видов, но время беременности (18 дней у мышей и 21 день у крыс, например) и чувствительные периоды могут быть разными. Эта информация может быть важной для открытия тестов и интерпретирования результатов. Плацента имеет решающие функции во время беременности, являясь проводником питания для внутриутробного плода. После разделения кровеносных систем матери и плода питательные вещества должны поступать через стенки кровяных сосудов матери, вступая во взаимодействия с тканями и стенками кровяных сосудов эмбриона. Это может являться барьером для перемещения токсичных веществ, однако, этот барьер не очень селективный. Например, гидрофобные соединения (например, метилированная ртуть) быстро проходят через него. Плацента проявляет способность метаболизировать токсические соединения. Курение матери стимулирует активность бензпирен-гидроксилазы, которая может активировать, либо инактивировать токсичные вещества, в то время как никотин в крови матери легко передается через плаценту и стимулирует скорость сердечного ритма у эмбриона. Сама плацента может наносить ущерб плоду. Так, у крыс кадмий является токсичным на средних и поздних стадиях беременности, несмотря на низкий эффект воздействия. Это связано с тем, что кадмий понижает поток крови между плацентой и транспортом питательных веществ через нее. Список известных токсикантов, действующих на развитие плода, продолжает расти. Случай с диэтилстильбензолом (DES) известен из прошлого. Этот синтетический эстроген был впервые синтезирован в 1938 г и в течение 10 лет прописывался беременным женщинам для предотвраащения выкидышей. В период с 1948 по 1971 г был проведен контроль 4 млн. женщин, что составило 7% от общего числа беременных. Общий режим дневной дозы составлял 5 мг в начале шестой недели беременности и увеличивался до 150 мг на 36-й недели. В 1971 г в Бостонской клинике восьми женщинам в возрасте от 15 до 22 лет была удалена аденомокарцинома влагалища. В литературе еще не было описано так много случаев. Причины были найдены в применении DES. После этого FDA запретило использовать DES в период беременности. К 1995 г было зарегистрировано 367 аналогичных случаев, которые продолжали появляться каждый год. Этот вид рака возникает редко, приблизительно один случай на тысячу женщин, подвергшихся воздействию DES, как инициатора опухоли. Дефецит питательных веществ или избыток витамина А известны с 1950-х гг., что внесло вклад в развитие токсикологии. В моделях на животных (мышах, хомяках) использование ретиноидной кислоты (активной формы витамина А) может вызывать неправильное образование лица, конечностей, сердца, нервной системы и скелета. Ретиноидная кислота изменяет экспрессию гена через специфичный рецепторный белок, который так же действует на Аh рецептор и экспрессируется во многих тканях. Этот механизм может иметь сильные эффекты, которые можно наблюдать при развитии цыпленка. В 1982 г фармацевтический препарат 13-цис-ретиноидной кислоты стал примененяться для удаления угревой сыпи у подростков. Несмотря на предупреждения врачей и на надписи на упаковке, весь следующий год сообщали об отклонениях в развитии младенцев у женщин, которые использовали это вещество. Изучение 115-ти беременных, которые принимали 13-цис-ретиноидную кислоту, показало, что у 18% женщин наблюдался самопроизвольный аборт, а у 26% родились дети с пороками развития. Другое исследование показало, что половина детей имели IQ меньше чем 85. Для уменьшения инцидентов токсичного отравления в будущем, были сделаны рекомендации по лимитированию его распространения среди женщин, имеющих сыпь, которые не имеют других альтернативных терапевтических средств. Наркотики являются наиболее известными химическими токсикантами. Потребление алкоголя во время беременности вызывает эмбриональный алкогольный синдром, характеризующийся замедленным ростом до и после рождения и характерным нарушением функций центральной нервной системы. Этот синдром, выявленный в начале 1970-х гг., отслеживался с 1979 г. Сейчас в США встречаемость этого синдрома составляет 2.2 случая на 10000 новорожденных, т.е. произошло увеличение в 4 раза со времени обнаружения. Синдром с высокой частотой встречается у детей, матери которых страдают алкоголизмом (2.5%). Порог потребления алкоголя для избежания синдрома не известен, но подсчитано, что потребление 1 гр. алкоголя в день вызывает уменьшение веса у новорожденных на 160 гр. Были предложены многочисленные механизмы для действия алкоголя как токсиканта. Вероятно, продукт метаболизма - высоко токсичный ацетальдегид, является решающим фактором. Однако, этанол сам изменяет функции одного из важнейшего нервно-трансмиссионного рецептора, тем самым нарушая нервную активность и, вероятно, сигналы нервной системы в период беременности. Употребление кокаина вызывает преждевременные роды, низкий вес у новорожденных, проблемы поведения и синдром неожиданной смерти у младенцев. Это вещество сужает кровеносные сосуды в плаценте, создавая тем самым дефицит питательных веществ у плода. Оно также влияет на нервные функции блокированием натриевых каналов, используемых в проводимости импульсов. Эффекты этого вмешательства становятся явными после рождения. Хотя кокаин вызывает серьезные проблемы со здоровьем, полагают, что влияние никотина до рождения при использовании табака ведет к более серьезным проблемам. Употребление табака в 25% случаев беременности ведет к низкому весу новорожденных, синдрому смертности младенцев и к устойчивым нарушениям при учебе и в поведении. В моделях на животных испытывалось влияние курения. Было отмечено замедление роста клеток и изменение синаптической активности. В дополнение к попыткам уменьшить использование табака, эти открытия также вызывают серььезные беспокойства о никотиновой замене для прекращения курения во время беременности.Дата: 2019-02-02, просмотров: 958.