Основные пути сигнальной трансдукции
Поможем в ✍️ написании учебной работы
Факторы роста и их рецепторы
Эпидермальный фактор роста (EGF) и тромбоцитарный фоктор роста (PDGF ) представляют собой небольшие полипептиды, стимулирующие рост особого типа клеток. Они вызывают множество эффектов, в том числе инициируют или стимулируют клеточный цикл. Рецепторы этих лигандов имеют общее строение - большой экстраклеточный домен и цитоплазматический домен. Рецепторы EGF и PDGF состоят из одной полипептидной цепи. Рецептор инсулина - димер. Эти рецепторы являются протеин киназами. Поиск специфических молекул-мишеней для токсических соединений в конечном счете свел все к изучению рецепторов. Обычно рецептор - это протеин, связывающий лиганд, в результате чего меняется его функция вместе с сигнальной трансдукцией. Важная особенность рецептора - высокая специфичность естественного лиганда. Это особенно важно для ответа рецептора на нужный лиганд и никакой другой. Это помогает связать две клетки в разных частях организма. Было показано, что даже нонамолярная концентрация гормона оказывает нужное влияние на клетку- мишень. Еще одно важное свойство - обратимость связи рецептора и лиганда. В животной клетке присутствует три основные категории рецепторов. Рецептор функционирует как одна из частей сигнального механизма. Первая группа рецепторов находится на поверхности клетки и связывается с крупными лигандами, которые не могут проникнуть в клетку (полипептидные гормоны). Второй вид рецепторов - стероидные, которые являются факторами транскрипции, чья способность влиять на экспрессию генов изменяется после связи с лигандом. Третья категория рецепторов состоит из ионных каналов. Они находятся на поверхности клетки, что позволяет ионам двигаться по градиенту концентрации, после того как рецептор свяжется с лигандом. Например, хорошо изученный G-белок стимулирует аденилат-циклазу, которая превращает АТР в АМР. Другой G-белок ингибирует аденилат- циклазу. Этот процесс очень важен, так как АМР влияет на многие функции клеток. Многие токсичные агенты повреждают рецепторы, так, например, доказано, что токсин холеры связывается со стимулирующим G-белком и необратимо активизирует его. Это приводит к неспособности всасывать воду эпителием кишечника, что, в конечном итоге, приводит к смерти от обезвоживания.Механизм действия ras белка
Ras принадлежит к большому семейству малых GTP-связывающих белков и регулирует клеточный рост и дифференцировку. В активном состоянии Ras связан с молекулой GTP, а в неактивном - с GDP. Обмен GDP на GTP стимулируется белковым фактором обмена гуанин нуклеотида (GEF, guanine nucleotide exchange factor). Гидролиз связанного с ras GTP до GDP осуществляется GTPаза активирующим белком (GAP, GTPase activating protein). Кроме того, белковый ингибитор диссоциации гуанин нуклеотида (GDI, guanine nucleotide dissociation inhibitor) способен поддерживать Ras в неактивном состоянии, ингибируя обмен гуанин нуклеотидов. Активация Ras опосредуется рецепторной тирозин киназой. После связывания ее рецепторной экстраклеточной части тирозин киназы с фактором роста и ее димеризации происходит взаимное фосфорилирование ее внутриклеточных доменов. Фосфорилирование создает благоприятную конформацию киназы для связывания с цитозольным белком Grb2 содержащим SH2 домен. Посредством этого домена Grb2 связан с GEF. Таким образом, GEF оказывается у внутренней поверхности клеточной мембраны, с которой связан Ras посредством гидрофобного остатка фарнезила. Происходит образование активного комплекса ras-GTP. Этот комплекс взаимодействует с серин/треонин киназой raf. Интересно, что Ras-GTP не повышает каталитическую активность raf, а просто привлекает ее из цитозоля к мембране, где она фосфорилирует другие связанные с мембраной белки. Эти события вызывают активацию ERK. При процессинге белка ras происходит его фарназилирование по аминокислотному остатку Cys-186, отщепление следующей после Cys-186 C-концевой части. Cys-186 становится C-концевым остатком ras и метилируется. Обратимое пальмитилирование других остатков цистеина ближе к С-концу ras повышает его сродство к мембране. Наиболее частыми онкогенными мутациями ras являются мутации в 12 и 61 кодонах. Мутация в 12 кодоне затрагивает GTP-связывающий сайт. 61 кодон входит в состав L4 домена, который изменяет свою конформациюпри гидролизе GTP. Белок ras фосфорилирует Raf белок, который в свою очередь активирует МЕК. Последний обладает двоякой специфичностью - фосфорилирует треонин и тирозин. Его мишень - ERK МАР киназа. Оба типа необходимы для активации МАР киназ.МАР киназы
Митоген активированные белки или МАР киназы играют важную роль в клеточных ответах, включая пролиферацию, генную экспрессию, ответ на гипертермию, УФ-излучение, повышение осмомолярности и т.д. МАР киназы являются серин/треонин киназами. Классические МАР киназы проходят в ядро где фосфорилируют свои мишени - факторы транскрипции. Альтернативеым путем является фосфорилирование цитоплазматических факторов. У дрожжей имеется четыре МАР киназных пути, которые функционально не зависят и регулируются разными каскадами киназ. Каждый из них регулируется уникальной киназой МАР киназы (МКК или МЕК). Кроме того, существуют и киназы киназы МАР киназы МЕКК. МАР киназы разделены на три подсемейства: 1. Внеклеточные сигнал регулируемые киназы ERK - осуществляют передачу сигнала внутрь клетки. 2. Стресс-активируемые протеин киназы или c-Jun NH2 терминальные киназы SAPK/JNK. 3. р38 киназа - играет критическую роль в воспалительном ответе. МАР киназы активируют работу многих генов, включая клеточный рост и дифференцировку. ERKs фосфорилируют и регулируют активность определенных ферментов, включая фосфолипазу A2 и р90 и ядерных факторов р62FCF и Elk-1, контролирующего несколько генов, включая c-fos. Белки JNKs фосфорилируют аминотерминальный трансактивированный домен c-Jun и ATF2. Они активируются различными стимулами, отличными от ERKs сигналов: тепловой шок, повышение осмомолярности, УФ-излучение. JNKs также могут активироваться агентами, взаимодействующими с рецепторами на клеточной поверхности: ФНОа, интерлейкин-1 или EGF. Более того, существуют доказательства того, что в то время как Ras контролирует активацию ERKs, члены Rho семейства (небольшие GTP-связывающие белки) - Rac1 и Cdc42 регулируют активность JNKs. Свойством Ras/MAPK пути является то, что они активируются под действием различных сигналов, но результат может быть различным. Когда клетки РС12 обрабатывали NGF (фактором роста нервов), то они дифференцировались, становились нейроноподобными и останавливали деление. После обработки EGF они получали сигнал для продолжения пролиферации. В обоих случаях в сигнальную трансдукцию вовлечены ERK MAPK. Различия, которые наблюдались в результате, можно объяснить еще не открытыми сигнальными путями. Однако основным различием является то, что NGF вызывает пролонгированное повышение Ras-GTP, тогда как EGF стимулирует только транзитный эффект. Но все же главная роль принадлежит ERK-MAPK мутации, при которой конститутивно активированные MEK вызывают дифференцировку клеток РС12. В последние годы был достигнут значительный прогресс в исследовании сигнальной трансдукции при развитии, где объектом исследования служили нематоды С.elegans и дрозофила. Для анализа формирования вульвы C.elegans и фоторецепторных клеток глаз дрозофилы была использована комбинация биохимических и генетических методов. Эти системы были изучены так подробно, что считалось, что больше в них нельзя обнаружить ничего нового. Но в 1995 была открыта система KSR-1. Потеря функции Ras или другого компонента вызывает потерю вульвы при формировании гермафродитных червей, тогда как увеличение функции приводит к формированию избыточных вульв (мультивульварный фенотип). Этот Ras путь не единственный, но малейшие его нарушения меняют развитие вульвы. Найден новый белок - супрессор KSR-1, который действует параллельно или ниже. KSR (киназный супрессор Ras) - новая протеин киназа, необходимая для Ras сигнальной трансдукции. У дрозофилы обнаружено два гена, чьи продукты необходимы для активации Ras в сигнал с нормальной эффективностью. Первый кодирует бетта-субъединицу геранил- трансферазы типа I в плазматической мембране. Деффект в этом гене блокирует Ras-изопренизацию. Второй ген кодирует протеинкиназу, которую назвали киназный супрессор Ras (KSR). Она функционирует во многих рецепторных тирозин киназных путях. KSR был обнаружен и у млекопитающих. Основные пути сигнальной трансдукции у разных организмов представлены в табл. 8| C.elegans | Drosophila | Млекопитающие | |
| лиганд--> рецептор лиганда | Lin15 Lin3--> let23??? | boss--> sevenless | EGF--> EGFR |
| адаптор--> ???? фактор | let23-->? | DRK-->SOS | GRb-2-->SOS |
| GAP | let60--> | Ras1--> | Ras--> |
| MAPKK--> MAPK | lin-45--> Sur1 Mpn1 | D-Raf--> Rolled | Raf--> Erk |
Оксидативный стресс
Генерация кислородных радикалов (ROS) изучена слабо за исключением некоторых специализированных клеток. В фагоцитах под действием различных факторов активируется НАДФН-оксидазный комплекс, состоящий из четырех белков. Этот комплекс ответственен за перенос электронов с НАДФН на O2 c последующей генерацией супероксиданиона О2-, который спонтанно или ферментативно дисмутирует в Н2О2. В нейтрофилах активность НАДФН-оксидазного комплекса регулируется G-белком (GTP связывающим белком) Rac2, а в макрофагах - Rac1. Таким образом, Rac белки регулируют уровень активных форм кислорода (ROS) в клетке. Генерация ROS играет существенную роль в стимуляции факторов роста и цитокинов. Перекись водорода может участвовать в сигнальной трансдукции. Она активирует МАРК и c-Jun- стресс-активируемую протеин киназу (JNK/SAPK), а МАРК регулируется Ras белками. Rac1 регулирует JNK/SAPK. Принято считать, что эффекты ROS осуществляются посредством ковалентной модификации сульфгидрильных остатков критических белков. Если это так, то спектр их регуляторной деятельности широк: от активации тирозиновых фосфатаз до ФТ. Существует два пути действия ROS: 1. Модификация функции белка через фосфорилирование тирозиновых остатков 2. Модификация функции белка окислительно-восстановительными реакциями цистеиновых остатковТеломераза
Теломераза представляет собой рибонуклеопротеин, который синтезирует GC-богатые теломерные повторы (TTAGGC) на концах хромосом. Она компенсирует постепенное укорочение 5'концов линейной молекулы ДНК при репликации. Укорочение происходит из-за того, что РНК-затравку на 5' конце невозможно заменить на ДНК, так как ДНКполимераза обладает лишь 5'>3' полимеразной активностью. Таким образом, теломераза вносит вклад в стабильность хромосом. Было предположено, что укорочение теломер может лежать в основе работы митотических часов, которые регулируют лимит нормальных клеточных делений и старение. Реактивация теломеразы может быть критической для пролиферации опухоли, позволяющая клеткам избежать старения. Современная модель клеточного старения предполагает, что теломеры соматических клеток укорачиваются до тех пор, пока они достигнут стадии М1, в которой длина теломеры препятствует дальнейшему клеточному делению, а теломераза больше не активна. Митотическое старение во многих клетках опосредована р53 и Rb генами. Когда пройден М1 барьер, дальнейшая пролиферация приводит к укорочению хромосом, что в конце концов приводит к хромосомной нестабильности, р53-зависимой остановке клеточного цикла и клеточной смерти (М2).Раковые супрессорные гены.
Эти гены обычно доминантны по отношению к ПО. Мутация, которая инактивирует один аллель, может привести к трансформации. Опухоли могут образовываться по другому механизму: потери двух аллелей в локусе онкогенности. Мутации могут наследоваться через половые клетки, либо быть результатом соматических изменений. Развитие рака происходит из-за потери функции РСГ. Наиболее охарактеризованными РСГ являются р53 и Rb.RB белок
Ретинабластома - рак сетчатки, встречающийся у детей. Он передается по наследству, либо возникает спорадически. Заболевание связано с инактивацией обеих копий гена Rb и, как следствие, с отсутствием в клетке белкового продукта. Инактивация происходит в результате делеции локуса q14 тринадцатой хромосомы, несущего данный ген. Признак является рецессивным и проявляется в потомстве, если оба родителя несут хотя бы по одной инактивированной копии гена. Ненаследственная форма ретинобластомы крайне редка, так как для ее возникновения необходимо произойти мутациям в обеих копиях гена Rb. Кроме ретинобластомы инактивация Rb вызывает многие опухоли легких, мочевого пузыря и молочной железы. Как уже упоминалось выше, инактивация Rb на белковом уровне может осуществляться продуктами генов раковых вирусов, таких как SV40, аденовирус и вирус папилломы.Rb является фосфопротеином, играющим важную роль в регуляции перехода клетки из G1 в S фазу (Рис. 31 ).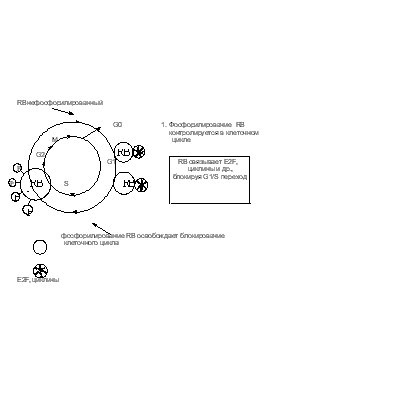 Рис. 31. Белок RB в регуляции клеточного деления Центральную роль в этом переходе играет E2F, фактор транскрипции некоторых генов, необходимых для синтеза ДНК в S фазе. Он так же стимулирует транскрипцию генов циклина А, циклина Е и своего собственного гена. Белок pRb ингибирует E2F, связываясь с последним в G1 фазе. Факторы роста стимулируют транскрипцию циклина D. Происходит накопление комплексов циклин D - Cdk4, которые начинают фосфорилировать Rb, что приводит к его диссоциации от E2F. Высвободившийся E2F стимулирует транскрипцию своего гена и гена циклина Е. Образующийся вследствие этого комплекс CDK2-цЕ, еще активнее фосфорилирует pRb. Таким образом, сеть эффектов через петлю положительной обратной связи приводит к быстрому возрастанию E2F зависимой транскрипции и переходу клетки в начало S фазы. В конце митоза рRb дефосфорилируется. Переэкспрессия Rb препятствует клеточному росту. Это продемонстрировано на примере клеточной линии остеосаркомы, которая потеряла этот ген. При внесении гена Rb в культуру ее рост прекращается. Были обнаружены сходные с Rb белки, способные взаимодействовать с другими представителями семейства факторов транскрипции E2F.
Рис. 31. Белок RB в регуляции клеточного деления Центральную роль в этом переходе играет E2F, фактор транскрипции некоторых генов, необходимых для синтеза ДНК в S фазе. Он так же стимулирует транскрипцию генов циклина А, циклина Е и своего собственного гена. Белок pRb ингибирует E2F, связываясь с последним в G1 фазе. Факторы роста стимулируют транскрипцию циклина D. Происходит накопление комплексов циклин D - Cdk4, которые начинают фосфорилировать Rb, что приводит к его диссоциации от E2F. Высвободившийся E2F стимулирует транскрипцию своего гена и гена циклина Е. Образующийся вследствие этого комплекс CDK2-цЕ, еще активнее фосфорилирует pRb. Таким образом, сеть эффектов через петлю положительной обратной связи приводит к быстрому возрастанию E2F зависимой транскрипции и переходу клетки в начало S фазы. В конце митоза рRb дефосфорилируется. Переэкспрессия Rb препятствует клеточному росту. Это продемонстрировано на примере клеточной линии остеосаркомы, которая потеряла этот ген. При внесении гена Rb в культуру ее рост прекращается. Были обнаружены сходные с Rb белки, способные взаимодействовать с другими представителями семейства факторов транскрипции E2F.
Белок р53
Р53 - раковый супрессорный ген. Он получил свое название по молекулярной массе белкового продукта. Ген наследуется как аутосомная доминанта при синдроме Ли-Фраумени - редкой форме наследственного рака. У больных этим синдромом развивается рак различных органов, что связано с мутациями в гене р53. Изучение этих мутаций открыло новые свойства р53 и объяснило его связь с возникновением рака.P53 - ядерный фосфопротеин, который открыли в SV40 трансформированных клетках, в которых он связан с Т-антигеном. Повышенная экспрессия р53 была обнаружена во многих раковых клеточных линиях. В ранних экспериментах вставка клонированного р53 была найдена в иммортализованных клетках, в связи с чем его назвали онкогеном с обычной доминантной функцией. Но все трансформирующие формы р53 выключались в мутантных формах белка. И тогда они попали в категорию доминантных негативных мутантов, которые функционируют через подавление функции в диком типе. Наиболее общее формой доминантного негативного мутанта является та, которая формирует гетеродимерный белок, объединяющий субъединицу мутировавшего и дикого типа, в котором субъединица дикого типа не функционирует. Вероятно, р53 существует как тетрамер.Трансформированный фенотип образуется либо делецией обоих аллелей или точечной мутацией в одном из аллелей, которая продуцирует доминантный негативный фенотип . Обе ситуации найдены в раковых опухолях человека. Мутации р53 накапливаются во многих во многих типах рака человека, вероятно из за того, что потеря р53 стимулирует рост клетки, а для остановки роста нужен дикий тип р53. Многообразие видов рака дает основания предполагать, что р53 не тканеспецифичен, то есть он вовлечен в общий контроль пролиферации и потеря этого контроля может быть вторичным событием, которое стимулирует рост многих опухолей. Такая интерпретация предполагает, что нормальные клетки растут в сдержанной манере, которая обычно ингибируется р53. Какова функция р53 на молекулярном уровне? р53 был открыт как белок, связывающийся с большим Т-антигеном вируса SV40. В отличие от дикого типа, мутантные формы белка не способны связывать Т- антиген. Связывание дикого типа р53 с Т-антигеном коррелирует с его способностью стимулировать репликацию вируса. Одна возможность - р53 дикого типа связывается с клеточными аналогами Т-антигена, при этом ингибируется активность последнего. У мутантных форм такая способность теряется. Белок р53 является ДНК связывающим белком, узнающим специфичный мотив из 10 п.о. в активном промоторе, который содержит этот мотив. Для некотоых генов р53 может быть супрессором. р53 также регулирует экспрессию генов, контролирующих клеточный цикл. Этот белок связывается с последовательностью ДНК PuPuPuC(A/T)(T/A)GpyPyPy, которая содержится в некоторых промоторах. Сам белок р53, состоящий из 392 аминокислот, состоит из шести доменов: 1.N-концевой домен (1-50 амк.) вовлечен в транскрипционную активацию генов-мишеней (р21- ингибитор Cdk и другие гены, участвующие в остановке клеточного цикла, GADD45, 14-3-3-d, Bax). Он же ответственен за взаимодействие с Mdm2 - ингибитором р53. В этом участке находятся 7 остатков серина и треонина, являющиеся мишенями для киназ. 2.Дополнительный транскрипционный домен (43-73 амк.) для активации генов-мишеней. 3. Гибкий пролин-богатый домен (73-97амк.), в котором выявлены элементы РххР, важен для полного проявления супрессорной активности. Участвует в запуске апоптоза. Мишени - TBP, TFIID, SpII, HIF-1, STAT-5, Bcl-2, MDR-1, рецептор тироидного гормона. 4. Центральный домен (100-300 амк.), который узнает специфические последовательности ДНК. Именно в этом районе обнаружено большинство мутаций в раковых опухолях. 5. Участок, отвечающий за ядерную локализацию р53 (305-323амк.).альфа-спираль - участок, отвечающий за тетрамеризацию (323-356амк.). 6. Основный домен (363-392амк.) является мишенью для модифицирующих ферментов (киназ, ацетилаз, гликозилаз). В немодифицированной форме он препятствует образованию комплекса с ДНК. Кроме того, С-конец может может неспецифически связываться с одноцепочечной ДНК, непарными основаниями и концама ДНК, что указывает на его участие в узнавании повреждений ДНК и запуске репарации.Р53 называют "стражем генома". Он активируется в ответ на различные виды стресса и останавливает пролиферацию, а вслучае более серьезных повреждений запускает программу апоптоза - гибели клетки. Около 50% опухолей человека имеют дефектный р53. Большинство мутаций р53 возникает в позициях, где аминокислоты высококонсервативны. Это предполагает, что эти мутации связаны с консервативными функциями. Охарактеризованные мутации р53 вызывают эффекты, связанные с изменениями свойств белка, включая его время полужизни от 20 минут до нескольких часов, изменения его конформации, изменения его клеточной локализации от ядерной к цитоплазматической, изменения способности связываться с ДНК или Т-антигеном. Такая плейотропность делает затруднительным определить, какой из них связан с супрессией рака. Кроме Rb и р53 существует множество других генов супрессоров опухолей. В частности, к ним относятся р21, p16 и р27 - ингибиторы Cdk, которые будут рассмотренные в следующей главе, WT1 - супрессор транскрипции некоторых факторов роста и онкогенов bcl-2 и c-myc, NF1 - подавляет активность ras за счет активации ГТФаз.Дата: 2019-02-02, просмотров: 967.