от других представителей семейства Streptococcaceae и Enterococcus
| Виды стрептококков | Тест с желчью | Рост при + 45° С | ПИРА-тест | Тест с гиппуратом натрия |
| Streptococcus pneumoniae | + | - | - | - |
| Streptococcus pyogenes | - | - | + | - |
| Streptococcus agalactiae | (–) | - | - | + |
| Streptococcus spp . (группы viridians ) | (–) | (+) | (–) | (–) |
| Enterococcus spp . | - | + | + | (+) |
+ – признак положительный
– – признак отрицательный
(+) – признак чаще положительный
(–) – признак чаще отрицательный
Клинически значимым при остром воспалительном процессе, считают выделение S . pneumoniae из мокроты в количестве > 105 КОЕ/мл; из БАЛ > 104 КОЕ/мл; из биоптата, полученного с помощью защищенных щеток > 103 КОЕ/мл (МУ 4.2.3115 -13). При исследовании стерильных жидкостей организма (кровь, плевральная жидкость, ликвор) для постановки этиологического диагноза пневмококковой инфекции основанием служит выделение S . pneumoniae в любом количестве.
Определение чувствительности к антибиотикам
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах +35 (± 1) °С;
- анаэростат или CO2-инкубатор, поддерживающий температуру в камере в пределах +35 (± 1) °С, содержание CO2 на уровне 3 - 7 %;
- холодильник фармацевтический, поддерживающий температуру +4 + 8 °С для хранения культур, биологических субстратов и реагентов;
- спиртовки (газовые горелки);
- дозаторы переменного объема полуавтоматические (автоматические);
- прибор для определения концентрации бактериальных клеток (стандарт мутности по Мак-Фарланду);
- дополнительное оборудование для автоматизации процесса выделения и изучения микроорганизмов (автоматические анализаторы, диспенсеры дисков, приборы для оценки антибиотикочувствительности диско-диффузионным методом и методом серийных разведений и пр.);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты
- питательные среды для определения чувствительности S . pneumoniae на базе обогащенных субстратов универсальные (МХА с 5% кровью);
- диски с антибиотиками профильной группы, E-тесты, планшеты и стрипы с лиофилизированными бульонами и серийными разведениями антимикробных препаратов;
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанных в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- чашки бактериологические (Петри) для выращивания микробиологических культур;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- петли бактериологические;
- наконечники стерильные для дозаторов переменного объема;
- посуда мерная лабораторная стеклянная и пластиковая;
- газогенераторные пакеты;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Методами определения антибиотикочувствительности пневмококков являются: метод серийных разведений (количественный, референтный); диско-диффузионный метод (полуколичественный); Е-тест (промежуточный).
В национальных Федеральных клинических рекомендациях (ФКР) «Определение чувствительности микроорганизмов к антимикробным препаратам», 2014г. даны методология оценки чувствительности S . pneumoniae к антимикробным препаратам, пограничные значения МПК и зон подавления роста для определения клинических категорий чувствительности, экспертные правила оценки чувствительности по системе EUCAST.
Учитывая, что в большинстве клинических лабораторий России основным методом является диско-диффузионный, ниже приводятся параметры его постановки, согласно ФКР.
Питательная среда: агар Мюллер-Хинтон + 5% дефибринированной лошадиной крови и 20 мг/л β-НАД (МХ-П);
Инокулюм: показатель мутности 0,5 по стандарту МакФарланда (при использовании колоний с кровяного агара) и 1,0 (с шоколадного агара);
Инкубация: 5% СО2, 35 ± 1 º С, 18 ± 2ч.;
Учет результатов: Чашку Петри помещают дном книзу так, чтобы свет падал на поверхность агара под углом 45º С (в отраженном свете), снимают крышку. При измерении зон ориентируются на зону полного подавления видимого роста. При показателе S (чувствительный) инкубацию продлевают до 24 ч.;
Контроль качества: Streptococcus pneumoniae АТСС 49619.
Необходимо помнить, что пневмококки, как все грамположительные бактерии, обладают природной устойчивостью к азтреонаму, темоциллину, полимиксину В (колистину) и налидиксовой кислоте, как представители стрептококков – к фузидиевой кислоте и аминогликозидам.
Скрининговым тестом для оценки чувствительности S . pneumoniae к бета-лактамным антибиотикам является определение чувствительности к оксациллину (1 мкг в диске). Именно с него начинают изучение лекарственной чувствительности пневмококков и выявляют пенициллинустойчивые штаммы. Базовыми антибиотиками для изучения антибиотикограммы могут быть моксифлоксацин, эритромицин, клинидамицин и тетрациклин. Антибиотиками резерва – хлорамфеникол, триметоприм/сульфаметоксазол, ванкомицин, линезолид, рифампицин (таб. 3).
Таблица 3.
Критерии интерпретации результатов определения чувствительности S . pneumoniae : диаметры зон подавления роста (мм) и пограничные значения МПК (мг/мл)
Антимикробных препаратов
| Антимикробный препарат | Содержание в диске (мкг) | Диаметры зон подавления роста (мм) | Пограничные значения МПК (мг/л) | Примечание: | ||
| S ≥ | R < | S ≤ | R > | |||
Скрининг
Базовые препараты
Препараты резерва
S – чувствительный, R – устойчивый (интервальные отклонения относятся к промежуточному критерию чувствительности/устойчивости – I )
Номенклатуру антимикробных средств, используемых при постановке антибиотикограммы, необходимо адаптировать в каждом медицинском учреждении с учетом специфики лечебно-диагностического процесса.
Латекс-агглютинаци я
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах +35 +37 (± 1) °С;
- центрифуга лабораторная;
- анаэростат или CO2-инкубатор, поддерживающий температуру в камере в пределах +37 (± 1) °С, содержание CO2 на уровне 3 - 7 %;
- холодильник фармацевтический, поддерживающий температуру + 4 + 8 °С для хранения культур, биологических субстратов и реагентов;
- водяная баня (сухо-воздушный инкубатор);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты :
- диагностические наборы (тест-системы) для проведения латекс-агглютинации.
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
При тестировании биологических материалов (ликвор, сыворотка) для реакции используют прозрачную надосадочную жидкость образца, предварительно прогретого в сухо-воздушном инкубаторе или на водяной бане и центрифугированного (профильтрованного) для получения прозрачной надосадочной жидкости. Минимальный объем для тестирования 0,5 мл. Одну каплю каждого латексного реактива (предварительно реактивы рекомендуют тщательно встряхнуть) наносят на специальные бумажные карты, приложенные к набору. Затем добавляют 30 мкл исследуемого материала (надосадочная фракция) к каждой капле латексного реактива. Перемешивают чистым аппликатором. Осторожно покачивают бумажную карту. Агглютинация в течение 2 мин свидетельствует о присутствии в испытуемом образце специфического антигена.
Для обнаружения антигена в бактериальной культуре, выделенные на питательном агаре изоляты, собирают петлей (в количестве 10-12колоний), тщательно эмульгируют в физиологическом растворе, предварительно нанесенном на агглютинационную карту, для получения гомогенной суспензии. Латексный реагент, содержащий сенсибилизированные кроличьи антитела, специфичные для S . pneumoniae наносят на карту, перемешивают с полученной суспензией и регистрируют на наличие четкой агглютинации в течение 2 мин. (рис. 3).

Рисунок 2. Латекс-агглютинация: положительный (слева) и отрицательный (справа) результаты.
Для выполнения реакции латекс-агглютинации используют наборы латексных диагностических препаратов, например, Slidex pneumo-Kit (BioMerieuх).
В настоящее время выпускают наборы с различными комбинациями моноклональных антител для выявления антигенов наиболее часто встречаемых в диагностике бактериальных менингитов (S . pneumoniae , N . meningitidis (серогруппы А, В, С, Y/W 135), H influenzae тип В, S . agalactiae группы В, E . coli K1 и др.).
Иммунохроматографический анализ (ИХА)
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- холодильник фармацевтический, поддерживающий температуру + 4 + 8 °С для хранения культур, биологических субстратов и реагентов;
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты :
- диагностические наборы реагентов (тест-системы) для выявления антигенов ДНК возбудителя;
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанных в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- штативы и поддоны для пробирок и контейнеров;
- наконечники стерильные для дозаторов переменного объема;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Для проведения иммунохроматографического экспресс-теста используют тест-кассету в герметичной упаковке (фольга) в форме открывающейся книжки (рис.4).
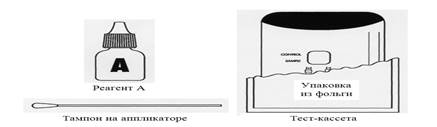
Рис. 4 . Тест система для иммунохроматографического метода
Тест-кассета содержит мембрану с нанесенными на нее в виде двух отдельных полосок кроличьими антителами к антигену S . pneumoniae и козьими антителами против IgG кролика в комбинации с конъюгатом из кроличьих антител к антигену S . pneumoniae и антивидовых антител, конъюгированных с окрашенными частицами. Вторая полоска дает контрольную линию, проявляющуюся розовым или красным цветом. Кассета имеет лунку, расположенную на противоположной стороне устройства, для внесения в тест исследуемого образца. В комплект входят Реагент А – (1 пластиковый флакон-капельница – 5,0 мл) цитратно-фосфатный буфер с лаурил-сульфатом, Твином-20 и азидом натрия, тампоны для отбора образца мочи пациента, разработанные специально для использования в тесте, положительный контрольный тампон с высушенными на тампоне инактивированными S . pneumoniae и отрицательный контрольный тампон.
Перед постановкой реакции охлажденный или замороженный образец следует разморозить. Мочу для исследования непосредственно перед тестированием перемешивают легким вращательным движением. Стерильный тампон на аппликаторе, прилагаемый к диагностическому набору, погружают в мочу и помещают в кассету. Из пластиковой капельницы в кассету добавляют 3 капли реагента А (рис.5).
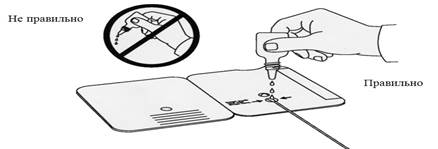
Рис. 5 . Постановка иммунохроматографического экспресс-теста
По окончании процедуры устройство закрывают, чтобы привести исследуемый образец мочи в контакт с тест - полоской.
При наличии в моче антигена S.pneumoniae происходит его связывание с находящимися на подложке антителами окрашенного конъюгата, а также с иммобилизированными на мембране кроличьми антителами к антигену S.pneumoniae, в результате чего возникает окрашенная розовая или красная линия в зоне чтения образца. Иммобилизированные на полоске в виде линии козьи антитела против IgG кролика также связывают окрашенный конъюгат и формируют вторую линию - контрольную.
Положительный результат регистрируют через 10-15 минут по наличию двух окрашенных линий в зоне чтения. На отрицательный результат указывает одна окрашенная контрольная линия, свидетельствующая об отсутствии антигена S.pneumoniae в тестируемом образце. Отсутствие окрашенной контрольной линии указывает на недействительные результаты.
Положительные и отрицательные контрольные образцы должны ставиться для каждого вновь открытого набора или в каждом отдельном случае согласно требованиям процедуры внутри лабораторного контроля качества. Для постановки контрольных реакций из пластиковой капельницы в кассету добавляют 6 капель реагента А.
Дата: 2018-12-28, просмотров: 419.