Государственное санитарно-эпидемиологическое
Нормирование Российской Федерации

МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Внебольничной ПНЕВМОНИИ ПНЕВМОКОККОВОЙ ЭТИОЛОГИИ
Методические рекомендации
МР 4.2.0114-16
Издание официальное
Москва, 2016
Лабораторная диагностика внебольничной пневмонии пневмококковой этиологии.- М.: Федеральный центр гигиены и эпидемиологии, 2016.- ___ с.
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Е.Б. Ежлова, Ю.В. Демина), ГБОУ ВПО ПГМУ им. ак. Е.А. Вагнера Минздрава России (И.В. Фельдблюм, Ю.А. Захарова, В.В. Николенко, Н.Н. Воробьева, С.О. Голоднова, А.В. Климашина), МБУЗ «Городская клиническая больница № 8» г. Челябинска (О.А. Орлова), ФБУН ЦНИИ Эпидемиологии Роспотребнадзора (В.В. Малеев, Г.А. Шипулин, С.Б. Яцышина, К.О. Миронов), НИИ антимикробной химиотерапии ГБОУ ВПО Смоленской ГМА Минздрава России (Р.С. Козлов, С.А. Рачина), ФГБУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалея Минздрава России (И.С. Тартаковский), ФГБУЗ НИИ детский инфекций ФМБА России (С.В. Сидоренко, В.В. Гостев, М.О. Волкова).
2. Утверждены и введены в действие руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю.Поповой «_______»_________ 2016 г.
3. Введены впервые.
Содержание
| 1. | Область применения | |
| 2. | Термины и сокращения | |
| 3. | Общие положения | |
| 4. | Биологические свойства Streptococcus pneumoniae , общая характеристика методов лабораторной диагностики | |
| 5. | Показания к обследованию | |
| 6. | Лабораторная диагностика внебольничной пневмонии пневмококковой этиологии | |
| 6.1. Преаналитический этап | ||
| 6.1.1. Правила получения материала | ||
| 6.1.2. Маркировка материала | ||
| 6.1.3. Транспортирование материала | ||
| 6.2. Аналитический этап | ||
| 6.2.1. Микроскопическое исследование | ||
| 6.2.2. Выделение чистой культуры возбудителя | ||
| 6.2.3. Определение чувствительности к антибиотикам | ||
| 6.2.4. Латекс-агглютинация | ||
| 6.2.5. Иммунохроматографический анализ (ИХА) | ||
| 6.2.6. Полимеразная цепная реакция (ПЦР) | ||
| 6.2.7. Определение серологических типов Streptococcus pneumoniae | ||
| 6.3. Постаналитический этап | ||
| 6.4. Алгоритм лабораторной диагностики | ||
| 7. | Библиографический указатель | |
| Приложения |
УТВЕРЖДАЮ
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия
человека
А.Ю. Попова
«_____» ____________ 2016 г.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Внебольничной ПНЕВМОНИИ ПНЕВМОКОККОВОЙ ЭТИОЛОГИИ
Методические рекомендации
МР -4.2……….

Область применения
1.1. Настоящие методические рекомендации (далее - МР) определяют порядок лабораторной диагностики внебольничной пневмонии пневмококковой этиологии.
1.2. Методические рекомендации предназначены для специалистов микробиологических лабораторий, не зависимо от ведомственной принадлежности и формы собственности.
Термины и сокращения
БАЛ – бронхоальвеолярный лаваж
ВКО – внутренний контрольный образец
ВОЗ – всемирная организация здравоохранения
ВП – внебольничная пневмония
ГЭ/мл – количество геном-эквивалентов в 1 миллилитре
ДНК – дезоксирибонуклеиновая кислота
ИХА – иммунохроматографический анализ
КОЕ/мл – колониеобразующие единицы в 1 миллилитре
МО – медицинская организация
МПК – минимальная подавляющая концентрация
МУ – методические указания
β-НАД – никотинамидадениндинуклеотид
ОК – отрицательный контроль экстракции
ОРВИ – острая респираторная вирусная инфекция
ОРИТ – отделение реанимации и интенсивной терапии
ПК – положительный контроль экстракции
ПЦР – полимеразная цепная реакция
СМЖ – спинномозговая жидкость
СП – санитарно-эпидемиологические правила
УФ-бокс – ультрафиолетовый бокс
ФКР – Федеральные клинические рекомендации
ЭДТА – этилендиаминтетрауксусная кислота
CNA - агар – селективный агар для выделения грамположительных
бактерий с налидиксовой кислотой и колимицином
EUCAST – European on Antimicrobial Susceptibility Testing (Европейская
система тестирования антимикробной восприимчивости)
Общие положения
Пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных заболеваний, характеризующихся поражением легких с обязательным наличием внутриальвеолярной экссудации, сопровождающихся симптомами патологии нижних отделов дыхательных путей (лихорадка, кашель, выделение мокроты, возможно гнойной, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы. Внебольничной пневмонией (ВП) считают заболевание, возникшее во внебольничных условиях (вне стационара или позднее 4 недель после выписки из него) или диагностируемое в первые 48 часов с момента госпитализации, а также развивающееся у пациента, не находившегося в домах сестринского ухода длительного медицинского наблюдения более 14 суток.
По данным федерального статистического наблюдения (форма №2 «Сведения об инфекционных и паразитарных заболеваниях») за 2011 – 2015 гг. заболеваемость ВП в России находилась на уровне 310-380 на 100 тысяч населения (600 – 750 случаев на 100 тысяч детей в возрасте до 14 лет).
У отдельных категорий граждан, в частности у военнослужащих срочной службы, медицинских работников заболеваемость пневмококковыми пневмониями превышает уровень заболеваемости среди населения в целом.
Показатель смертности при ВП в 2011-2014 гг. составлял 2,9 - 3,9 на 100 тысяч населения (у детей в возрасте до 14 лет – 0,3 - 0,4 на 100 тысяч). В структуре младенческой смертности заболевания органов дыхания стоят на третьем месте (около 7%), из них около 74% приходится на пневмонии.
Этиологическая структура ВП может различаться в зависимости от возраста пациентов, тяжести заболевания и наличия сопутствующей патологии. По зарубежным данным пневмококковые пневмонии диагностируют у 5% взрослых амбулаторных пациентов, 17,3% госпитализированных в терапевтические отделения и 21% - в отделения интенсивной терапии. В Российской Федерации по расчетным данным некоторых авторов частота пневмококковых пневмоний у детей в возрасте от 1 мес. до 15 лет составляет 490 случаев на 100000 детского населения соответствующего возраста, в возрасте от 1 мес. до 4 лет – 1060 случаев.
Дети первых лет жизни являются основными источниками пневмококковой инфекции, заражая окружающих взрослых. Так, при средней частоте носительства у взрослых в 5 - 7%, среди взрослых, проживающих с детьми, она может достигать 30%.
По данным отчетной формы государственного статистического наблюдения в России (ф-2) пневмококковая этиология ВП подтверждается лишь в 1,3 % случаев.
4. Биологические свойства Streptococcus pneumonia e , общая характеристика методов лабораторной диагностики
Возбудитель пневмококковой пневмонии, S . pneumoniae, или пневмококк, входит в состав семейства Streptococcaceae, род Streptococcus, как вид условно-патогенных бактерий. Пневмококки – грамположительные каталазо- и оксидазо- отрицательные мелкие шаровидные бактерии (кокки), являющиеся факультативными анаэробами.
При микроскопии часто имеют ланцетовидную форму, располагаются парами (диплококк), нередко имеют капсулу. Из жидких питательных сред под микроскопом визуализируются цепочками средней длины. При искусственном культивировании пневмококк нуждается в специальных питательных основах, обогащенных дефибринированной кровью животных. Рост возбудителя в искусственных условиях культивирования стимулирует повышенное содержание в атмосфере СО2.
На плотных питательных средах пневмококк образует мелкие (1-2 мм в диаметре), округлые, блестящие, бесцветные колонии с ровным краем, мягкой консистенции, которые в большинстве случаев через 24 часа инкубации имеют сферическую форму с уплощенным центром, образующимся в результате аутолиза (шероховатая R-форма).
На 5% кровяном агаре вокруг колоний пневмококка характерно образование зеленящей зоны альфа-гемолиза. Наиболее вирулентные капсульные бактерии могут располагаться в виде капель росы, в последующем принимая сливной рост (мукоидная M-форма). Гладкие, компактные, точечные колонии (S-форма) преобладают у авирулентных штаммов.
Рост S . pneumoniae на жидких питательных средах характеризуется диффузным помутнением бульона без образования пленки.
Биохимическая активность пневмококка во многом совпадает с активностью других зеленящих стрептококков: он разлагают глюкозу, лактозу, мальтозу, сахарозу, не ферментируют маннит, салицин и сорбит, однако в отличие от других представителей зеленящих форм стрептококков не обладает способностью к росту при температуре +45°С.
Видовая специфичность пневмококка выражается в способности ферментировать инулин, чувствительности к оптохину и солям желчных кислот (дезоксихолату и таурохолату натрия). Вместе с тем в последние годы появились изоляты, устойчивые к оптохину (до 10% от всей популяции).
Вирулентность пневмококка в первую очередь обусловлена наличием полисахаридной капсулы, обеспечивающей антифагоцитарную активность, а так же протеина адгезии, протеазы секреторного IgA, тейхоевой кислоты и фрагментов пептидогликана, активизирующих комплемент по альтернативному типу.
В зависимости от химического строения капсульного полисахарида выделяют более 90 серологических типов S . pneumoniae: серогруппы (обозначаются цифрами, например: серогруппа 6) и входящие в них серотипы (обозначаются буквами, например: серотип 6A). Определение серологических типов проводится с использованием серологических методик, основанных на реакции набухания капсулы в присутствии иммунной сыворотки или в реакции латкес-агглютинации. Альтернативным способом определения серогрупп (серотипов) является детекция специфических локусов бактериальной ДНК, вовлеченных в биосинтез капсульного полисахарида, с помощью различных ПЦР-методик или секвенирования ДНК.
Более 90% инвазивных заболеваний вызывается 23 серотипами возбудителя, которые входят в широко используемую в настоящее время полисахаридную вакцину (1, 2, 3, 4, 5, 6В 7F, 8, 9N, 9V, 10A, 11А, 12F, 14, 15В, 17F, 18С, 1-9F, 19А, 20, 22F, 23F, 33F).
Спектр антибиотикорезистентности пневмококка зависит от географического места изоляции и вида материала, из которого изолирован штамм (мазок из носоглотки, спинномозговая жидкость и др.). В России уровень устойчивости пневмококков, выделенных из нестерильных локусов, к пенициллинам (МПК > 0,06 мг/л) составляет в среднем 11%, к макролидам 7%, к тетрациклинам - 25%, ко-тримоксазолу - 39%. Полирезистентностью (устойчивостью к 3 и более классам антимикробных препаратов) обладает 14,5% штаммов пневмококка, большинство из которых (> 90%) выделено из респираторных образцов. Пневмококки 23, 19 и 6 серогрупп (серотипы 23F, 19F, 19A, 6B) часто характеризуются повышенной устойчивостью к пенициллину и другим антибактериальным препаратам, а также могут обладать полирезистентными свойствами, что обусловлено генетическими мутациями циркулирующих возбудителей.
Микроскопическое исследование относится к простым ускоренным методам обнаружения S . pneumoniae , позволяющим получить предварительный результат. Бактериоскопия окрашенного по Граму мазка определяет морфотип потенциального бактериального патогена. Ценность метода и решаемые задачи различаются в зависимости от того, из какого локуса организма отобран клинический материал.
Модифицированным вариантом микроскопии в комбинации с серологической диагностикой S . pneumoniae является метод Нейфельда или феномен набухания капсулы при взаимодействии с неразведенной специфической анти-пневмококковой сывороткой (I, II, III типов) в присутствии синьки Лёффлера. Метод основан на способности капсул пневмококков увеличиваться в объёме в присутствии гомологичной антисыворотки, что регистрируют светооптической микроскопией. При положительном результате наблюдается резкое увеличение капсул пневмококков. При отрицательном результате капсулы едва заметны.
Реакция набухания специфична и не даёт положительного результата с другими капсульными бактериями, однако с его помощью невозможно идентифицировать не имеющие капсулы S . pneumoniae.
Пневмококки, имеющие капсулу, также можно визуализировать по методу Бурри-Гинса. По Бурри материал перемешивают с тушью, на фоне которой будут выделяться неокрашенные бактерии и капсулы. В модификации Гинса приготовленный по Бурри препарат дополнительно окрашивается фуксином Циля, при этом бактерии приобретают ярко малиновую окраску, а их капсулы остаются неокрашенными.
У пациентов, принимавших антибактериальные препараты, данные методы могут давать ложно-отрицательные результаты, поскольку в этом случае в клиническом материале могут присутствовать пневмококки, лишенные капсулы. Следует помнить, что при переходе S . pneumoniae из S в R-форму капсульные антигены утрачиваются.
Бактериологический метод позволяет выделить «чистую» культуру возбудителя, провести его видовую идентификацию и серотипирование, определить чувствительность к антимикробным препаратам.
Основной сложностью при выделении культуры пневмококка является требовательность к условиям культивирования и склонность микроорганизма к быстрому аутолизу (саморазрушению). Ограничением метода может быть сложность получения мокроты и значительная продолжительность исследования (результат определяется спустя 48-72 часа с момента забора биологического материала). Диагнойстическая ценность будет ниже при исследовании крови и широком использовании антимикробных препаратов на догоспитальном этапе (низкий уровень высеваемости).
Отправной точкой идентификации пневмококков на кровяном агаре является гемолитическая реакция стрептококков. S . pneumoniae – α-гемолитический (зеленящий) стрептококк, который по морфологическим признакам роста трудно отличим отдругих α-гемолитических (“зеленящих”) стрептококков – S . mitis , S . oralis , S . sanguis , S . parasanguis , S . gordonii .
Признаками, подтверждающими видовую принадлежность изолята являются его морфология (грамположительные кокки), отсутствие каталазо- и оксидазообразования, чувствительность к оптохину и лизис солями желчи. Оптохин (этилгидрокупреина гидрохлорида) селективно подавляет рост пневмококка в отличие от других «зеленящих» стрептококков. Соли желчи (в особенности дезоксихолат натрия и таурохолат натрия) обладают способностью избирательно лизировать колонии S . pneumoniae на агаре или в бульоне. Метод основан на активации пневмококковых аутолизинов – ферментов, участвующих в синтезе клеточной стенки, что приводит к визуальному лизису S . pneumoniae в течение 0,5–2 ч. Однако примерно для 14% пневмококков наблюдается неполный лизис. Дифференциальная диагностика S . pneumoniae проводится с прочими представителями рода Streptococcus: S . pseudopneumoniae (чувствительного к оптохину, но устойчивого к желчи), S . pyogenes группы А (чувствительного к бацитрацину и положительного в ПИРА-тесте), S . agalactiae группы В (положительного в тесте с гиппуратом Na и CAMP-тесте) зеленящими стрептококками группы S . viridans (как правило, растущих в тиогликолевой среде при температуре +45 °С). От представителей других родов: Neisseria spp., Haemophilus spp. и Corynebacterium spp ., дающих схожий рост на средах первичного посева с атипичными формами пневмококков, их отличают морфология, оксидазная и каталазная активность.
Необходимо помнить, что в современной популяции до 10% изолятов пневмококков устойчивы к оптохину, они также резистентны и к бета-лактамным антибиотикам. В то же время рост некоторых “зеленящих” стрептококков подавляется оптохином.
Принадлежность S . pneumoniae, устойчивых к оптохину, необходимо подтверждать с использованием комплекса тестов, дифференцирующих между собой различные виды стрепрококков, с помощью тест-систем коммерческого производства, разрешенных к применению в Российской Федерации.
К сожалению, один из современных методов идентификации бактерий по белковому профилю, MALDI-масс-спектрометрия, не может быть использован для идентификации S . pneumoniae в связи с высоким сходством белкового профиля различных видов α-гемолитических стрептококков.
Конечным этапом бактериологической диагностики S . pneumoniae является определение чувствительности к антибиотикам. В настоящее время теоретически обоснованным считается подход к оценке чувствительности, предлагаемый Европейским сообществом, основанный на признании факта существования различий между микробиологической и клинической чувствительностью/устойчивостью микроорганизмов. Для обоснования клинических критериев тест использует фармакокинетические / фармакодинамические закономерности зависимости между величиной минимальной подавляющей концентрации (МПК) антибактериального препарата в отношении микроба-возбудителя, фармакологическими характеристиками препарата и эффективностью лечения.
К способам обнаружения антигена пневмококка с целью его ускоренного выявления может быть отнесен метод латекс-агглютинации, основанный на выявлении пневмококковых капсульных полисахаридных антигенов с применением поливалентной специфической пневмококковой сыворотки. Антиген, содержащийся в исследуемом образце, взаимодействует со специфичными гомологичными антителами, которыми покрыты латексные частицы. В присутствии гомологичного антигена латексные частицы агглютинируют. В отсутствии антигена, они остаются в виде гомогенной суспензии
Исследование проводят непосредственно с чашки первичного посева. Можно использовать сам биологический материал, как правило, ликвор или сыворотку крови. Быстроту получения результата и простоту теста могут нивелировать перекрестные реакции с антигенами других стрептококков. К преимуществам метода относят быстроту и простоту исполнения, к недостаткам – высокую стоимость, невозможность определения антигена в нестерильном биологическом материале.
В последние годы все всё чаще используются быстрые тесты, в частности иммунохроматографический экспресс-тест для выявления пневмококкового клеточного полисахарида (с-полисахарида) в моче.
Тест адаптирован только для образцов мочи взрослых пациентов, и применяется до начала антибактериальной терапии. Не рекомендуется проводить данное исследование среди лиц, ранее перенесших внебольничную пневмонию или получавшим профилактическую прививку от S . pneumoniae в течение 5 дней предшествующих тестированию. Время выполнения исследования составляет 15 минут, чувствительность теста по данным литературы – 86 - 90%, специфичность – 71 - 97%.
Ряд международных сообществ рекомендует этот метод в качестве дополнительного способа диагностики пневмококковых пневмоний, прежде всего у пациентов с тяжелым течением заболевания. Диагностическая значимость теста снижается в популяциях с высоким носительством пневмококка S . pneumoniae и S . mitis. Отрицательный результат теста не исключает наличия пневмококковой инфекции.
Полимеразная цепная реакция (ПЦР) является прямым методом быстрой диагностики инфекционных болезней, позволяющим обнаруживать в качестве аналита специфичные участки генома инфекционного агента. Многообразие видов стрептококков, многие из которых являются непатогенными комменсалами верхних дыхательных путей, бессимптомное носительство пневмококка, как и в случае использования других методов, вызывает сложности и накладывает определенные ограничения при применении ПЦР.
Традиционно используемый для видового типирования бактерий ген 16S RNA не может быть использован в качестве мишени для ПЦР, поскольку гомология между разными видами стрептококков составляет 99%.
В качестве диагностической мишени для ПЦР чаще используют гены, кодирующие факторы патогенности S . pneumoniae, в первую очередь, пневмолизин (ply) и аутолизин (lytA), ген, кодирующий пневмококковый поверхностный антиген (psaA), и протеин, участвующий в биосинтезе полисахаридов капсулы ( cpsA ). Все эти мишени могут быть использованы для обнаружения ДНК S . pneumoniae в крови, плевральной жидкости и ликворе, поскольку из множества видов стрептококков только S . pneumoniae может вызывать инвазивную инфекцию.
Исследования отделяемого со слизистой оболочки верхних дыхательных путей показали, что ply может присутствовать в геноме S . oralis и S . mitis, а lytA – в геноме S . mitis. Ген, кодирующий пневмококковый поверхностный антиген (psaA), также имеет высокую гомологию со стрептококками группы viridans. В связи с этим, тесты по обнаружению ply , lytA и psaA рекомендуют использовать только для стерильных локусов (кровь и плевральная жидкость, ликвор).
Вместе с тем, существуют гены, отсутствующие у стрептококков группы viridans. К таким участкам ДНК S . pneumoniae относится cpsA (Park H.K., et al., 2010), который содержится только у изолятов S . pneumoniae, имеющих капсулу, а также фрагмент ДНК Spn 9802, обнаруживающийся у всех S . pneumoniae и у единичных изолятов S . pseudopneumoniae.
Учитывая факт повсеместного носительства S . pneumoniae диагностика пневмококковой пневмонии по нестерильным локусам методом ПЦР в качественном формате (результат: обнаружено / не обнаружено) затруднена. В таких случаях решением проблемы служит применение ПЦР в количественном формате. Использование в качестве диагностической мишени локусов Spn 9802 или cpsA в совокупности с этой методикой позволило судить о пневмококковой этиологии пневмонии при исследовании аспиратов из носоглотки больных. Диагностическая чувствительность метода относительно «золотого стандарта» составила 94%, специфичность - 98%.
Помимо детекции ДНК возбудителя, проводимого с целью этиологической расшифровки случая пневмококковой инфекции, метод ПЦР также используют для определения серологических типов возбудителя, циркулирующих на различных территориях, с целью оптимального планирования иммунопрофилактики и мониторинга эффективности использования существующих вакцин.
В настоящее время определены нуклеотидные последовательности всех генов, вовлеченных в биосинтез капсульного полисахарида (cps-локус генома S . pneumoniae), для всех серотипов S . pneumoniae, способных вызывать инвазивные формы инфекции.
Основными преимуществами основанных на ПЦР методик для определения серологических вариантов S . pneumoniae являются сравнительно низкая стоимость и возможность определения свойств возбудителя без этапа культивирования. В отличие от традиционных методик (определение серологических вариантов S . pneumoniae, с использованием метода электрофореза), ПЦР в режиме «реального времени» отличают меньшее количество этапов исследования и одинаковая чувствительность для всех серотип-специфических мишеней, включенных в реакционную смесь, поскольку при этой методике нет необходимости проведения амплификации мишеней различной длины.
Результаты ПЦР-исследования должны учитываться в совокупности с результатами других методов в комплексной диагностике ВП.
Показания к обследованию
А. Подозрение на внебольничную крупозную пневмонию (плевропневмонию)
Инфекционный процесс характеризуется острым началом с потрясающего озноба, повышения температуры тела до 39-40°С и выше. В последующем присоединяются боли в грудной клетке, тахипноэ и тахикардия. Отмечается умеренный цианоз в результате гипоксии, вызванной нарушением вентиляции легких или шунтирования крови, раздувание крыльев носа, вначале сухой кашель, затем продуктивный с трудно отделяемой, вязкой с прожилками крови или ржавого цвета мокротой. Как правило, процесс наблюдается в одном легком, чаще правом, может охватывать одну нижнюю, среднюю или две доли. При обследовании выявляется ограничение подвижности пораженной половины грудной клетки, усиление голосового дрожания над областью воспаления, укорочение перкуторного звука, ослабление дыхания, крепитация, реже - шум трения плевры. По мере развития определяется бронхиальное дыхание, разнокалиберные хрипы. При рентгенологическом исследовании имеет место усиление легочного рисунка, со 2-3-го дня интенсивное затемнение ткани легких с расширением тени от корня легкого к периферии, при поражении плевры - выпот в плевральной полости. В периферической крови выявляют нейтрофильный гиперлейкоцитоз со сдвигом формулы влево.
Б. Подозрение на внебольничную очаговую бронхопневмонию
Как правило, дебют заболевания происходит на фоне острого респираторного процесса (бронхита), характеризуется общей слабостью, повышенной утомляемостью, потливостью, усилением одышки, тахикардией, повышением температуры. Кашель сопровождается слизистой или слизисто-гнойной мокротой. Очаги воспаления обычно возникают в задних и задне-нижних сегментах легких. При аускультации определяются влажные мелко- и среднепузырчатые хрипы, реже крепитация и трение плевры.
В. Подозрение на пневмонию у детей
По мнению экспертов ВОЗ бактериальную пневмонию у детей следует подозревать при сочетании фебрильной температуры и синдрома дыхательных расстройств, определяемого у детей до 2 мес. – более 60 дыханий в минуту; для детей 2-12 месяцев – более 50 дыханий в минуту; для детей старше 12 месяцев – более 40 дыханий в минуту при условии отсутствия признаков бронхиальной обструкции (Бюллетень ВОЗ, 2008). Диагноз пневмонии подтверждается по результатам рентгенологического исследования.
Преаналитический этап
Отбор материала для лабораторного исследования от больного проводит специалист МО. Сбор биологического материала осуществляют в день обращения пациента за медицинской помощью до начала этиотропного лечения. Лица, ответственные за сбор, хранение и транспортировку образцов биологических материалов должны владеть навыками безопасной работы с биологическим материалом.
Мокрота
- для микроскопического и бактериологического исследования
Сбор свободно отделяемой мокроты осуществляют натощак или не ранее двух часов после еды. Предварительно пациента просят почистить зубы и тщательно прополоскать рот кипяченой водой.
Больной делает несколько глубоких вдохов с задержкой дыхания на несколько секунд, затем с силой производит выдох, что способствует появлению продуктивного кашля и отделению мокроты. Пациента откашливает мокроту (не слюну!) в стерильный контейнер. Объем образца должен составить не менее 3 мл для взрослых (около 1 мл для детей).
Хранение образца:
В стерильной емкости
- при комнатной температуре + 20 + 25º С – до 2 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- для исследования методом ПЦР в количественном формате.
Используются только наборы реагентов, в инструкции которых указан этот тип клинического материала. Сбор мокроты аналогичен предыдущему пункту.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес.
И ндуцированная мокрота
- для микроскопического и бактериологического исследования
Перед процедурой взятия материала пациент получает сальбутамол через дозирующий ингалятор для предотвращения бронхоспазма. Затем в течение 15 минут через струйный небулайзер (аэрозольный аппарат) подается кислород со скоростью 5 л /мин с 5 мл 5% стерильного раствора NaCl. После этого проводится постукивание по передней и задней стенкам грудной клетки с целью стимуляции отхождения мокроты. Пациента просят откашлять мокроту (не слюну!) в стерильный контейнер. Объем образца должен быть не менее 3 мл для взрослых (около 1 мл для детей).
В случае если мокрота не откашливается, процедуру рекомендуют комбинировать с последующим получением аспирата из трахеи.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 2 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- для исследования методом ПЦР в количественном формате.
Используются только наборы реагентов, в инструкции которых указан этот тип клинического материала. Сбор мокроты аналогичен предыдушему пункту.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес.
Мазки со слизистой оболочки верхних дыхательных путей
Бактериоскопия мазков с задней стенки глотки не проводится в связи с недостаточной информативностью результата.
Бактериологический посев мазков с задней стенки глотки осуществляется лишь при невозможности получения свободно отделяемой и индуцированной мокроты (детский возраст, дебют пневмонии).
- для бактериологического исследования
Мазки берут в специальную транспортную систему типа Амиеса (Copan®) сухим стерильным зондом из полистирола с вискозным тампоном (специальной щеткой) вращательными движениями с задней стенки глотки, аккуратно прижимая язык пациента шпателем.
После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с транспортной средой. При использовании коммерческих тампонов фирмы Copan® после погружения в питательную среду конец зонда с тампоном (1 см) отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Хранение образца:
В коммерческой транспортной среде (типа Амиеса, Copan®) при комнатной температуре + 20 + 25º С – до 48 ч. (не допускается хранение в условиях холодильника и термостата).
- для исследование методом ПЦР в количественном формате
Осуществляют при невозможности получения свободно отделяемой и индуцированной мокроты (детский возраст, дебют пневмонии). Используют только наборы реагентов, в инструкции которых указан этот тип клинического материала.
Материал берут после полоскания полости рта кипяченой водой комнатной температуры. Если полость носа заполнена слизью, перед процедурой рекомендуется ее удалить. В течение 6-ти часов перед процедурой нельзя использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту.
Мазки у пациента берут двумя разными зондами сначала со слизистой нижнего носового хода, а затем из ротоглотки, при этом концы зондов с тампонами после взятия мазков последовательно помещают в одну пробирку объемом 1,5-2 мл с 0,5 мл транспортной среды для респираторных мазков.
Мазки со слизистой носоглотки у детей берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе, у взрослых - сухим стерильным зондом из полистирола с вискозным тампоном. Зонд вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3–4 см для детей и 5–6 см для взрослых). После забора материала конец зонда с тампоном опускают в стерильную одноразовую пробирку с транспортной средой до места слома, при этом гибкая часть зонда сворачивается спиралью, далее, прикрывая сверху пробирку крышкой, рукоятку зонда опускают вниз, добиваясь полного отламывания верхней части зонда. Пробирку герметично закрывают.
Мазки из ротоглотки берут сухим стерильным зондом из полистирола с вискозным тампоном вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем. После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с транспортной средой и зондом с мазком из носоглотки. Конец зонда с тампоном (1 см) отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Хранение образца:
В коммерческой транспортной среде (типа «Транспортная среда для хранения и транспортировки респираторных мазков», ФБУН ЦНИИЭ Роспотребнадзора)
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 72 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес.
Т рахеальный аспират
- для микроскопического и бактериологического исследования
Манипуляцию проводят натощак после чистки зубов и полоскания полости рта водой. Пациента просят сделать несколько глубоких вдохов с задержкой дыхания на несколько секунд, затем с силой выдохнуть. Это способствует появлению продуктивного кашля и очищению верхних дыхательных путей от мокроты. После присоединения мукус-экстрактора через трубку-переходник к отсосу катетер для забора трахеального аспирата вводится в глотку через полость рта. Вследствие раздражения слизистой в области голосовой щели провоцируется кашлевой рефлекс и проводится извлечение трахеального содержимого через стерильный катетер (6 или 7 размера) с помощью отсоса. Материал переносят в стерильную емкость (контейнер).
Объем трахеального аспирата должен составлять не менее 3-5 мл для взрослых (около 1мл для детей).
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 2 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес.
Плевральная жидкость
- для микроскопического и бактериологического исследования
Перед проведением чрескожной аспирации тщательно очищают выбранный участок кожи 70% раствором этилового спирта; затем дезинфицируют его 1-2% раствором йода или другим дезинфицирующим средством (разрешенным к применению для этих целей в установленном порядке) для предотвращения контаминации; избыток йода удаляют марлевой салфеткой, смоченной 70%-м спиртом, во избежание ожога кожи пациента.
Соблюдая правила асептики, выполняют чрескожную аспирацию для получения пробы плевральной жидкости. Удаляют пузырьки воздуха из шприца и немедленно переносят пробу в стерильную емкость и (или) транспортные системы со специальными средами коммерческого (типа SIGNAL для «посева крови») или местного (тиогликолевая среда) производства.
Отправлять пробу в шприце с удаленной иглой, закрытой стерильной резиновой пробкой в лабораторию не рекомендуется из-за вероятности прокола сотрудником кожных покровов (при проведении манипуляции), а также из-за образования плотного сгустка в результате присутствия в плевральной жидкости большого количества белковых компонентов.
Рекомендуемый объем плевральной жидкости, который необходимо направить в лабораторию составляет 10-15 мл.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 2 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
*В коммерческой транспортной среде «для посева крови» (тип Oxoid, BD, Hi-Media и пр.):
- при комнатной температуре + 20 + 25º С – до 24 ч.;
- при температуре термостатирования + 35 + 37º С – до 48 ч.;
*В транспортных питательных средах, приготовленных в лаборатории (тиогликолевая среда):
- при комнатной температуре + 20 + 25º С – до 24 ч.;
- при температуре термостатирования + 35 + 37º С – до 48 ч.
* - Посев биологического материала в указанные питательные среды позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
- для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту. Плевральную жидкость помещают в стерильный контейнер.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес..
Венозная кровь
- для микроскопического и бактериологического исследования
В связи с низкой информативностью микроскопия цельной крови при внебольничной пневмонии средней тяжести не проводится. При тяжелых формах пневмонии или подозрении на генерализованную инфекцию микроскопия осуществляется (см. ниже) для выдачи предварительного результата.
Пробы для микроскопического и бактериологического исследования получают пункцией из периферических вен (чаще локтевого сгиба). Собирают 2 пробы из двух сосудов. У больных, в комплекс терапии которым включены антибиотики, собирают 6 проб в течение 48ч. Сбор проб крови производят у постели больного или в процедурном кабинете. Для получения пробы необходимо:
- продезинфицировать участок кожи над выбранным для пункции сосудом и обработать кожу тампоном, смоченным 70%-м этиловым спиртом, затем другим тампоном, смоченным 1-2%-м раствором йода или другим дезинфицирующим средством (разрешенным к применению для этих целей в установленном порядке), круговыми движениями, начиная от центра, в течение 30 сек.;
- подождать, пока высохнет обработанный участок, не допускать пальпирование сосуда после обработки кожи перед введением иглы;
- с использованием иглы-бабочки у взрослых вводят во флакон с коммерческой питательной средой 10-30 мл крови, у детей - 0,5-3,0 мл, предварительно обработав колпачок флакона спиртом. При отсутствии коммерческих сред кровь забирают шприцем и переносят в транспортные среды, приготовленные в лабораторных условиях (не менее 2-х флаконов). В этом случае необходимо учитывать возможность контаминации образца посторонней микрофлорой.
- для первичной микроскопии снимают иглу-переходник с адаптера системы для забора крови, каплю крови свободно вытекающую из системы наносят на предметное стекло, оставляя до полного высыхания, стекло помещают в стерильный контейнер (чашку Петри). При использовании шприца кровь иглой наносят на предметное стекло только после посева во флаконы.
- после венепункции и посева крови для предотвращения возможного раздражения (ожога) с участка кожи пациента стирают остатки йода с помощью тампона, смоченного 70%-м этиловым спиртом.
Хранение образца:
*В коммерческой транспортной среде «для посева крови» (тип Oxoid, BD, Hi-Media и пр.):
- при комнатной температуре + 20 + 25º С – до 24 ч.;
- при температуре термостатирования + 35 + 37º С – до 48 ч.;
*В транспортных питательных средах, приготовленных в лаборатории (тиогликолевая среда, двухфазная среда и пр.):
- при комнатной температуре + 20 + 25º С – до 24 ч.;
- при температуре термостатирования + 35 + 37º С – до 48 ч.;
* - Посев биологического материала в указанные питательные среды позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
- для исследования методом латекс-агглютинации
Кровь забирается натощак в вакуумные пробирки диаметром 4-9 мл с активатором свертывания или конические центрифужные пробирки для получения сыворотки.
Хранение образца:
В коммерческих вакуумных пробирках при комнатной температуре + 20 + 25º С – до 24 ч.
В конических центрифужных пробирках при комнатной температуре + 20 + 25º С – до 2 ч.
- для исследования методом ПЦР
Взятие венозной крови проводят натощак или через 3 часа после приема пищи из локтевой вены в положении сидя в пробирки с антикоагулянтом (ЭДТА).
Непосредственно перед венепункцией производится дезинфекция кожи в месте венепункции циркулярными движениями от центра к периферии дважды 70% раствором спирта или 1-2% раствором йода. Необходимо дождаться полного высыхания дезинфицирующего средства и провести манипуляцию, не касаясь места обработки кожи. После венепункции следует удалить оставшийся йод с поверхности кожи, чтобы избежать ожога.
После взятия крови пробирку следует несколько раз (6-8) плавно перевернуть вверх дном, чтобы кровь в пробирке тщательно перемешалась. Пробирку поместить в штатив.
Хранение образца:
В пробирке с антикоагулянтом:
- при комнатной температуре + 20 + 25º С – до 6 ч. (с количественной оценкой результата);
- при комнатной температуре + 20 + 25º С – до 12 ч. (для обнаружения нуклеиновых кислот без учета их количества);
- при температуре холодильной камеры + 2 + 8º С – до 24 ч. (качественный и количественный анализ);
Не допускается замораживание цельной крови!
Моча
- для исследования методом ИХА
Наиболее достоверный результат может быть получен при исследовании порции мочи, собранной после ночного отдыха до завтрака. Образцы мочи для исследования объемом 5-10 мл помещают в стандартные пластиковые контейнеры.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 24 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 14 сут.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес.
А утопсийный материал
В случае летального исхода исследуется посмертный (аутопсийный) материал, который следует собирать в начале вскрытия. Наиболее приемлемым для бактериологического исследования принято считать отбор материала в первые 15 часов после смерти, хороших результатов достигают при отборе проб крови из сердца путем трансторакальной пункции до вскрытия.
- для микроскопического и бактериологического исследования
Учитывая высокую степень контаминации биологического материала посторонней микрофлорой дезинфекцию выбранного для пункции участка можно выполнить методом прижигания ткани шпателем. Пробы (кусочки) органов и/или тканей, величиной не менее 3-5 см3 отбирают стерильным инструментом (индивидуальным для каждого органа) и помещают в отдельную стерильную емкость (одноразовые стерильные контейнеры с завинчивающейся крышкой или чашки Петри - d = 55 мм). Кровь, гной из вскрытых полостей, спинномозговую и другие жидкости отбирают стерильным шприцем в объеме не менее 7-10 мл и доставляют в шприце. Материал из легких забирают только с тех морфологически измененных участков, которые указывают на наличие инфекционного процесса.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 2 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту.
Хранение образца:
В стерильной емкости:
- при комнатной температуре + 20 + 25º С – до 6 ч.;
- при температуре холодильной камеры + 2 + 8º С – до 24 ч.;
- при температуре морозильной камеры - 16 - 20º С – до 1 мес. (кроме цельной крови)
Маркировка материала
На этикетке пробирок (контейнеров и пр.) с материалом указывается: порядковый номер образца, соответствующий номеру в сопроводительном документе, и по возможности, фамилия и инициалы, тип материала.
В сопроводительном документе (направлении) к материалу, собранному для исследования в лаборатории, необходимо указать:
- наименование учреждения, которое направляет материал на исследования, телефон, адрес электронной почты;
- фамилию и имя обследуемого больного (если этого не требует положение о конфиденциальности);
- возраст;
- дату взятия материала для лабораторного исследования;
- тип материала;
- дату заболевания или контакта с больным;
- предполагаемый диагноз;
- степень тяжести заболевания;
- наличие осложнений;
- данные о вакцинации против пневмококка (вакцинирован / не вакцинирован / нет данных);
- ФИО, должность, дату отправки материала и контактный телефон, по которому можно связаться с данным сотрудником.
В сопроводительном документе (направлении) при исследовании аутопсийного материала дополнительно указывают дату и время смерти, а также отделение, в котором умер больной, дату и время вскрытия.
Транспортирование материала
При транспортировании проб внутри одного здания, пробирки/контейнеры с биологическим материалом помещают в штативы и специальные герметичные контейнеры-переноски.
При необходимости транспортирования биологического материала в другие организации, образцы от каждого пациента помещают в индивидуальный герметичный пакет с адсорбирующим материалом и дополнительно упаковывают в общий герметичный пакет и общий термоконтейнер.
Сопроводительные документы помещают в индивидуальную упаковку отдельно от биологического материала и прочно прикрепляют снаружи контейнера. Транспортировка материала осуществляет обученный персонал в специально оборудованном для этих целей санитарном транспорте.
В сроки хранения биологического материала включены сроки транспортировки с обязательным учетом температурного режима.
Аналитический этап
Комплекс исследований по микробиологической диагностике внебольничной пневмонии пневмококковой этиологии выполняется в бактериологических лабораториях, имеющих разрешительные документы для работы с микроорганизмами III-IV групп патогенности (опасности).
Персонал, участвующий непосредственно в проведении лабораторных исследований должен соблюдать общие правила работы с микроорганизмами (СП.1.3.2322-08) и стандарты безопасной рабочей среды (ГОСТ Р 52905-2007 (ИСО 15190:2002)). Все сотрудники лаборатории обязаны выполнять инструкции и правила безопасности, изложенные в технических паспортах к приборам и в инструкциях к диагностическим наборам реагентов. В выполнении исследований принимают участие сотрудники, имеющие соответствующее специальное образование, квалификацию, подтвержденные дипломом и сертификатом. Им необходимо периодически проходить курсы повышения квалификации и профессиональной переподготовки в установленном порядке. Требования к знаниям и умениям специалистов должны соответствовать образовательным стандартам, действующим на территории РФ. Для выполнения исследований используют стандартные для микробиологической (ПЦР) лаборатории оборудование, диагностические наборы реагентов и расходные материалы, имеющие соответствующие сертификаты качества и действующий срок годности, разрешенные к применению на территории РФ в установленном порядке.
Аналитический этап включает микроскопическое исследование (в классическом и модифицированном варианте), выделение чистой культуры возбудителя, определение чувствтительности к антибиотикам, латекс-агглютинацию, ИХА, ПЦР, определение серологических типов S . pneumoniae.
Некоторые виды биологического материала требуют предварительной обработки, заключающейся в снижении вязкости (густая и неоднородная по консистенции мокрота) и гомогенизации (секционный материал) с последующим фракционированием путем центрифугирования.
Классический метод окраски
На середину предметного стекла пипеткой (стерильным наконечником дозатора) наносят каплю крови, спинномозговой жидкости, БАЛ и другой материал. При необходимости материал можно центрифугировать и проводить микроскопию осадка. Мокроту предварительно помещают в стерильную чашку Петри, петлей захватывают гнойно-слизистый комочек, промывают его в физиологическом растворе, затем петлей или наконечником дозатора растирают на предметном стекле. Материал по поверхности стекла распределяют так, чтобы диаметр образующегося мазка соответствовал величине небольшой монеты. Стекло оставляют в горизонтальном положении и высушивают. Фиксацию препарата проводят над пламенем горелки или спиртовки.
Окраску мазка проводят ручным или автоматизированным методом. В качестве красителя используют водный раствор метиленового синего (или производят окраску по Граму).
В нативном препарате ликвора клетки S . pneumoniae чаще визуализируются ланцетовидной формы, располагаются парами, имеют капсулу (рис. 1.)
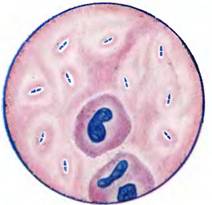
Рисунок 1. Окраска ликвора по Граму (в мазке видны ланцетовидные диплококки, окруженные бесцветной капсулой, встречаются единичные палочкоядерные нейтрофилы).
В мазке крови, имеющем голубой фон, хорошо видны окрашенные в темно-синий цвет лейкоциты и между ними (или внутри них) множество мелких диплококков. В мазках из других органов чаще встречаются мелкие не имеющие капсулы диплококки, что затрудняет их дифференциальную диагностику с другой бактериальной микрофлорой (прежде всего в образцах из «нестерильного» материала).
Бактериоскопия мазков из носо- и ротоглотки не проводится в связи с их недостаточной информативностью.
Метод Нейфельда или феномен набухания капсулы является модифицированным вариантом микроскопии и серологической диагностики S . pneumoniae. При его использовании на три покровных стекла наносят по одному комочку свежевыделенной мокроты (СМЖ, сыворотки крови) к каждому из которых прибавляют каплю неразведенной специфической антипневмококковой сыворотки (I, II, III типов) и каплю синьки Лёффлера. Капли тщательно смешивают, покрывают предметным стеклом с лункой, смазанной по краям вазелином. Через две минуты рассматривают висячие капли под микроскопом с иммерсионной системой. При положительном результате видно резкое увеличение капсул пневмококков. При отрицательном результате капсулы едва заметны. Реакция набухания специфична и не даёт положительного результата с другими капсульными бактериями.
По методу Бурри на край предметного стекла наносят каплю исследуемого материала и каплю туши. Смесь перемешивают и делают мазок, высушивают на воздухе, и, не фиксируя микроскопируют. Фон препарата — тёмно-дымчатый, микробные тела и их капсулы не окрашиваются.
Препарат, изготовленный по Бурри, можно фиксировать смесью Никифорова, отмыть водой, окрасить фуксином Циля, разведенным 1:3 в течение 3-5 минут. На тёмном фоне мазка выделяются неокрашенные капсулы, внутри которых находятся бактерии ярко малинового цвета (метод Гинса).
Реагенты
- транспортные питательные среды (Амиеса с углем и без угля, Стюарта, Кери Блейра и пр.);
- готовые питательные среды для посева и инкубации крови;
- питательные среды для культивирования S . pneumoniae на базе обогащенных субстратов универсальные (кровяной агар, шоколадный агар, эритрит-агар, тиогликолевая среда и др.), дифференциально-диагностические (CNA-агар), хромогенные;
- наборы реагентов для окраски микропрепаратов;
- диагностические наборы реагентов (коммерческие тест-системы) для идентификации S . pneumoniae по биохимическим свойствам.
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанных в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала (мокроты, плевральной жидкости, трахеального аспирата, бронхоальвеолярного лаважа, мочи, ликвора, секционного материала и пр.);
- чашки бактериологические (Петри) для выращивания микробиологических культур;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- кюветы и штативы-рельсы для фиксации и окрашивания мазков;
- петли бактериологические;
- наконечники стерильные для дозаторов переменного объема;
- посуда мерная лабораторная стеклянная и пластиковая;
- газогенераторные пакеты;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Посев первичного материала проводят на специальные питательные среды с высоким содержанием аминного азота и нативного белка животного происхождения.
Для материала, не содержащего нормофлору, используют кровяной, шоколадный, Колумбийский агары, а также полужидкую тиогликолевую среду в качестве среды обогащения (в которой посевной материал оставляют на сутки в стандартном режиме инкубации при + 35° +37°С 16-20 часов.
При выделении пневмококка из «нестерильного материала предпочтение отдают питательным средам со специальными ингибирующими добавками (CNA-агар).
В плотной среде необходимо предусмотреть присутствие дефибринированной крови барана для оценки гемолитических свойств пневмококка. С учетом сложившейся лабораторной практики допускается использование человеческой крови (эритроцитарной массы). При этом следует помнить о возможности получения сомнительных результатов.
В первый квадрант вносят материал, проворачивая тампон и придавливая его к поверхности агара. Жидкий материал вносят стерильной пипеткой или наконечником дозатора в объеме 0,05 мл (1 капля).
Во второй и следующие квадранты материал засевают микробиологической петлей, захватывая площадку предыдущего квадранта лишь двумя штрихами. Между посевами на квадранты петлю стерилизуют прожиганием, либо меняют ее при использовании одноразовых петель. Не допускается касания краев чашки Петри. На каждом квадранте производят по 10 штрихов (рис. 2.).
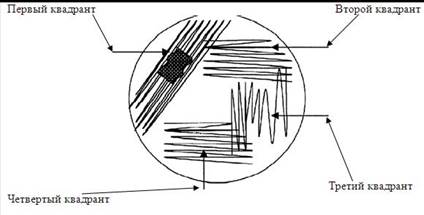
Рис. 2. Посев методом истощающих штрихов (квадрантов)
Инкубацию посевного материала, по возможности, осуществляют в атмосфере c повышенным содержанием СО2. Наиболее распространенным методом создания таких условий является использование эксикатора, в который помещается зажженная свеча, при горении утилизирущая кислород. Когда свеча гаснет, концентрация СО2 достигает 3% (не допускается использование свечи с красителями). Однако наиболее эффективным является применение СО2 термостата или анаэростата со специальными газогенераторными пакетами.
Через 16-20 часов инкубации в стандартном режиме S . pneumoniae формируют мелкие, округлые, блестящие, бесцветные с ровным краем и мягкой консистенции колонии с зоной α-гемолиза. В некоторых случаях (чаще при использовании человеческой крови или эритроцитарной массы) может наблюдаться зона гемолиза промежуточной формы (между α- и β-).
В зависимости от степени выраженности капсулы, отмечено несколько типов колоний.
Колонии с сильно развитой капсулой (преимущественно у S . pneumoniae серотипа 3 имеют несколько миллиметров в диаметре, напоминают каплю масла на агаровой поверхности и бывают настолько слизистыми, что их идентификация не представляет существенных проблем. В полужидкой питательной среде такие изоляты, как правило, дают нежный хлопьевидный осадок (комочек ваты).
Колонии с менее выраженной капсулой обычно небольших размеров, их выделение сопряжено с определенными трудностями. При длительной инкубации (до 48ч) центральная часть колонии может опускаться, давая характерную «блюдцеобразную форму» до полного уплощения и образования на поверхности агара "шляпки гвоздя", что объясняется действием пневмококковых аутолизинов.
Авирулентные формы пневмококков на плотных средах формируют гладкие, компактные, точечные колонии. В полужидкой среде имеют придонно-пристеночный рост. Именно такие формы необходимо, прежде всего, идентифицировать не только от близких видов стрептококков, но и от других представителей бактериальной флоры (Neisseria, Haemophilus, Corynebacterium).
Фенотипическую идентификацию S . pneumoniae проводят по таким признакам, как отсутствие каталазной и оксидазной активности, а так же по специфическим методам, основными из которых являются чувствительность к оптохину (зона задержки роста вокруг диска превышает 14 мм при концентрации препарата в диске 6 мкг и зоны задержки 15 мм при концентрации 5 мкг) и лизис бактериальной культуры в присутствии солей желчи (наличие зоны лизиса вокруг коммерческого диска с желчью в концентрации 3 мкг). Использование нативной, сухой или медицинской желчи не обеспечивает достоверных результатов, поскольку такая желчь не стандартизована по содержанию желчных кислот.
Дополнительным тестом может служить отсутствие роста бактериальной культуры пневмококка при + 45° С в стандартном режиме инкубации (тест проводят методом посева чистой культуры в полужидкую среду для контроля стерильности, разлитую в пробирку в объеме 9-10 мл). У прочих зеленящих стрептококков, составляющих нормофлору дыхательных путей (S. mitis , S . oralis , S . salivarius , S . mutans и др.) в этих условиях инкубации в питательной среде будет наблюдаться хороший бактериальный рост.
Основные дифференцирующие признаки Streptococcus pneumoniae от других представителей семейств Streptococcaceae и Enterococcus, схожих по тинкториальным и культуральным свойствам и дающих на агарах с содержанием крови барана и человека зоны α- или β- гемолиза представлены в таб. 1 и таб. 2.
Таблица 1.
Дифференцирующие признаки штаммов Streptococcus pneumoniae
чувствительных к оптохину от других представителей семейства Streptococcaceae
| Виды стрептококков | Тест с желчью | Рост при + 45° С |
| Streptococcus pneumoniae | + | - |
| Streptococcus pseudopneumoniae | - | - |
| Streptococcus группы viridians | (–) | (+) |
Таблица 2.
Дифференцирующие признаки штаммов Streptococcus pneumoniae
Реагенты
- питательные среды для определения чувствительности S . pneumoniae на базе обогащенных субстратов универсальные (МХА с 5% кровью);
- диски с антибиотиками профильной группы, E-тесты, планшеты и стрипы с лиофилизированными бульонами и серийными разведениями антимикробных препаратов;
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанных в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- чашки бактериологические (Петри) для выращивания микробиологических культур;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- петли бактериологические;
- наконечники стерильные для дозаторов переменного объема;
- посуда мерная лабораторная стеклянная и пластиковая;
- газогенераторные пакеты;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Методами определения антибиотикочувствительности пневмококков являются: метод серийных разведений (количественный, референтный); диско-диффузионный метод (полуколичественный); Е-тест (промежуточный).
В национальных Федеральных клинических рекомендациях (ФКР) «Определение чувствительности микроорганизмов к антимикробным препаратам», 2014г. даны методология оценки чувствительности S . pneumoniae к антимикробным препаратам, пограничные значения МПК и зон подавления роста для определения клинических категорий чувствительности, экспертные правила оценки чувствительности по системе EUCAST.
Учитывая, что в большинстве клинических лабораторий России основным методом является диско-диффузионный, ниже приводятся параметры его постановки, согласно ФКР.
Питательная среда: агар Мюллер-Хинтон + 5% дефибринированной лошадиной крови и 20 мг/л β-НАД (МХ-П);
Инокулюм: показатель мутности 0,5 по стандарту МакФарланда (при использовании колоний с кровяного агара) и 1,0 (с шоколадного агара);
Инкубация: 5% СО2, 35 ± 1 º С, 18 ± 2ч.;
Учет результатов: Чашку Петри помещают дном книзу так, чтобы свет падал на поверхность агара под углом 45º С (в отраженном свете), снимают крышку. При измерении зон ориентируются на зону полного подавления видимого роста. При показателе S (чувствительный) инкубацию продлевают до 24 ч.;
Контроль качества: Streptococcus pneumoniae АТСС 49619.
Необходимо помнить, что пневмококки, как все грамположительные бактерии, обладают природной устойчивостью к азтреонаму, темоциллину, полимиксину В (колистину) и налидиксовой кислоте, как представители стрептококков – к фузидиевой кислоте и аминогликозидам.
Скрининговым тестом для оценки чувствительности S . pneumoniae к бета-лактамным антибиотикам является определение чувствительности к оксациллину (1 мкг в диске). Именно с него начинают изучение лекарственной чувствительности пневмококков и выявляют пенициллинустойчивые штаммы. Базовыми антибиотиками для изучения антибиотикограммы могут быть моксифлоксацин, эритромицин, клинидамицин и тетрациклин. Антибиотиками резерва – хлорамфеникол, триметоприм/сульфаметоксазол, ванкомицин, линезолид, рифампицин (таб. 3).
Таблица 3.
Критерии интерпретации результатов определения чувствительности S . pneumoniae : диаметры зон подавления роста (мм) и пограничные значения МПК (мг/мл)
Антимикробных препаратов
| Антимикробный препарат | Содержание в диске (мкг) | Диаметры зон подавления роста (мм) | Пограничные значения МПК (мг/л) | Примечание: | ||
| S ≥ | R < | S ≤ | R > | |||
Скрининг
Базовые препараты
Препараты резерва
S – чувствительный, R – устойчивый (интервальные отклонения относятся к промежуточному критерию чувствительности/устойчивости – I )
Номенклатуру антимикробных средств, используемых при постановке антибиотикограммы, необходимо адаптировать в каждом медицинском учреждении с учетом специфики лечебно-диагностического процесса.
Латекс-агглютинаци я
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах +35 +37 (± 1) °С;
- центрифуга лабораторная;
- анаэростат или CO2-инкубатор, поддерживающий температуру в камере в пределах +37 (± 1) °С, содержание CO2 на уровне 3 - 7 %;
- холодильник фармацевтический, поддерживающий температуру + 4 + 8 °С для хранения культур, биологических субстратов и реагентов;
- водяная баня (сухо-воздушный инкубатор);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты :
- диагностические наборы (тест-системы) для проведения латекс-агглютинации.
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
При тестировании биологических материалов (ликвор, сыворотка) для реакции используют прозрачную надосадочную жидкость образца, предварительно прогретого в сухо-воздушном инкубаторе или на водяной бане и центрифугированного (профильтрованного) для получения прозрачной надосадочной жидкости. Минимальный объем для тестирования 0,5 мл. Одну каплю каждого латексного реактива (предварительно реактивы рекомендуют тщательно встряхнуть) наносят на специальные бумажные карты, приложенные к набору. Затем добавляют 30 мкл исследуемого материала (надосадочная фракция) к каждой капле латексного реактива. Перемешивают чистым аппликатором. Осторожно покачивают бумажную карту. Агглютинация в течение 2 мин свидетельствует о присутствии в испытуемом образце специфического антигена.
Для обнаружения антигена в бактериальной культуре, выделенные на питательном агаре изоляты, собирают петлей (в количестве 10-12колоний), тщательно эмульгируют в физиологическом растворе, предварительно нанесенном на агглютинационную карту, для получения гомогенной суспензии. Латексный реагент, содержащий сенсибилизированные кроличьи антитела, специфичные для S . pneumoniae наносят на карту, перемешивают с полученной суспензией и регистрируют на наличие четкой агглютинации в течение 2 мин. (рис. 3).

Рисунок 2. Латекс-агглютинация: положительный (слева) и отрицательный (справа) результаты.
Для выполнения реакции латекс-агглютинации используют наборы латексных диагностических препаратов, например, Slidex pneumo-Kit (BioMerieuх).
В настоящее время выпускают наборы с различными комбинациями моноклональных антител для выявления антигенов наиболее часто встречаемых в диагностике бактериальных менингитов (S . pneumoniae , N . meningitidis (серогруппы А, В, С, Y/W 135), H influenzae тип В, S . agalactiae группы В, E . coli K1 и др.).
Иммунохроматографический анализ (ИХА)
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- холодильник фармацевтический, поддерживающий температуру + 4 + 8 °С для хранения культур, биологических субстратов и реагентов;
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты :
- диагностические наборы реагентов (тест-системы) для выявления антигенов ДНК возбудителя;
Средства дезинфекции:
Дезинфицирующие средства в концентрации и времени экспозиции, указанных в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- штативы и поддоны для пробирок и контейнеров;
- наконечники стерильные для дозаторов переменного объема;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Для проведения иммунохроматографического экспресс-теста используют тест-кассету в герметичной упаковке (фольга) в форме открывающейся книжки (рис.4).
Рис. 4 . Тест система для иммунохроматографического метода
Тест-кассета содержит мембрану с нанесенными на нее в виде двух отдельных полосок кроличьими антителами к антигену S . pneumoniae и козьими антителами против IgG кролика в комбинации с конъюгатом из кроличьих антител к антигену S . pneumoniae и антивидовых антител, конъюгированных с окрашенными частицами. Вторая полоска дает контрольную линию, проявляющуюся розовым или красным цветом. Кассета имеет лунку, расположенную на противоположной стороне устройства, для внесения в тест исследуемого образца. В комплект входят Реагент А – (1 пластиковый флакон-капельница – 5,0 мл) цитратно-фосфатный буфер с лаурил-сульфатом, Твином-20 и азидом натрия, тампоны для отбора образца мочи пациента, разработанные специально для использования в тесте, положительный контрольный тампон с высушенными на тампоне инактивированными S . pneumoniae и отрицательный контрольный тампон.
Перед постановкой реакции охлажденный или замороженный образец следует разморозить. Мочу для исследования непосредственно перед тестированием перемешивают легким вращательным движением. Стерильный тампон на аппликаторе, прилагаемый к диагностическому набору, погружают в мочу и помещают в кассету. Из пластиковой капельницы в кассету добавляют 3 капли реагента А (рис.5).
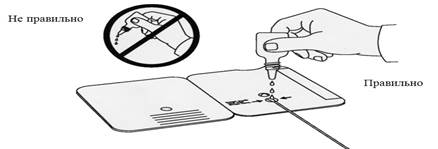
Рис. 5 . Постановка иммунохроматографического экспресс-теста
По окончании процедуры устройство закрывают, чтобы привести исследуемый образец мочи в контакт с тест - полоской.
При наличии в моче антигена S.pneumoniae происходит его связывание с находящимися на подложке антителами окрашенного конъюгата, а также с иммобилизированными на мембране кроличьми антителами к антигену S.pneumoniae, в результате чего возникает окрашенная розовая или красная линия в зоне чтения образца. Иммобилизированные на полоске в виде линии козьи антитела против IgG кролика также связывают окрашенный конъюгат и формируют вторую линию - контрольную.
Положительный результат регистрируют через 10-15 минут по наличию двух окрашенных линий в зоне чтения. На отрицательный результат указывает одна окрашенная контрольная линия, свидетельствующая об отсутствии антигена S.pneumoniae в тестируемом образце. Отсутствие окрашенной контрольной линии указывает на недействительные результаты.
Положительные и отрицательные контрольные образцы должны ставиться для каждого вновь открытого набора или в каждом отдельном случае согласно требованиям процедуры внутри лабораторного контроля качества. Для постановки контрольных реакций из пластиковой капельницы в кассету добавляют 6 капель реагента А.
Рабочая зона 1
1. Бокс биологической безопасности III класса защиты или бокс биологической безопасности II класса защиты.
2. Центрифуга для пробирок объемом 5 - 100 мл до 3 тыс. об/мин.
3. Микроцентрифуга / вортекс.
4. Настольная центрифуга для микропробирок (типа «Эппендорф» или аналоги) объемом 1,5 -2 мл до 10000g.
5. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25– 100 0С.
6. Термостатируемый шейкер для пробирок.
7. Отдельный набор автоматических пипеток переменного объема.
8. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 мл или 2,0 мл.
9. Одноразовые наконечники для пипеток переменного объема с фильтром до 200 и до 1000 мкл.
10. Штативы для наконечников, микропробирок объемом 1,5 мл.
11. Комбинированный холодильник с камерами, поддерживающими температуру от 2 до 8 0С и не выше минус 16 0С (для хранения исследуемого материала). Возможно, отдельное использование холодильника с камерой поддерживающей температуру от 2 до 8 0С и морозильника, с камерой поддерживающей температуру не выше минус 16 0С.
12. Морозильная камера на минус 70 0С (при необходимости, в случае длительного хранения материала).
13. Емкость с регламентируемым дезинфицирующим раствором.
14. Емкость с 70 % этиловым спиртом.
Рабочая зона 2
1. Бокс биологической безопасности II или III класса биологической защиты.
2. Микроцентрифуга / вортекс.
3. Настольная центрифуга для микропробирок (типа «Эппендорф» или аналоги) объемом 1,5 -2 мл до 10000g.
4. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25 - 100 0С.
5. Вакуумный отсасыватель медицинский с колбой-ловушкой.
6. Отдельный набор автоматических пипеток переменного объема.
7. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся пробирки объемом 1,5 мл или 2,0 мл.
8. Одноразовые наконечники для дозаторов переменного объема до 200 мкл.
9. Одноразовые наконечники для дозаторов переменного объема с фильтром до 100, 200 и до 1000 мкл.
10. Штативы для наконечников, микропробирок на 1,5 мл.
11. Холодильник с камерами, поддерживающими температуру от 2 до 8 0С и не выше минус 16 0С (для хранения наборов, предназначенных для выделения нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 0С и морозильника, с камерой поддерживающей температуру не выше минус 16 0С.
12. Холодильник с камерой, поддерживающей температуру от 2 до 8 0С (для хранения препаратов нуклеиновых кислот). Не допускается хранение препаратов нуклеиновых кислот в одном холодильнике с компонентами набора для выделения нуклеиновых кислот;
13. Емкость с дезинфицирующим раствором.
14. Отдельный халат, шапочки, обувь и одноразовые перчатки по МУ 1.3.2569-09.
15. Одноразовые пластиковые контейнеры для сброса и инактивации материалов.
16. Допускается использование автоматизированного оборудования для выделения нуклеиновых кислот.
17. Коммерческие наборы реагентов зарегистрированные и разрешенные для использования в РФ в установленном порядке.
Рабочая зона 3
1. Бокс биологической безопасности II и III класса или настольный бокс с бактерицидной лампой (ПЦР-бокс; УФ-бокс).
2. Программируемые термоциклеры (персональные, многомодульные, с функцией амплификации в режиме «реального времени») и автоматизированные станции. Выбор термоциклера или автоматизированной станции определяется методами амплификации нуклеиновых кислот и коммерческими наборами реагентов, используемыми в лаборатории, характером выполняемых задач и финансовыми возможностями.
4. Микроцентрифуга / вортекс.
5. Отдельный набор автоматических пипеток переменного объема.
6. Одноразовые полипропиленовые пробирки для амплификации объемом 0,5 (0,2) мл.
7. Одноразовые наконечники для пипеток переменного объема с фильтром до 10 мкл, 100 мкл и 200 мкл, свободные от ДНКаз.
8. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
9. Холодильник с камерами, поддерживающими температуру от 2 до 8 0С и от минус 180С до минус 25 0С (для хранения наборов, предназначенных для проведения обратной транскрипции и амплификации нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 0С и морозильника с камерой, поддерживающей температуру от минус 180С до минус 25 0С.
10. Емкость для сброса отработанных расходных материалов.
11. С целью автоматизации процедуры приготовления реакционных смесей для амплификации допускается использование автоматизированного оборудования для раскапывания реагентов.
12. Коммерческие диагностические наборы реагентов (тест-ситемы) зарегистрированные и разрешенные для использования в РФ в установленном порядке.
Этап пробоподготовки
Некоторые виды биологического материала, перечисленные в данном разделе, требуют предварительной обработки перед проведением исследования.
Мокрота или аспират из трахеи. Вязкая по консистенции мокрота подлежит обработке реагентом, разрушающим мукополисахариды (например, препаратом «муколизин» или аналогом). С целью снижения вязкости в емкость с мокротой добавляется равное количеству мокроты количество реагента. После инкубации при комнатной температуре до просветления мокроты (не более 20 минут) 100 мкл мокроты используют для экстракции ДНК. При необходимости повторного проведения анализа остаток обработанной мокроты замораживают.
Бронхоальвеолярный лаваж или промывные воды бронхов. Образец перемешивают переворачиванием в исходной емкости. Автоматическим дозатором, используя наконечник с фильтром, отбирают 1 мл образца и переносят в пробирку объемом 1,5 мл для проведения центрифугирования при 10 тыс об/мин в течение 10 мин. Надосадочную жидкость аккуратно отбирают, используя наконечник с фильтром, оставляя над осадком 200 мкл жидкости, в которой ресуспендируют осадок. Полученную суспензию (100 мкл) используют для экстракции ДНК. При необходимости повторного проведения анализа оставшийся материал замораживают.
Cекционный материал гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10 % суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку на 1,5 мл и центрифугируют при 10 тыс об/мин в течение 5 мин. Надосадочную жидкость (100 мкл) используют для экстракции ДНК. При необходимости повторного проведения анализа остаток суспензии замораживают.
Метод латекс-агглютинации
Порядок проведения исследования аналогичен п. 6.2.4.
Отличия заключается в использовании нескольких латексных реагентов, содержщих сенсибилизированные кроличьи антитела специфичные для определенной серологической группы S . pneumoniae.
Метод ПЦР
Порядок проведения исследования аналогичен п. 6.2.6.
Для определения серотипов S . pneumoniae c помощью ПЦР в режиме «реального времени» может быть использована методика, предполагающая исследование 16 серотип-специфических мишеней в 4 реакционных смесях. Каждая из реакционных смесей содержит праймеры и зонды для проведения ПЦР на амплификаторах с пятью каналами флуоресцентной детекции. Методика предназначена для определения пневмококков, ассоциированных с инвазивными формами инфекции, капсульные антигены которых включены в состав 10- и 13-валентных конъюгированных вакцин. Серотип-специфические праймеры и зонды распределены по реакционным смесям следующим образом:
реакционная смесь №1 - 3, 6BA, 19F, 9VA;
реакционная смесь №2 - 1, 14, 23F, 4;
реакционная смесь №3 - 18, 9NL, 15AF, 11AD;
реакционная смесь №4 - 2, 5, 7AF, 19A.
Каждая реакционная смесь содержит праймеры (Pai et al., 2006) и зонд для амплификации положительного внутреннего контроля – фрагмента гена cps.
Порядок проведения исследования с использованием данной методики, условия проведения амплификации и интерпретации результатов опубликованы в работе К.О. Миронова и соавторами (К.О. Миронов и соавт., 2014). Выбор методики для определения серологических типов S . pneumoniae зависит от их предполагаемого распространения в наблюдаемой популяции на данной территории, эпидемиологической обстановки и проведения иммунопрофилактических мероприятий. В частности, для расширенного эпидемиологического исследования могут быть использованы альтернативные зарубежные или отечественные (Н.А. Маянский и соавт., 2010; К.О. Миронов и соавт., 2011) методики, предполагающие детекцию большего количества серотип-специфических мишеней.
Постаналитический этап
Библиографический указатель
- Акимкин В.Г. Организационно-эпидемиологические аспекты профилактики внебольничной пневмонии в воинских коллективах / В.Г. Акимкин, А.Б. Белевитин, В.Д. Мосягин и др. // Военно-медицинский журнал. – 2009. - № 9. – С. 56-63.
- Баранов А.А., Брико Н.И., Намазова-Баранова Л.С., Ряпис Л.А. Стрептококки и пневмококки / Руководство для врачей. - Ростов-на –Дону: Феникс. - 2013. - 302 с.
- Баранов А.А., Намазова Л.С., Таточенко В.К. Пневмококковая инфекция и связанные с ней заболевания - серьезная проблема современного здравоохранения // Журн. Педиатрическая фармакология. - 2008. - Том 5. - №1. - С. 28–33.
- Брико Н.И. Бремя пневмококковых инфекций и направления совершенствования эпидемиологического надзора в России// Эпидемиология и инфекционные болезни. Актуальные вопросы. - 2013. - № 6. - С. 4-9.
- ГОСТ Р 52905-2007 (ИСО 15190:2002) «Национальный стандарт Российской федерации. Лаборатории медицинские. Требования безопасности. Medical laboratories. Requirements for safety (Утв. 01.07.2009 г.).
- Инструкция к набору реагентов Binax NOW «Streptococcus pneumoniae test ». http://www.biograd.ru/sites/default/files/BinaxNOW%20S.pneumoniae.pdf/ (дата обращения: 07.10.2015).
- Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» (Утв. ноябрь 2014 г.)
- Козлов Р.С. Пневмококки: прошлое, настоящее и будущее / Смоленск: Смоленская государственная медицинская академия. - 2005. - 128 с.
- Козлов Р.С. с соавт. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999-2005 гг.: результаты многоцентровых проспективных исследований ПеГАС-I и ПеГАС-II // КМАХ. - 2006. - Том 8. - №1. – С. 33-47.
- Козлов Р.С., Стецюк О.У., Богданович Т.М., Кречикова О.И., Суворов М.М. Выделение, идентификация и определение чувствительности к антибиотикам Streptococcus pneumoniae // Клиническая микробиология и антимикробная химиотерапия. - 2000. - № 1. - С. 88-98.
- Ломинадзе Г.Г., Семенова Е.А., Мотузова О.В., Калакуцкая А.Н., Лазарева А.В.. Использование метода MALDI-TOF масс-спектрометрии для ускорения идентификации микроорганизмов в гемокультурах пациентов с подозрением на сепсис // Лабораторная диагностика. «ЛАБОРАТОРИЯ ЛПУ». – 2014. №4.
- Малеев В.В. Внебольничные пневмонии: классификация, патогенез, этиология, эпидемиология, лабораторная диагностика на современном этапе / В.В. Малеев, Е.Б. Ежлова, Ю.В. Демина и др. – М: ЦНИИЭ, - 2013. – 65 с.
- Маянский Н.А., Алябьева Н.М., Катосова Л.К., Гречуха Т.А., Пинелис В.Г., Намазова-Баранова Л.С. Определение капсульных серотипов пневмококка методом мультиплексной ПЦР // Вопросы диагностики в педиатрии. – 2010. №6, С. 6-10.
- Методические указания МУ 3.1.2.3047-13 «Эпидемиологический надзор за внебольничными пневмониями» (Утв. 10.01.2013 г.).
- Методические указания МУ 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» (Утв. 21.10.2013 г.).
- Миронов К.О. Идентификация и серотипирование российских штаммов Streptococcus pneumoniae с применением методик, основанных на ПЦР / Миронов К.О., Платонов А.Е., Козлов Р.С. // Клиническая микробиология и антимикробная химиотерапия. – 2011. – Том 13. - № 4. – С. 304-313.
- Миронов К.О. Методика ПЦР в режиме реального времени для определения серотипов Streptococcus pneumoniae / Миронов К.О., Платонов А.Е., Дунаева Е.А. и др. // Журн. микробиол. – 2014. – № 1. – С. 41-48.
- Николенко В.В. Опыт использования иммунохроматографического теста для диагностики пневмококковой пневмонии / Николенко В.В., Фельдблюм И.В., Воробьева Н.Н. и др. // ЖМЭИ. – 2015. - № 3. – С. 18-24.
- Практические рекомендации "Выделение, идентификация и определение чувствительности к антибиотикам Streptococcus neumoniae" / под ред. Страчунского Л.С. //Клиническая микробиология и антимикробная химиотерапия. – 2000. - Том 2. - №1. - С. 88-98.
- Приложение к Методическим указаниям МУ 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» (Утв. 21.10.2013 г.).
- Рачина С.А., Козлов Р.С., Шаль Е.П., Устюжанин И.В., Кречиков О.И., Иванчик Н.В., Гудков И.В., Асафьева О.Ю., Гучев И.А., Гуляева С.А., Бурдинская Ю.В., Яцышина С.Б., Астахова Т.С., Бейкин Я.Б., Беседина Л.Г.. Структура бактериальных возбудителей внебольничной пневмонии в многопрофильных стационарах Смоленска // Пульмонология. – 2011. - №1, - С. 5-18.
- Санитарно-эпидемиологические правила СП 1.3.2322-08 «Безопасность работы с микроорганизмами 3-4 групп патогенности и возбудителями паразитарных болезней» (Утв. 28.01.2008 г.) (с изменениями от 2.06.2009 г.).
- Санитарно-эпидемиологические правила СП 2.1.2.3116-13 «Профилактика внебольничных пневмоний» (Утв. 2.02.2014 г.).
- Санитарные правила и нормативы СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» (Утв. 09.12.2010 г.).
- Санитарные правила СП 1.2.036-95 «Порядок учета, хранения и транспортирования микроорганизмов I-IV групп патогенности» (Утв. 28.08.1995 г.).
- Середкина М.А., Кречикова О.И., Сухорукова М.В. Микробиологическое исследование аутопсийного материала и интерпретация его результатов // Клиническая микробиология и антимикробная химиотерапия. - 2000. – Том 2. - № 2. - С. 79-85.
- Сидоренко С.В., Лобзин Ю.В., Харит С.М., Королева И.С., Таточенко В.К. Пневмококковая инфекция и современные возможности ее профилактики - эпидемиологический обзор ситуации в мире и в России // Вопросы современной терапии. - 2010, - №1(9). - С. 54-61.
- Федеральный закон 99-ФЗ «О лицензировании отдельных видов деятельности» от 27.11.2011 г.
- Фельдблюм И.В., Голоднова С.О., Семериков В.В. Эпидемиологические проявления заболеваемости и смертности от пневмоний среди населения г. Перми // Медицинский алфавит. – 2015. - №. 17(258)– С. 13-17.
- Фельдблюм И.В., Голоднова С.О., Семериков В.В. Уровень и внутригодовая динамика носительства S . pneumonia среди различных групп взрослого населения // Эпидемиология и инфекционные болезни. Актуальные вопросы. – 2015. - №.5 – С.13-16.
- Чучалин А.Г. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению, профилактике / А.Г. Чучалин, А.И. Синкопальников, Р.С. Козлов, И.Е. Тюрин, С.А. Рачина // Клин. микробиол антибиот. химиотер. - 2010. - №3(12). – С. 186-225.
- Abdeldaim G.M., Stralin K., Olcen P., Blomberg J., Herrmann B. Toward a quantitative DNA-based definition of pneumococcal pneumonia: a comparison of Streptococcus pneumoniae target genes, with special reference to the Spn9802 fragment // Diagn. Microbiol. Infect. Dis. – 2008. – Vol. 60. – P. 143–150.
- Bentley S.D. Genetic Analysis of the Capsular Biosynthetic Locus from All 90 Pneumococcal Serotypes / Bentley S.D., Aanensen D.M., Mavroidi A. et al. // PLoS Genet. – 2006. – Vol. 2. - № 3. – e31.
- Carvalho M.G., Pimenta F.C., Jackson D., Roundtree A. et al. Revisiting pneumococcal carriage by use of broth enrichment and PCR techniques for enhanced detection of carriage and serotypes // J. Clin. Microbiol. – 2010. – Vol. 48. - № 5. – P. 1611–1618.
- Catterall J.R. Streptococcus pneumonia / Catterall J.R. // Thorax. - 1999. - Vol. 54. - P. 929- 937.
- Dominguez J. Detection of Streptococcus pneumonia antigen by a rapid immunochromatographic assay in utinesamples / Dominguez J., Gali N., Blanco S. et al. // Chest. – 2001. – Vol. 119. – P. 243-249.
- European on Antimicrobial Susceptibility Testing – EUCAST. http://www.eucast.org/ (дата обращения: 07.10.2015).
- Fine M.J., Smith M.A., Carson C.A., Mutha S.S., Sankey S.S., Weissfeld L.A., Kapoor W.N. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis // JAMA. – 1996. – Vol. 275(2). – P. 134-141.
- Gutiérrez F., Masiá M., Rodríguez J.C., Ayelo A., Soldán B., Cebrián L., Mirete C., Royo G., Hidalgo A.M. Evaluation of the immunochromatographic Binax NOW assay for detection of Streptococcus pneumoniae urinary antigen in a prospective study of community-acquired pneumonia in Spain // Clin. Infect. Dis. – 2003. – Vol. 36(3). - P. 286-292.
- Kawamura Y., Hou X.-G., Sultana F., Miura H., Ezaki T. Determination of 16S rRNA sequences of Streptococcus mitis and Streptococcus gordonii and phylogenetic relationships among members of the genus Streptococcus // Int. J. Syst. Bacteriol. - 1995. – Vol. 45. – P. 406–408.
- Mandell L.A., Marrie T.J., Grossman R.F., Chow A.W., Hyland R.H. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group // Clin Infect Dis. – 2000. - Vol. 31(2). – P. 383-421.
- Mavroidi A. Genetic Relatedness of the Streptococcus pneumoniae Capsular Biosynthetic Loci / Mavroidi A., Aanensen D.M., Godoy D. et al. // J. Bacteriol. – 2007. – Vol. 189. - № 21. – P. 7841–7855.
- Pai R. Sequential multiplex PCR approach for determining capsular serotypes of Streptococcus pneumoniae isolates / Pai R., Gertz R.E., Beall B. // J. Clin. Microbiol. – 2006. – Vol. 44. - № 1. – P. 124-131.
- Park H.K., Lee S-J, Yoon J.W., Shin J.W., Shin H-S., Kook J-K., Myung S.C., Kim W. Identification of the cpsA gene as a specific marker for the discrimination of Streptococcus pneumoniae from viridans group streptococci // J. of Med. Microbiol. - 2010, - Vol. 59, - P. 1146–1152.
- PCR Deduction of Pneumococcal Serotypes. http://www.cdc.gov/streplab/pcr.html/ (дата обращения: 07.10.2015).
- Rudan I., Boschi-Pinto C., Biloglav Z., Mulholland K., Campbell H. Epidemiology and etiology of childhood pneumonia // Bull World Health Organ. – 2008. – Vol. 86(5). – P. 408-416.
- Simões A.S., Valente C., de Lencastre H., Sá-Leão R. Rapid identification of noncapsulated Streptococcus pneumoniae in nasopharyngeal samples allowing detection of co-colonization and reevaluation of prevalence // Diagn. Microbiol. Infect. Dis. – 2011. – Vol. 71. – P. 208–216.
- Sinclair A. Systematicreview and metaanalysis of a urinebased pneumococcal antigen test for diagnosis of communityacquired pneumonia caused by Streptococcus pneumoniae / Sinclair A., Xie X., Teltscher M., Dendukuri N. // J. Clin. Microbiol. – 2013. – Vol. 51(7). – P. 2303-2310.
- Smith M.D., Derrington P., Evans R., Creek M., Morris R., Dance D.A., Cartwright K. Rapid diagnosis of bacteremic pneumococcal infections in adults by using the Binax NOW Streptococcus pneumoniae urinary antigen test: a prospective, controlled clinical evaluation // J. Clin. Microbiol. – 2003. - Vol. 41(7). - P 2810-2813.
- Stralin K., Herrmann B., Abdeldaim G., Olcen P., Holmberg H., Molling P. Comparison of sputum and nasopharyngeal aspirate samples and of the PCR gene targets lytA and Spn9802 for quantitative PCR for rapid detection of pneumococcal pneumonia // J. Clin. Microbiol. - 2014. Vol. 52. – P. 83–89.
- Tatochenko V. Streptococcus pneumonia serotype distribution children in the Russian Federation before the introduction of pneumococcal conjugate vaccines into the national immunization program / Tatochenko V., Sidorenko S., Namazova-Baranova L. et. al. // Expert review of vaccine. – 2014. – Vol. 2(13). – P. 257-264.
- Weichselbaum A. Current blood culture methods and systems: clinical concepts, technology, and interpretation of results / Weichselbaum A. // Clin. Infect. Dis. – 1996. – Vol. 23. – P. 40-46.
- Whatmore A.M., Efstratiou A., Pickerill A.P., Broughton K., Woodard G., Sturgeon D., George R., Dowson C.G. Genetic relationships between clinical isolates of Streptococcus pneumoniae, Streptococcus oralis, and Streptococcus mitis: characterization of “atypical” pneumococci and organisms allied to S. mitis harboring S. pneumoniae virulence factor-encoding genes // Infect. Immun. - 2000. – Vol. 68. – P. 1374–1382.
Приложения
Приложение 1.
Основные дифференцирующие тесты Streptococcus pneumoniae
Постановка теста c желчью
Реагенты:
- Диски с желчью ( Набор – 1 флакон по 100 дисков).
Метод:
- Обильно засеять поверхность кровяного агара в чашке, используя либо чистую культуру испытуемого микроорганизма, либо патологический исследуемый материал (если одновременно проводится выделение чистой культуры возбудителя).
- Наложить диск с желчью на поверхность засеянного испытуемой культурой агара.
- На поверхность диска нанести несколько капель стерильной дистиллированной воды (до полного пропитывания диска).
- Инкубировать при температуре 37º С в атмосфере СО2, используя GENbox CO2 генератор ( Каталожный номер – 96 126) в течение 18-24 часов.
- Определить наличие зоны вокруг диска с желчью.
Интерпретация:
- Положительный результат теста: наличие зоны задержки роста.
- Отрицательный результат теста: рост культуры вокруг диска, как и без него.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: низкое качество реактива.
- Ложноположительные результаты: отдельные штаммы стрептококков группы viridans лизируются желчью.
Контроль качества:
- Положительный результат теста с Streptococcus pneumoniae ATCC 49619.
- Отрицательный результат теста с Enterococcus faecalis АТСС 29212
Постановка ПИРА-теста
Реагенты:
ПИРА-тест – набор для определения пирролидамилариламидазы микроорганизмов( Каталожный номер – 10 003 344. Набор на 50 определений).
Метод:
- Достать из тубуса ПИРА-теста пинцетом тест-полоску на предметное стекло (в чашку Петри)
- В зону индикации полоски нанести 20 мкл стерильной дистиллированной воды.
- В зону индикации нести несколько изолированных колоний суточной культуры испытуемого микроорганизма, используя пастеровскую пипетку, деревянную палочку или платиновую бактериологическую петлю.
- Полоску инкубировать 10 мин. при комнатной температуре.
- Добавить в зону индикации 1 каплю реактива для ПИРАтеста (кат. № 10 003 379), пользуясь дозатором или капельницей во флаконе.
- Через 1-2 мин. Приступить к учету результатов.
Интерпретация:
- Положительный результат теста: появление красного окрашивания тест-полоски в месте нанесения бактериальной культуры.
- Отрицательный результат теста: желтое (бесцветное) окрашивание.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: при использовании культуры микроорганизмов старше 24 ч., недостаточное количество нанесенного материала.
- Ложноположительные результаты: низкое качество реактива.
Контроль качества:
- Положительный результат теста с Enterococcus faecalis АТСС 29212.
- Отрицательный результат теста с Streptococcus pneumoniae ATCC 49619.
Приложение 2.
Государственное санитарно-эпидемиологическое
Дата: 2018-12-28, просмотров: 458.