Синдром раздраженного кишечника (СРК) — устойчивая совокупность функциональных расстройств, проявляющаяся болью и/или чувством дискомфорта в животе, которые проходят после дефекации, и сопровождающаяся изменением частоты и консистенции стула. Эти расстройства должны продолжаться не менее 12 нед на протяжении последних 12 мес.
Заболевание широко распространено, по данным мировой статистики, СРК страдают 15—20 % населения, женщины болеют в 2—4 раза чаще, чем мужчины. Наибольшая распространенность заболевания отмечается среди JjU 30—40 лет. Первое появление симптомов заболевания в пожилом возрасте считается маловероятным, поэтому диагноз СРК в подобных случаях
сомнителен.
Этиология и патогенез. Имеет значение наследственная предрасположенность (симптомы СРК у однояйцевых близнецов встречаются чаще, чем у двуяйцевых). Большое внимание уделяется психоэмоциональному стрессу (в анамнезе таких больных часто отмечаются так называемые жизненные стрессовые ситуации, а также состояние тревоги или же эпизоды депрессии).
В патогенезе важное место отводится различным нарушениям двигательной функции кишечника. Эти нарушения, хотя и не являются специфичными для СРК и встречаются при других заболеваниях кишечника, все же считаются основной причиной возникновения болей и нарушений стула. У больных с СРК отмечается снижение порога чувствительности прямой кишки (висцеральная гипералгезия), которая проявляется снижением порога восприятия боли, а также более интенсивным ощущением боли при нормальном ее восприятии. У части больных с СРК выявляют изменения толстого кишечника в виде уменьшения его емкости («короткий» кишечник) либо дополнительную петлю в области сигмы («увеличение емкости»).
Классификация. Согласно рекомендациям Международных рабочих совещаний (Рим, 1988, 1998), выделяют три формы заболевания: с преобладанием болей и метеоризма, с преобладанием диареи, с преобладанием запоров. Для СРК характерны следующие симптомы: 1) частота стула менее 3 раз в неделю; 2) частота стула более 3 раз в день; 3) твердый или комковатый стул; 4) жидкий (кашицеобразный) стул; 5) напряжение при акте дефекации; 6) неотложные (императивные) позывы на стул; 7) ощущение неполного опорожнения кишечника; 8) выделение слизи при дефекации; 9) вздутие живота.
Для варианта СРК с преобладанием диареи характерно сочетание признаков 2, 4, 6 и отсутствие признаков 1, 3, 5.
Для варианта СРК с преобладанием запоров характерно сочетание признаков 1, 3, 5 в отсутствие признаков 2, 4, 6.
Клиническая картина. На I этапе диагностического поиска опрос больного позволяет с большой вероятностью предположить у пациента наличие СРК. Боли локализуются обычно в подвздошной области, они могут быть ноющими, тупыми или схваткообразными, не иррадиируют, усиливаются после приема пищи и уменьшаются после отхождения газов или дефекации. Ночью боли, как правило, не возникают. У женщин боли могут усиливаться во время менструаций.
При преобладании запоров боли могут быть постоянными и зависят от спастического сокращения сигмовидной кишки. Нарушение двигательной Функции толстой кишки обусловливает появление стула в виде «овечьего» кала или орешков. Для нормализации функции кишечника больные часто прибегают к приему слабительных средств или применению очистительных клизм.
333

 Диарея у пациентов с СРК имеет ряд особенностей: она отсутствует ночью и возникает либо рано утром (при пробуждении больного) — так называемый симптом будильника или после приема пищи («гастроколитиче-ский» рефлекс, по определению старых авторов). Позывы на дефекацию носят часто императивный характер, что объясняется усилением двигательной функции кишечника и повышенным газообразованием. Такие больные плохо переносят легко бродящие продукты (молоко, черный хлеб, мороженое, виноград), тогда как кисломолочные продукты переносят хорошо точно так же как и вареное мясо, каши (особенно гречневую). Частота стула не превышает, как правило, 2—5 раз в день. Позывы на дефекацию возникают с небольшими интервалами в течение короткого времени. При первом акте дефекации стул может быть оформленным, при последующих актах — кашицеобразным и жидким. Общая масса выделенного кала обычно не превышает 200 г.
Диарея у пациентов с СРК имеет ряд особенностей: она отсутствует ночью и возникает либо рано утром (при пробуждении больного) — так называемый симптом будильника или после приема пищи («гастроколитиче-ский» рефлекс, по определению старых авторов). Позывы на дефекацию носят часто императивный характер, что объясняется усилением двигательной функции кишечника и повышенным газообразованием. Такие больные плохо переносят легко бродящие продукты (молоко, черный хлеб, мороженое, виноград), тогда как кисломолочные продукты переносят хорошо точно так же как и вареное мясо, каши (особенно гречневую). Частота стула не превышает, как правило, 2—5 раз в день. Позывы на дефекацию возникают с небольшими интервалами в течение короткого времени. При первом акте дефекации стул может быть оформленным, при последующих актах — кашицеобразным и жидким. Общая масса выделенного кала обычно не превышает 200 г.
Достаточно часто встречаются внекишечные симптомы: наклонность к сердцебиениям и частым головным болям типа мигрени, общая повышенная возбудимость, неудовлетворенность дыханием (гипервентиляционный синдром). Кишечные нарушения часто сочетаются с синдромом раздраженного мочевого пузыря (до 30 %), неязвенной диспепсии (изменение аппетита, отрыжка, изжога), сексуальными нарушениями.
На II этапе диагностического поиска выявляется немного значимых для диагноза признаков. Тем не менее можно обнаружить непостоянную болезненность по ходу спазмированного толстого кишечника, «шум плеска» и урчание в области слепой кишки. Отмечаются симптомы вегетативной дисфункции: холодные кисти и стопы, повышенное потоотделение, выраженный дермографизм, наклонность к тахи- или брадикардии; часто выявляется гипотония.
Данные III этапа диагностического поиска нужны прежде всего для исключения других заболеваний желудочно-кишечного тракта, так как диагноз СРК является «диагнозом исключения». Этому помогают исследования кала, эндоскопия и рентгенологическое исследование.
Анализ кала предусматривает микроскопию, химическое исследование (определение в суточном кале аммиака и органических кислот), бактериологическое исследование. На основании этих исследований выделяют типичные копрологические синдромы при СРК.
♦ Синдром бродильной диспепсии:
а) кашицеобразный кал кислой реакции;
б) незначительное количество мыл и жирных кислот;
в) очень много крахмала, перевариваемой клетчатки и йодофильной
флоры;
г) содержание органических кислот в суточном количестве кала увели
чено.
♦ Синдром гнилостной диспепсии:
а) кашицеобразный темно-коричневый кал щелочной реакции с гнило
стным запахом;
б) в кале содержание обычных ингредиентов не превышает норму;
в) резко увеличено содержание аммиака в суточном количестве кала.
Исследование бактериальной флоры кала часто выявляет дисбактерй-
оз — уменьшение количества бифидо- и лактобактерий, увеличение количества гемолитических и лактозонегативных эшерихий, патогенного стафилококка, протея, гемолитического стафилококка.
| 334 |
Определение суточной потери жира позволяет исключить внешнесекре-торную недостаточность поджелудочной железы при хроническом панкреа-
jjire. Для выявления скрытой лактозной недостаточности используют тест с нагрузкой лактозой.
При эндоскопическом исследовании различных отделов толстого кишечника прежде всего исключают воспалительные заболевания (неспецифический язвенный колит, болезнь Крона), а также опухоли, полипы, дивертикулы. Слизистая оболочка толстого кишечника обычно не изменена.
При рентгенологическом исследовании обнаруживают типичные признаки дискинезии: неравномерное наполнение и опорожнение, чередование спастически сокращенных и дилатированных участков кишечника, избыточную секрецию в просвет кишечника.
Данные ультразвукового исследования (по показаниям выполняют компьютерную томографию брюшной полости) позволяют исключить желчнокаменную болезнь, наличие кист и кальцинатов в поджелудочной железе, объемных образований в органах брюшной полости, способных обусловить симптомы кишечных расстройств.
Биохимическое и клиническое исследование крови не обнаруживает каких-либо изменений.
Диагностика. Распознавание болезни основано на выявлении типичных симптомов (указанных выше) и исключении «органических» поражений кишечника, а также других заболеваний желудочно-кишечного тракта, сопровождающихся кишечными расстройствами.
Существенно, что клинические критерии, укладывающиеся в рамки «Римских критериев» СРК, не являются специфичными и могут встречаться при многих органических заболеваниях (опухоли кишечника, болезнь Крона, неспецифический язвенный колит, хронический панкреатит). В то же время можно отметить ряд признаков, при наличии которых диагноз СРК становится весьма вероятным. К ним относятся следующие: 1) длительное течение заболевания (как правило, многолетнее) без заметного прогрессирования; 2) многообразие имеющихся жалоб, обусловленных вегетативной дисфункцией; 3) изменчивый характер жалоб; 4) связь ухудшения самочувствия с психоэмоциональными факторами; 5) отсутствие болей и кишечных расстройств (диареи) в ночное время; 6) отсутствие так называемых симптомов тревоги — примеси крови в кале, лихорадки, необъяснимого похудения, анемии, увеличения СОЭ и др.
Кишечная диспепсия наблюдается как изолированный признак при различных алиментарных перегрузках, чаще всего при перегрузке углеводами, реже — белковой пищей. В первом случае отмечается диарея, во втором — запоры. Если нет пищевых нарушений, то жалоб может и не быть. Причины диареи — размножение йодофильной флоры, что возможно и на фоне обычного питания. При эндоскопии изменений слизистой оболочки не наблюдается. При исследовании кала обнаруживают типичные копрологические синдромы бродильной или гнилостной диспепсии без признаков воспаления или повышенного выделения ферментов. Рентгенологически выявляют признаки дискинезии толстого кишечника. Общее состояние пациента не меняется. Нормализация питания быстро приводит к улучшению состояния.
Опухоли кишечника следует исключить при первом обращении больного к врачу. При локализации опухоли в правой половине толстого кишечника в клинической картине доминирует железодефицитная анемия, а «кишечные» симптомы выражены мало. В связи с этим всем больным среднего и пожилого возраста с железодефицитной анемией следует проводить коло-Носкопию. Локализация опухоли в левой половине толстого кишечника обусловливает упорные запоры (иногда прерываемые эпизодами диареи). Слабительные средства, а также клизмы сначала способствуют опорожне-
335
нию кишечника, а в дальнейшем становятся малоэффективными. Эти сим-птомы должны привлечь внимание врача (диагноз устанавливают после эндоскопического исследования).
Хронический энтерит, неспецифический язвенный колит и болезнь Крона (см. соответствующие отделы данной главы).
Следует еше раз напомнить, что диагноз СРК ставят после исключения целого ряда заболеваний и состояний, сопровождающихся нарушением деятельности кишечника.
Лечение. Лечение больного СРК должно быть комплексным и включать: 1) общие мероприятия («образование больного» для правильного понимания существа имеющихся у него симптомов); 2) диетические мероприятия; 3) лекарственную терапию (в зависимости от преобладания диареи или запоров).
Необходимо объяснить больному доброкачественность его страдания, демонстрируя ему данные лабораторных и инструментальных исследований, свидетельствующих об отсутствии у него тяжелых заболеваний (прежде всего опухолей кишечника и других отделов желудочно-кишечного тракта).
Диетические мероприятия в настоящее время подверглись существенному пересмотру, тем не менее следует подробно расспросить больного о переносимости тех или иных продуктов с тем, чтобы дать определенные рекомендации (при диарее исключаются легко бродящие углеводы, грубая клетчатка; напротив, при запорах оправданы пищевые добавки — пшеничные отруби, семя льна).
При СРК с преобладанием диареи назначают: а) регуляторы моторики — лоперамид в дозе по 0,002 г 2 таблетки 1 раз в день под язык до стабилизации стула (1—3 дня и более); б) смекту — 1 пакетик 3 раза в день до еды до оформления стула; в) один из пробиотиков — бифиформ по 1—2 капсулы 2 раза в день (2 нед), линекс 1—2 капсулы 3 раза в день (4 нед), лактобактерин 5 доз 2 раза в день (4 нед); г) пребиотик — хилак-форте по 60 капель 3 раза в день (4 нед).
При СРК с преобладанием запоров назначают: а) мукофальк по 1—2 чайные ложки на ночь (2 нед) или макрогель-4000 по 10—20 г (1—2 пакетика) на ночь; б) лактулозу по 10—30 мл.
При СРК с преобладанием болей применяют: а) спазмолитик миотроп-ного ряда — мебеверин по 0,2 г 2 раза в день; б) пинаверия бромид по 0,05 г 3 раза в день.
Важным компонентом лечения больных СРК является применение психотропных средств, что обусловливается частой связью симптомов СРК с психотравмирующей ситуацией, повышенным уровнем тревоги и депрессии, которые обнаруживаются у 40—60 % пациентов. Чаще всего назначают (на 4—6 мес) тианептин (коаксил) по 1 таблетке 3 раза в день. Препарат весьма эффективен, хорошо переносится и не имеет побочных эффектов.
Прогноз. СРК не имеет тенденции к прогрессированию, что делает его благоприятным, хотя полной ликвидации симптомов может и не быть.
Хронический гепатит
скийР£?ИЧЕСКИЙ. ГЕПАТИТ (ХГеп) - диффузный полиэтиологиче-Ewспалител™ процесс в печени, продолжающийся более 6 мес. н™5£°логически ХГеп характеризуется дистрофией или некрозами пече-I™ ™ Ю1СТОК (°Т единичных До массивных), инфильтрацией ткани печени иммунокомпетентными клетками и полиморфно-ядерными лейкоцита-
336
jQi расширением портальных трактов за счет воспалительной инфильтрации в основном лимфоцитами и плазматическими клетками, фиброзом п0ртальных трактов при сохранении дольковой структуры печени.
Хронический воспалительный процесс в печени может быть как самостоятельным в нозологическом отношении заболеванием, так и реакцией печеночной ткани на внепеченочные заболевания и очаговые поражения печени, т.е. являться неспецифическим реактивным гепатитом (НРГеп). К группе НРГеп примыкает хронический гранулематозный гепатит. Морфологические изменения печени при НРГеп не имеют тенденции к прогрессированию, течение НРГеп целиком зависит от динамики основного
заболевания.
Классификация. В основе применявшихся до настоящего времени классификаций ХГеп лежало разделение гепатита по морфологическому признаку с одновременной прогностической оценкой, т.е. определением тенденции прогрессирования в цирроз печени [Акапулько, 1974].
Все ХГеп подразделялись на хронический персистирующий гепатит (ХГТГеп), хронический активный гепатит (ХАГеп) и хронический лобуляр-ный гепатит (ХЛГеп).
При ХПгеп гистологическое исследование биоптатов позволяло выявить расширение и умеренное склерозирование портальных полей без нарушения дольковой архитектоники, инфильтрацию портальных трактов, умеренную дистрофию гепатоцитов без некроза. Этот вариант ХГеп не трансформируется в цирроз печени.
ХАГеп характеризуется обширными и сливающимися (мостовидными) некрозами, значительными дистрофическими изменениями гепатоцитов, выраженной инфильтрацией портальных трактов с распространением воспалительных инфильтратов в паренхиму, фиброзированием портальных трактов, проникающим в дольку. Этот вариант переходит в цирроз печени.
ХЛГеп характеризуется мелкими некрозами и внутридольковой инфильтрацией. Изменения более выражены, чем при ХПГеп, но не достигают степени ХАГеп.
Появление современной дифференцированной этиотропной терапии потребовало сделать акценты на этиологических аспектах.
Классификацию, подразделяющую хронические гепатиты на ХПГеп, ХЛГеп, ХАГеп предлагается заменить новым подходом [Лос-Анжелес, 1994]. Хронический гепатит предлагается оценивать по следующим критериям: 1) по этиологии; 2) по клинической картине; 3) по гистологическим изменениям (т.е. по выраженности некрозов и воспаления); 4) по стадии хронизации (т.е. по распространенности фиброза).
Этиология. Выделяют три основных этиологических типа ХГеп: 1) вирусный; 2) аутоиммунный; 3) лекарственный. Выделена и четвертая группа — криптогенный хронический гепатит, т.е. гепатит неуточненной этиологии.
Авторы классификации исключили алкогольный, наследственный, токсический ХГеп, так как, по их мнению, не доказаны механизмы хрониза-Иии и прогрессирования этих гепатитов.
Отечественные авторы к этиологическим факторам ХГеп относят и алкоголь, выделяя наряду с острым и хронический алкогольный гепатит, полагая, что алкогольный гепатит лежит в основе хронизации процесса.
В группе вирусных гепатитов выделяют следующие этиологические Факторы: 1) вирус гепатита В — HBV; 2) вирус гепатита D — HDV; 3) ви-РУс гепатита С — HCV; 4) неопределенные (негепатотропные) или неизвестные вирусы.
337
Основной массив в полиэтиологической группе ХГеп составляют гепатиты вирусной этиологии, среди них чаще всего встречается гепатит, вызванный вирусом В (HBV). Считают, что 5 % населения Земли страдают ХВГеп В, эта нозология занимает девятое место среди причин смерти. Такая распространенность обусловлена высокой заболеваемостью острым гепатитом В. У 3 % перенесших желтушную форму острого гепатита В болезнь переходит в хроническую форму, причем чаще у мужчин. Носителями HBV являются 300—370 млн человек, в Западной Европе носители составляют 0,2—1 %, в России — 7 %. В последние годы быстрыми темпами растет заболеваемость хроническим вирусным гепатитом С (ХВГеп С). При этом отмечают значительные географические различия: ХВГеп С имеют 0,4 % населения Европы и 15 % населения Центральной Африки. Возросло значение в генезе ХГеп алкоголя и метаболических болезней печени (болезнь Вильсона—Коновалова, гемохроматоз, неалкогольный стеатогепатит).
Пути передачи HBV, HCV, HDV идентичны. Вирусы гепатита A (HAV) и гепатита Е (HEV) не являются причиной хронических гепатитов.
Хронический аутоиммунный гепатит (ХАИТ) был описан в 1950 г. Вальденстремом и имеет много названий, отражающих различные особенности заболевания (ювенильный цирроз, гепатит молодых женщин, гипер-у-глобулинемический гепатит, люпоидный гепатит).
Этиология этого гепатита неизвестна, но ясно, что ХАИТ — это заболевание, обусловленное нарушением регуляции иммунитета, дефектом су-прессорных Т-клеток и продукцией аутоантител к антигенам гепатоцитов.
Список лекарств, вызывающих при определенных условиях поражение печени, весьма велик. Рассматривают два основных механизма повреждения печени: прямое и непрямое патологическое воздействие.
На реакцию лекарственной гепатотоксичности влияют пол, возраст, ожирение, злоупотребление алкоголем, дефицит белка в пищевом рационе. К поражению предрасполагает прием одновременно нескольких лекарств (полипрогмазия), частые повторные курсы такого лечения.
Алкоголь вызывает разнообразные повреждения печени: острый и хронический гепатит, жировую дистрофию печени, фиброз и цирроз печени. Характер поражения во многом зависит от дозы и длительности алкоголизации.
Отечественные морфологи и клиницисты убедительно показали механизмы хронизации гепатита при хронической алкогольной интоксикации. Алкоголь и особенно его метаболит ацетальдегид оказывают гепатотокси-ческий эффект, разрушая клеточные мембраны гепатоцитов, повреждая микротрубочки цитоскелета и запуская процесс перекисного окисления липидов. Ацетальдегид также может образовывать комплексы с белками клеток печени (неоантигены) и нарушать репаративные процессы в ядре.
Гистологическая оценка любого ХГеп основывается на определении выраженности некроза и воспаления. Наибольшее распространение получила градация с использованием индекса гистологической активности по Кноделю. Портальное воспаление оценивается от 0 до 4 баллов, внутрй-дольковая дегенерация и очаговые некрозы — 0—4 балла, перипортальные некрозы, мостовидные некрозы — от 0 до 10 баллов. Высокой активности соответствуют 13—18 баллов, минимальной — 1—3. Степени активности заменили ранее используемые понятия «ХАГеп», «ХПГеп», «ХЛГеп». При этом портальное воспаление и внутридольковая дегенерация соответствуют морфологии ХПГеп, очаговые некрозы — ХЛГеп, а перипортальные и мостовидные некрозы — морфологии ХАГеп.
Патогенез. Возбудитель ХГеп HBV — крупный ДНК-содержащий вирус. На наружной его поверхности находится поверхностный антиген —'
338
ugsAg, ядерными антигенами являются HBcAg и HBeAg. Ядро вируса содержит ДНК HBV (HBV-DNA) и ДНК-полимеразу (DNA-P). Все эти вирусные компоненты и антитела к его антигенам являются специфическими Маркерами данной инфекции.
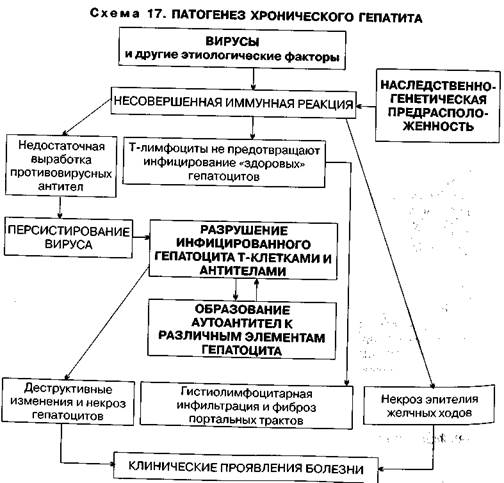
В своем развитии HBV проходит две фазы: фазу репликации и фазу интеграции. В фазе репликации геном вируса и клетки автономны (в эту фазу возможна полная элиминация вируса из организма). Повреждение гепатоцитов обусловлено не самим вирусом, а иммунокомпетентными клетками, распознающими его антигены. HBcAg и HBeAg обладают сильными имму-ногенными свойствами, a HBsAg — слабыми иммуногенными свойствами.
В фазе репликации HBV, когда синтезируется HBcAg и HBeAg, сила иммунных реакций достаточно высока, в результате чего некротизируются
гепатоииты.
В фазе интеграции HBV происходит встраивание генома вируса в область клеточного генома (элиминация вируса в эту фазу невозможна). В большинстве случаев формируется состояние иммунологической толерантности к HBsAg, что приводит к купированию активности процесса (в ряде случаев может происходить регресс хронического гепатита вплоть до формирования «здорового» носительства HBsAg).
ХВГепВ не всегда предшествует распознаваемая острая форма гепатита В. Хронизация зависит от продолжающейся репликации вируса и состояния иммунной системы больного. HBV не оказывает прямого повреждающего действия на гепатоцит, и лизис инфицированных гепатоцитов является следствием иммунного ответа больного.
Нарушение гуморального и клеточного иммунитета определяет исход
гепатита В.
У пациентов с ХВГепВ наблюдается неполноценный клеточно-опосре-дованный иммунный ответ на вирусную инфекцию. В случае, если ответ слишком слабый, то иммунное поражение гепатоцитов или отсутствует, или весьма незначительное, но при этом продолжается репликация вируса на фоне нормально функционирующей печени. Как правило, это здоровые носители HBV. У больных с выраженным клеточно-опосредованным иммунным ответом происходит некроз гепатоцитов, но при этом ответ недостаточен для полной элиминации вируса и развивается ХВГепВ. Недостаточность ответа связана с цитотоксическими лимфоцитами, дефектом регуляции Т-супрессоров, наличием блокирующих антител на мембране гепатоцитов.
Вирус гепатита С, как полагают, вызывает прямое цитотоксическое действие: существует корреляция между тяжестью заболевания и уровнем виремии. Иммунный ответ на HCV слабый.
Длительное сохранение (персистирование) вируса в организме больного объясняется недостаточной иммунной реакцией в ответ на появление антигенов вируса в организме (вероятно, имеется недостаточная продукция противовирусных антител). Даже отсутствие антител к HCV в ряде случаев не исключает диагноз ХГеп, вызванного вирусом С. В целом антитела к HCV образуются медленно, что занимает в среднем 20 нед от момента инфицирования. У некоторых больных для образования антител требуется около года.
Кроме того, вирус, повреждая мембрану гепатоцита, высвобождает мембранный липопротеид, входящий в структуру специфического печеночного антигена. Этот антиген, воздействуя на Т-лимфоциты, приводит к образованию «агрессивных» форм этих клеток. Однако эти клетки функционально Неполноценны, и «атака» ими гепатоцитов, ставших для организма чужерод-
339

|
| 340 |
ными (вследствие воздействия на них вируса), хотя и приводит к гибели последних, но не обеспечивает полной элиминации вируса из организма.
Под воздействием самых различных патогенных факторов гепатоццт приобретает новые антигенные детерминанты (становится аутоантиген-ным), что обусловливает ответную реакцию иммунной системы в виде продукции аутоантител. Имеющийся генетический дефект иммунной системы («слабость» Т-супрессоров) обусловливает неконтролируемую продукцию аутоантител, реакция антиген—антитело на поверхности гепатоцитов вызывает их гибель, формирующиеся иммунные комплексы (вначале циркулирующие, а затем фиксированные в микроциркуляторном русле) обусловливает наряду с поражением гепатоцитов вовлечение в патологический процесс других органов и систем.
Гуморальные и клеточные иммунные реакции и поражение гепатоцитов обусловливают морфологические признаки ХГеп — гистиолимфоцитарную инфильтрацию портальных трактов, дистрофические и некротические изменения гепатоцитов и эпителия желчных ходов.
Патогенез ХГеп представлен на схеме 17.
Клиническая картина. Проявления ХГеп весьма разнообразны и зависят оТ этиологии, степени активности и хронизаиии, функционального состояния печени.
Клиническая картина включает в себя следующие клинико-лаборатор-
нЫе синдромы:
• болевой,
• цитолитический,
___ [• печеночно-клеточной недостаточности,
• иммуновоспалительный,
• холестатический,
• астенический,
• диспепсический.
Боли при ХГеп возникают при увеличении объема печени и растяжении фиброзной капсулы; этот вариант болей не зависит от характера пищи и чаше всего ощущается больными как тяжесть в правом подреберье.
Боли также могут возникать при развитии очагов некроза вблизи крупных сосудов, желчных протоков и фиброзной капсулы; они сопровождаются желтухой, повышением температуры тела и активности трансаминаз в
сыворотке крови.
Цитолитический синдром неотделим от синдрома печеночно-клеточной недостаточности и является следствием гибели (лизиса) гепатоцитов или их дистрофии, что сопровождается нарушением функции печеночных клеток, нарушением проницаемости клеточных мембран. В кровь поступают продукты гибели клеток, что клинически проявляется снижением ряда функций печени; клинические признаки — желтуха, повышение температуры, снижение массы тела. Снижение способности печени деградировать эстрогены и вазоактивные вещества приводит к повышению их концентрации в крови; появляются телеангиэктазии на коже груди и плечевого пояса, печеночные ладони — пятнистая эритема тенара и гипотенара ладоней, гинекомастия и женский тип оволосения у мужчин, происходит изменение ногтей («белые» ногти), появляется красный «лакированный печеночный» язык. Лабораторные признаки синдрома: повышение активности в крови индикаторных ферментов: аланиновой аминотрансферазы (АЛТ), аспараги-новой аминотрансферазы (ACT), лактатдегидрогеназы (ЛДГ) общей и «печеночных» фракций ЛДГ — ЛДГ-4 и ЛДГ-5. Повышается активность специфических печеночных ферментов: сорбитдегидрогеназы, альдолазы, фруктозо-1-фосфатальдолазы, а также содержание прямой и непрямой Фракции билирубина. Возрастает концентрация витамина В12 и железа.
Снижение синтетической функции печени приводит к падению концентрации в сыворотке крови альбуминов, холестерина, фермента холинэсте-разы, протромбина, V и VIII факторов свертывания крови (геморрагии). Снижение превращения в печени токсичных продуктов (аммиака, фенолов и Др.) в нетоксичные сопровождается интоксикацией, появлением «печеночного» запаха. Печеночная недостаточность с умеренными лабораторными проявлениями определяется как «малая печеночная недостаточность».
Иммуновоспалительный (мезенхималъно-воспалителъный) синдром клинически проявляется лихорадкой, артралгиями, васкулитами с локализацией в коже, легких, почках, кишечнике, лимфаденопатией, спленомегалией. Лабораторными проявлениями являются: а) повышение уровня у-глобули-н°в, а,-глобулинов, уровня иммуноглобулинов класса G, М, А, гиперпро-теинемией, появлением патологических результатов «осадочных» проб; ") обнаружение в крови антител к гладкомышечным клеткам, митохондриям, ДНК, появление LE-клеток; в) снижение титра комплемента.
341
 Холестатический синдром обусловлен внутрипеченочным холестазом ц повышением концентрации в крови и накоплением в тканях компонентов желчи. Клинические признаки синдрома: а) кожный зуд, от слабого до упорного, нестерпимого; б) желтуха; в) бурая пигментация кожи; г) ксантелазмы и ксантомы. Потемнение мочи и посветление кала для внутрипеченочного холестаза нехарактерно. Лабораторные признаки: 1) повышение в крови активности экскреторных ферментов: щелочной фосфатазы, у-глютамилтранс-пептидазы, 5-нуклеотидазы, 2) повышение в сыворотке крови содержания холестерина, (3-липопротеинов, фосфолипидов, желчных кислот.
Холестатический синдром обусловлен внутрипеченочным холестазом ц повышением концентрации в крови и накоплением в тканях компонентов желчи. Клинические признаки синдрома: а) кожный зуд, от слабого до упорного, нестерпимого; б) желтуха; в) бурая пигментация кожи; г) ксантелазмы и ксантомы. Потемнение мочи и посветление кала для внутрипеченочного холестаза нехарактерно. Лабораторные признаки: 1) повышение в крови активности экскреторных ферментов: щелочной фосфатазы, у-глютамилтранс-пептидазы, 5-нуклеотидазы, 2) повышение в сыворотке крови содержания холестерина, (3-липопротеинов, фосфолипидов, желчных кислот.
Астенический синдром отражает степень снижения функции печени и интоксикации. Клинические проявления: слабость, утомляемость (от ограничения физической нагрузки до невозможности самообслуживания), снижение настроения, апатия, ипохондрия.
Диспепсический синдром обусловлен снижением желчесинтетической функции печени, интоксикацией и проявляется кишечной диспепсией (бродильной, гнилостной) и дисмоторной желудочной диспепсией (тошнота, рвота, снижение аппетита, анорексия).
В связи с имеющимися возможностями в настоящее время проведение этиотропной терапии в диагностике важнейшей задачей является этиологическая верификация хронического гепатита.
Клинические проявления хронического вирусного гепатита В зависят от уровня репликации вируса. Высокий уровень репликации HBV отмечается у 20—30 % всех больных ХВГеп В.
Высокий уровень репликации сопровождается яркой клинической картиной с четко выраженными клинико-лабораторными синдромами: астеническим, диспепсическим, цитолитическим с проявлениями «малой печеночной недостаточности». Иммуновоспалительный синдром отражает реакцию на инфекцию HBV.
Больные ХВГеп В в период репликации (в активной фазе гепатита) предъявляют жалобы на общую слабость, легко возникающую утомляемость, их беспокоят неопределенные боли в правом подреберье и верхней половине живота. Внимательный расспрос выявляет снижение аппетита, плохую переносимость жирной пищи, алкоголя. Эти диспепсические расстройства обычно выражены незначительно.
В период репликации повышается температура тела до субфебрильных цифр, появляются нерезко выраженные боли в суставах и мышцах («ревматические» жалобы), головная боль.
На I этапе диагностического поиска можно выявить связь настоящего заболевания с перенесенным ранее острым вирусным гепатитом. У незначительной части пациентов ХВГеп В может манифестировать непосредственно после острого гепатита. У значительной части заболевших такую связь установить не удается. Важно выявление «факторов риска»: гемо-трансфузии, вливания компонентов крови, частые инъекции, прививки, операции, контакт с инфекционными больными, работа с кровью.
Примерно у '/3 от общего числа больных ХВГеп В начинается как острый процесс с желудочно-кишечными симптомами, артралгиями и даже с лихорадкой и желтухой. Заболевание остается клинически выраженным JXO периода нормализации активности трансаминаз и снижения репликации вируса до низкого уровня.
У 2/з заболевание начинется незаметно с разнообразной, неопределенной и малозначительной, по мнению больных, симптоматики. В анамнезе иногда можно выявить причину обострения: прием глюкокортикостерой-дов, инсоляцию, возможна спонтанная реактивация вируса.
342
ХВГеп В часто протекает как «немая» болезнь, клинические симптомы нередко не имеют прямой корреляции с тяжестью поражения печени, поэтому жалобы могут отсутствовать.
На II этапе диагностического поиска можно выявить гепатомегалию, спленомегалию. Печень умеренно плотная, край заострен, чувствителен 0ЛИ даже болезнен при пальпации. Увеличение селезенки незначительное. Гепатоспленомегалия выявляется у у4— 'А больных, в 70 % случаев на ц этапе диагностического поиска не обнаруживается каких-либо отклонений от нормы. Клинические признаки печеночно-клеточной недостаточности не выявляются.
Решающее значение для постановки диагноза ХВГеп В имеет III этап диагностического поиска. Данные этого этапа позволяют: а) подтвердить этиологию; б) определить уровень репликации вируса; в) определить степень активности процесса; г) выявить характер морфологических изменений в печени; д) определить состояние других органов и систем, что является важным для решения вопроса о противовирусной терапии.
При клиническом анализе крови у больных ХВГеп В отклонений от физиологической нормы обычно не наблюдается.
Биохимические и вирусологические исследования могут оказать существенную помощь.
Повышение активности АЛТ и ACT наблюдается у всех больных; степень повышения коррелирует с уровнем репликации вируса. Гиперфермен-темия не бывает высокой. Электрофорез белков сыворотки выявляет умеренное повышение содержания у-глобулинов. Иногда обнаруживают антитела к гладкой мускулатуре, правда, в низких титрах. Уровень билирубина отражает степень цитолиза.
Для определения маркеров ХВГеп применяют радиоиммунные и иммуно-ферментные методы. Маркером ХВГеп В в клинических условиях является HBsAg. Для фазы репликации, когда контагиозность высокая, характерно появление в крови HBeAg, HBV-ДНК, ДНК-полимеразы. Для фазы интеграции, когда контагиозность низкая, характерно выявление антиНВе. Обнаружение в крови HBsAg и HBeAg свидетельствует об активном вирусном гепатите. Тест на HBV-ДНК может быть положительным даже при появлении антиНВе. При переходе из HBeAg-положительного статуса в HBeAg-отрицательный может наблюдаться обострение ХВГеп В с повышением активности АЛТ, ACT и морфологической картиной лобулярного гепатита. Сероконверсия может быть спонтанной или произойти при противовирусной терапии. Возможна спонтанная реактивация вируса при HBeAg-отри-Цательном статусе. Реактивация диагностируется по появлению в крови антиНВс-IgM.
Вирусологические исследования позволяют выявить суперинфицирование HDV, а также HAV и HCV. Все это сопровождается серьезным прогресси-рованием ХВГ В.
Диагностическая значимость радионуклидных исследований при ХВГ В невелика; эти методы, как правило, не используют.
УЗИ позволяет определить размеры печени, селезенки, диаметр и состояние сосудистой и протоковой системы, но для постановки диагноза ХВГеп В большого значения не имеет.
Пункционная биопсия печени позволяет поставить морфологический ди-агНоз. Проведение пункционной биопсии печени и гистологическое исследование биоптата позволяет уточнить этиологию гепатопатии, определить степень активности воспаления, фиброза, выявить начальные признаки Цирроза печени и объективно оценить результаты лечения.
343
К постоянным дифференциально-диагностическим признакам ХВГеп В относят наличие HBsAg в виде матово-стекловидных гепатоцитов, а также обнаружение HBeAg с помощью иммунопероксидазной реакции («песочные» ядра).
Многие больные ХВГеп В сохраняют стабильное компенсированное состояние. Прогноз зависит от морфологических изменений в печени. Пожилой возраст, наличие мостовидных некрозов, персистирование в сыворотке HBV-ДНК, суперинфекция HDV и HCV указывают на неблагоприятный прогноз.
Хронический вирусный гепатит С — вялотекущее заболевание, характеризующееся скудной клинической картиной.
На I этапе диагностического поиска выясняется, что в клинической картине преобладает астенический синдром — больные жалуются на небольшую слабость, плохое самочувствие, снижение трудоспособности. Диспепсические симптомы не обусловлены самим ХВГеп С, а являются следствием сопутствующих заболеваний. Значительная часть больных жалоб не предъявляют, у них болезнь протекает совершенно бессимптомно, диагноз можно заподозрить при скрининговом исследовании на антиНСУ.
В анамнезе могут быть выявлены факторы риска: гемотрансфузии (HCV является причиной более чем 90 % посттрансфузионного гепатита), внутривенное введение наркотиков, гомосексуализм. Факторы риска отсутствуют или больные их скрывают. Острый вирусный гепатит обычно остается нераспознанным, отсутствуют и клинические признаки, позволяющие заподозрить и прогнозировать хронизацию гепатита. У 60—80 % больных, перенесших острый вирусный гепатит С, развивается хронический гепатит. Если пациент наблюдался в медицинском учереждении и имеются результаты биохимических и вирусологических исследований, то можно выявить, что заболевание протекало медленно, при этом эпизоды гипертрансамина-земии чередовались с нормальной активностью ферментов в сыворотке крови, гиперферментемия, как правило, отражает пики виремии.
На II этапе диагностического поиска при ХВГеп С физикальное исследование позволяет обнаружить умеренное увеличение и уплотнение печени с заострением печеночного края. Реже определяют незначительное увеличение селезенки. Желтуха, как правило, отсутствует. Кожные внепеченоч-ные знаки, а также проявления геморрагического синдрома отсутствуют. Наиболее важен III этап диагностического поиска. Для ХВГеп С характерны колебания активности АЛТ, ACT в крови. Лабораторные показатели холестаза, иммуновоспалительного синдрома, уровня билирубина, у-глобу-линов, альбумина не изменяются.
Важнейшим этапом исследования является определение антител к HCV и РНК HCV. Более чем у 90 % больных ХВГеп С тест на антиНСУ оказывается положительным. Показателем репликации HCV является наличие РНК HCV в сыворотке.
При решении вопроса о проведении противовирусной терапии необходимо определение генотипа HCV. Это связано с тем, что генотип в значительной мере определяет успешность лечения интерфероном. Генотип вируса 1в связывают с более тяжелым течением, плохим ответом на противовирусное лечение и возможностью гепатоцеллюлярной карциномы. Для генотипа 4 характерна резистентность к противовирусной терапии.
Важным фактором для решения вопроса о начале терапии и ее эффективности является определение степени виремии. Из изложенного вытекает, что характерных клинических признаков ХВГеп С не существует, в связи с чем важнейшее место в диагностике имеет пункционная биопсия. ЪАА
При наличии в крови РНК HCV гистологическое исследование биопта-тов печени практически всегда выявляет патологические изменения. Выраженная виремия сопровождается высоким индексом гистологической активности и значительной гиперферментемией.
Гистологическая картина не является нозологически специфичной, но имеет ряд особенностей, к которым относятся жировая дистрофия гепатоцитов, лимфоидные фолликулы, расположенные интралобулярно и в портальных трактах, активация синусоидальных клеток и поражение желчных
протоков.
Хронический аутоиммунный гепатит (ХАИТ) имеет ряд отличительных
особенностей.
• Чрезвычайная выраженность аутоиммунных процессов.
• Высокий индекс гистологической активности (воспаления) — хронический активный гепатит.
• Системный характер аутоиммунного процесса.
Значительное количество синонимов и определений ХАИГ основывается на каком-либо отличительном факторе клинической картины, морфологии, лабораторных исследований.
ХАИГ полностью соответствует основным критериям аутоиммунного заболевания: это невозможность выявления этиологического фактора, значительное увеличение СОЭ, гипер-у-глобулинемия, лимфоплазмоци-тарная инфильтрация печени, дефекты иммунной системы, появление в крови аутоантител, положительный терапевтический эффект глюкокорти-костероидов.
При некоторых заболеваниях печени (ХВГеп С, ХВГеп D, первичный билиарный цирроз) также находят циркулирующие антитела, но только при ХАИГ неизвестной этиологии отмечается более яркая и своеобразная клиническая картина, полностью соответствующая аутоиммунному заболеванию.
Своеобразие ХАИГ, отличие от других хронических гепатитов состоит в
следующем:
• системный характер аутоиммунного процесса реализуется в разнообразных внепеченочных проявлениях (артралгии, пурпура, нодозная эритема, легочные инфильтраты, плевриты, волчаночноподобный нефрит, гемолитическая анемия);
• ХАИГ протекает одновременно с другими аутоимунными заболеваниями — тиреоидитом Хасимото, сахарным диабетом, неспецифическим язвенным колитом;
• основные клинико-лабораторные синдромы, наблюдаемые при хронических заболеваниях печени (цитолитический, печеночно-клеточная недостаточность, иммуновоспалительный и др.) имеют высокую степень выраженности.
ХАИГ возникает чаще у женщин, первый пик заболеваемости приходится на возраст 10—30 лет, второй пик — на период менопаузы; I этап Диагностического поиска дает важную информацию о дебюте болезни и ее течении, жалобы больных зависят от варианта начала ХАИГ и темпа про-грессирования болезни.
• Около 10 % пациентов заболевают внезапно — развивается симпто
матика, трудно отличимая от острого вирусного гепатита. Быстро нараста
ет слабость, диспепсические явления, анорексия, появляется желтуха,
темнеет моча, обесцвечивается кал, повышается содержание билирубина в
сыворотке крови, наблюдается очень высокая активность ферментов. Боль
ных госпитализируют в инфекционный стационар, где отмечают отсутст-
■\А^
| В виоптате печени при ХАИГ ^^^^^SSS^S^- ^и интенсивной инфильтрацией преимуществанн биопсии Утками, фиброз печени. В большинстве СЛ^*™^1£тото типа. Особен- \l\HHui но различна. т «лица 19. Признаки хронического аутоиммунного (ХАИГ) и вирусных 1£тоЦвВ(ХВГРВ)иС(ХВГС) |
вие типичной динамики желтухи и констатируют наличие признаков хро-нического поражения печени.
• Заболевание может начинаться с внепеченочных проявлений и какого-либо аутоиммунного заболевания (гемолитическая анемия, тромбоци-топеническая пурпура, ревматоидный артрит, лимфаденопатиял! др.). При обследовании выявляется преимущественное поражение печени. Если патологию печени рассматривают как реактивный гепатит, больных длительно лечат от СКВ, ревматоидного артрита, васкулита, миокардита.
• У ряда больных наблюдается малозаметное начало гепатита с жалобами на слабость, утомляемость, неопределенные боли в правом подреберье вздутие живота, снижение аппетита, субфебрильную температуру. К правильному диагнозу приводит выявление гепатоспленомегалии, внепеченочных знаков, повышения уровня билирубина, АЛТ, ACT, у-глобулинов.
Важным моментом I этапа является исключение злоупотребления алкоголем, наркомании, чрезмерного приема лекарств, контактов с кровью, а также оценка проводившегося ранее лечения.
Результаты II этапа диагностического поиска зависят от характера поражения печени (активность воспаления, степень фиброза) и вовлечения в патологический процесс других органов.
На II этапе диагностического поиска подтверждается, что для ХАИГ особенно характерно сочетание признаков тяжелого поражения печени и аномалий иммунной системы. Часто видны кожные внепеченочные знаки — яркие, крупные сосудистые звездочки на лице, в области шеи, на груди, яркая пальмарная эритема. Желтуха часто носит эпизодический характер. Наблюдают кровоточивость десен, легко возникающие кровоподтеки. Выявляются признаки, обусловленные эндокринными изменениями — синевато-багровые стрии на коже бедер, живота. Лицо может иметь ку-шингоидный вид даже без приема глюкокортикостероидов, также наблюдаются угри, гирсутизм. Развитие аутоиммунного тиреоидита может сопровождаться симптомами тиреотоксикоза или гипотиреоза. Обнаруживаются изменения кожи, являющиеся следствием васкулита — аллергический ка-пиллярит, узловатая эритема, «бабочка» на лице.
Несмотря на частые артралгии, визуально суставы изменены незначительно — дефигурация обратима и обусловлена периартикулярным отеком. В процесс вовлекаются преимущественно крупные суставы нижних и верхних конечностей. Лимфаденопатия обычно генерализованная и часто сочетается с умеренной спленомегалией (без портальной гипертензии).
Физикальное исследование уже на ранних стадиях определяет увеличение печени, заостренный, умеренно плотный край ее выступает на 4—5 см, край и поверхность органа могут быть неровными. Появление асцита свидетельствует о циррозе печени.
На III этапе диагностического поиска окончательно решается диагноз.
Клинический анализ крови демонстрирует резкое увеличение СОЭ (до 40—50—60 мм/ч). Лейкопения и тромбоцитопения наблюдаются часто и не обусловлены гиперспленизмом. Как правило, наблюдается незначительная нормохромная анемия.
Биохимические исследования свидетельствуют о выраженности цитолити-ческого и иммуновоспалительного синдромов. Активность АЛТ и ACT в сыворотке кроЕи очень высокая и нередко в 10 раз превышает норму; уровень билирубина повышен, преимущественно за счет прямой и частично непрямой фракций и составляет 2—10 мг% (34—170 ммоль/л). Электрофорез белков сыворотки выявляет повышение уровня у-глобулинов более чем в 2 раза.
| Признак | ХАИГ | ХВГеп В | ХВГеп С |
| 1реобладающий пол ' | >Ке некий | Мужской | эез преобладания |
| Преимущественный воз- | 15—25 лет, период менопаузы | Все возрастные группы | |
| ист HBsAg | Отсутствует | Выявляется | Отсутствует |
| » | Отсутствуют | Присутствуют | |
| iCVAb Внепеченочные проявле- | Характерны | Могут быть | Отсутствуют |
| ния Принадлежность к «груп- | Отсутствует | Высокая | Очень высокая |
| пам риска» Клиническое течение | Быстро прогрессирующее | Манифестное, наличие спонтанных ремиссий | Длительное, слабо манифестное |
| Активность трансаминаз | Высокая (увеличение в 10 раз и более) | Средняя | Низкая |
| Повышение содержания | Значительное | Умеренное | Умеренное или отсутствует |
| ■у-глобулинов Антитела к актину | Определяются в высоком титре | Отсутствует | Отсутствуют |
| Антинуклеарные антитела Развитие гепатоцеллюляр- | То же Риск низкий | » Риск высокий | Риск высокий |
| ной карциномы Эффективность приема | Выражена | Плохая | Плохая |
| глюкокортикостероидов |
Хронический алкогольный гепатит 0^)^^^^^^ ным гепатитом, жировой дистрофией печени и ^ррозом.печени локальным проявлением системного воздействия алкоголя на ор
Циническая картина ХалГеп с™™™^^П^^^^"
торных проявлений алкоголизации (часто ^K°rJf™c " С™вом подре-
жения печени. Больные предъявляют жмобы "^^^^а^рии тошно -
берье постоянного характера, чувство ^еио^^\1ох^ш^яосяиостъ
ту, снижение аппетита, вздутие живота после еды плохую^™ ь_
жирной пиши. Диспепсические^^^но^об^^ыал^ ^ ным хроническим гастритом и панкреатитом, у сутствуют.
При проведении I этапа диагностического поиска следует помнить, что пациенты могут скрывать злоупотребление алкоголем, поэтому очень ва-жен так называемый объективный алкогольный анамнез, т.е. сведения, полученные от родственников.
На II этапе диагностичесого поиска выявляют как стигматы алкоголизма, так и признаки поражения печени. К первым относятся контрактура Дюпюитрена, гипертрофия околоушных слюнных желез, полинейропатия с парестезиями, нарушениями чувствительности в области конечностей Следует обратить внимание на одутловатость и гиперемию лица, гипергидроз, тахикардию, измененное поведение — эйфорию, фамильярность или депрессию. У мужчин часто наблюдается гиперэстрогенемия (женский тип оволосения, пальмарная эритема, гинекомастия) при отсутствии цирроза печени.
При объективном физическом обследовании в 80—100 % случаев удается обнаружить гепатомегалию; спленомегалия выявляется редко (около 15 % пациентов). Пальпация позволяет выявить заболевания желудка, поджелудочной железы, кишечника.
На III этапе диагностического поиска можно уточнить этиологию и определить характер поражения печени. Биохимическими маркерами алкоголизма являются увеличение активности у-глутаминтранспептидазы, высокие уровень IgA и активность ACT, превышающая уровень АЛТ, при этом ACT обычно превышает АЛТ в 2 раза. ХалГеп протекает с умеренным повышением активности трансаминаз.
В клиническом анализе крови выявляется макроцитоз. В отличие от других хронических гепатитов при ХАлГ наблюдается лейкоцитоз.
ХАлГ протекает с нарушением липидного обмена: повышено содержание в крови холестерина и триглицеридов.
Биопсия печени подтверждает этиологию, определяет морфологический статус печени. Для алкогольного гепатита характерны резко выраженная жировая дистрофия, мелкие очаги некроза, значительный фиброз, наличие в гепатоцитах алкогольного гиалина.
Хронический холестатический гепатит (ХХГ) — полиэтиологический вариант хронического гепатита с внутрипеченочным холестазом, т.е. уменьшением или прекращением тока желчи вследствие нарушения экскреторной способности гепатоцитов или поражения холангиол. Внутрипе-ченочный холестаз сопровождается регургитацией составных компонентов желчи в кровотоке.
В Международной классификации ХХГ не выделен. При этом гистологическая картина ХХГ заметно отличается от картины, характерной для хронических гепатитов. К основным морфологическим признакам внутри-печеночного (гепатоцитарного) холестаза относятся: а) накопление зерен желчных пигментов в гепатоцитах у билиарного полюса клетки; б) укрупнение гранул пигмента и появление их в желчных капиллярах; в) концентрация желчи в расширенных желчных капиллярах в виде сгустков (желчные тромбы).
Клиническая картина ХХГ отличается выраженностью синдрома холестаза.
На I этапе диагностического поиска выявляют основной клинический симптом холестаза — кожный зуд (наблюдается у всех больных). Он не купируется симптоматическими препаратами, носит мучительный характер, является нередко причиной бессонницы и депрессии; зуд часто за месяцы и даже годы предшествует желтухе, заставляя длительно лечиться у дерматолога. Желтуха может развиваться медленно, не сопровождается похудением. 348
При длительном холестазе возможно появление жалоб, связанных с на-пуииением всасывания в кишечнике жирорастворимых витаминов A, D, Е, ^(расстройство сумеречного зрения, кровоточивость десен и кожи, боли в Гостях и пр.). На этом же этапе имеется возможность уточнить этиологические факторы: а) длительный прием лекарственных препаратов — аминазина, сульфаниламидных, противодиабетических, а также диуретиков, антибиотиков, контрацептивов и др., вызывающих аллергический холестаз; а также метилтестостерона, анаболических стероидов, вызывающих простой неаллергический холестаз, непереносимость их; б) токсическое воздействие (алкоголь, ядохимикаты и прочие токсичные вещества); в) вирусный гепа-ТЙТ; г) эндокринные изменения (прием гормональных препаратов, перо-рал'ьных контрацептивов, эндокринные заболевания). Последние 4 мес беременности могут протекать с холестазом.
В ряде случаев этиология может быть неизвестной (так называемый идиопатический холестаз). Это не исключает предположения о первичном холестазе. Тщательно выясняют наличие заболеваний, которые могли бы привести к вторичному холестазу, возникающему при обструкции внепече-ночных желчных путей (желчнокаменная болезнь, опухоли гепатобилиар-ной системы, хронический панкреатит и др.). В таких случаях диагноз ХХГ становится маловероятным. На последующих этапах производят уточняющие исследования.
На II этапе диагностического поиска выявляют другие проявления холестаза: желтуху, пигментацию кожи (чаще генерализованную), ксантелаз-мы и ксантомы (приподнятые, светло-желтые, узловатые мягкие образования — отложения липидов в коже). Обнаруживают расчесы кожи.
«Печеночные ладони», сосудистые звездочки не характерны для ХХГ: единичные внепеченочные знаки встречаются у небольшого числа больных.
Печень увеличена незначительно, плотная, с гладким краем. У части больных наблюдается незначительное увеличение селезенки (в фазе обострения).
Наибольшее значение в диагностике имеет III этап диагностического поиска. При подозрении на вторичный холестаз основными в диагностике становятся инструментальные методы исследования, позволяющие отвергнуть (или установить) существование причин, приводящих к внепеченоч-ному холестазу.
Биохимическое исследование крови выявляет: а) повышение активности Щелочной фосфатазы, у-глутаматтранспептидазы; б) гиперхолестеринемию, повышение уровня фосфолипидов, [3-липопротеидов, желчных кислот; в) гипербилирубинемию (в основном за счет связанного билирубина); в моче уменьшенное содержание уробилина, могут встретиться желчные пигменты; в крови как проявление поражения гепатоцитов — умеренное повышение уровня аминотрансфераз.
Иммунологическое исследование крови позволяет обнаружить митохонд-РИальные антитела, которые являются характерным серологическим маркером внутрипеченочного холестаза.
Биохимические и ферментативные тесты дифференциально-диагностического значения в разграничении внепеченочного и внутрипеченочного холестаза не имеют. Основная роль принадлежит инструментальным методам.
Всем больным с желтухой неясного происхождения прежде всего необходимо проводить эхографию печени, желчного пузыря и поджелудочной же лезы для исключения патологических изменений в этих органах, которые Могут послужить причиной внепеченочного холестаза.
349
УЗИ — наиболее применяемый и важный метод диагностики. Расширение внутрипеченочных желчных протоков свидетельствует об обструкции крупного протока (вторичный, подпеченочный холестаз). УЗИ не позволяет уточнить состояние дистального отдела желчных путей, поэтому в плац обследования при вторичном холестазе включают компьютерную томогра фию, магнитно-резонансную томографию.
Ретроградная панкреатохолангиография или чрескожная гепатохолегра- фия. Эти методы позволяют установить уровень обтурации желчных протоков. Разрешающая способность сцинтиграфии желчных путей с радиофармпрепаратами уступает другим методам визуализации.
При нерасширенных желчных протоках для уточнения характера процесса производят пункционную биопсию печени или лапароскопию с биопсией. Следует отметить, что прижизненное морфологическое исследование печени имеет второстепенное значение для диагностики холестаза, поскольку констатируемые при световой микроскопии изменения (накопление компонентов желчи в гепатоцитах и желчных ходах и т.д.) появляются значительно позже биохимических и клинических признаков.
Кроме того, пункционная биопсия печени противопоказана при наклонности к кровоточивости, что нередко отмечается у больных с холе-стазом.
Исключение причин внепеченочного холестаза является достаточным для диагностики первичного внутрипеченочного холестаза.
Диагностика хронического гепатита. Основным фактором диагностики ХГеп являются результаты морфологического изучения биоптата.
Важные данные гистологического исследования должны дополняться другими характеристиками, т.е. необходимо учитывать клиническую картину заболевания, показатели лабораторных исследований (гематологические, биохимические, вирусологические).
Критерии диагноза ХГеп:
• дистрофические изменения и некроз гепатоцитов, воспалительные инфильтраты портальных трактов, фиброз без нарушения дольковой структуры (архитектоники) печени;
• лабораторные проявления цитолитического, иммуновоспалительного и холестатического синдрома;
• гепатомегалия, спленомегалия, «внепеченочные» знаки;
• подтвержденные этиологические факторы (HBV, HCV, высокая концентрация антител к гладкой мускулатуре, ДНК, к митохондриям печени и почек.
Формулировка развернутого клинического диагноза учитывает:
• этиологическую характеристику;
• индекс гистологической активности;
• гистологическую оценку степени фиброза;
• клиническую активность.
Лечение. Лечебные мероприятия при ХГеп направлены на: 1) ликвидацию воздействия этиологического фактора; 2) снижение активности
воспалительного процесса; 3) улучшение функционального состояния печени.
Все лечебные воздействия преследуют главную цель — предотвратить развитие цирроза печени и гепатоцеллюлярной карциномы.
| 350 |
Характер проводимой терапии зависит от: 1) этиологии; 2) варианта течения и результатов предшествующей терапии; 3) гистологической и клинической активности; 4) преобладания каких-либо клинико-биохимиче-ских синдромов; 5) сопутствующих заболеваний.
Больным ХГеп противопоказаны вакцинации, инсоляция, какое-либо дивное физиотерапевтическое лечение, тяжелая физическая нагрузка. рледует избегать переохлаждения, перегревания. Необходимо полностью исключить употребление алкоголя.
Режим физической нагрузки определяется степенью клинико-биохими-есКой и гистологической активности. Постельный режим показан при выпаженном цитолитическом и иммуновоспалительном синдроме.
В России при хроническом гепатите принято назначать диету № 5, суточный рацион которой содержит белков 100 г, жиров 80 г, углеводов 450—600 г, что составляет 3000—3500 ккал. Исключаются жирные сорта мяса, острые блюда, соленые, копченые и жареные продукты.
Лечение хронического гепатита В включает использование противовирусных интерферонов и аналогов нуклеотидов. Интерферон-а применяют ежедневно по 5 ME или по 10 ME 3 раза в неделю в виде подкожных инъекций. Курс лечения составляет 4—6 мес.
Применяют также пег-интерферон-а-2а — препарат интерферона пролонгированного действия, инъекции проводят 1 раз в неделю.
Из антивирусных лекарственных средств используют ламивудин по 100 мг/сут не менее 12 мес.
К прогностическим факторам хорошего ответа на терапию интерфероном относят высокую активность АЛТ, низкую виремию, высокий индекс гистологической активности, женский пол, небольшую длительность болезни (менее 5 лет). Отсутствие суперинфекции HCV, HDV, ВИЧ. Хороший ответ на терапию при этом (исчезновение HBeAg и HBV-ДНК, уменьшение воспаления и гепатоцеллюлярного некроза) приближается к 50 %.
Терапия интерфероном обычно сопровождается значительным количеством побочных эффектов. Это гриппоподобный синдром, миалгии, головная боль, уменьшение массы тела, миелосупрессия, диарея, алопеция, тревожность, депрессия.
Лечение хронического гепатита С представляет комбинацию ос-интерфе-рона и рибавирина. Дозы препаратов зависят от генотипа и массы тела больного. Возможно включение в терапию третьего противовирусного препарата — ремантадина. При типе 1в назначают а-интерферон по 3 ME 3 раза в неделю в течение 12 мес, при других типах — в течение 6 мес. Рибавирин назначают по 600—1200 мг/сут.
Цель противовирусной терапии ХВГ:
• Элиминация или прекращение репликации вируса.
• Купирование или уменьшение степени активности воспаления.
• Предупреждение прогрессирования гепатита с развитием отдаленных его последствий, включая цирроз печени и печеночно-клеточный рак.
Даже если не происходит полной элиминации вируса, проведение курса лечения приводит к улучшению морфологических проявлений болезни.
Противопоказанием к назначению а-интерферона являются печеноч-Но-клеточная недостаточность, лейкопения, тромбоцитопения, психическая патология.
Эффект лечения проявляется в нормализации показателей АЛТ, исчезновении PHK-HCV из крови и снижении активности процесса в печени, однако результаты лечения все же нельзя назвать удовлетворительными.
Лечение хронического аутоиммунного гепатита. Длительная терапия глюкокортикостероидами продлевает жизнь больным при этом тяжелом заболевании. Обычная начальная доза преднизолона 30—40 мг/сут. Длительность назначения данной дозы определяется динамикой лабораторных показателей и клинических симптомов; при достижении эффекта дозу очень
351

 медленно снижают до 10—15 мг; такое количество препарата необходимо принимать не менее 2—3 лет после наступления ремиссии.
медленно снижают до 10—15 мг; такое количество препарата необходимо принимать не менее 2—3 лет после наступления ремиссии.
При недостаточной эффективности преднизолона, рецидивировании гепатита на фоне уменьшения дозы, а также при развитии осложнений глюкокортикостероидной терапии проводят комбинированное лечение преднизолоном и азатиоприном. К преднизолону (в суточной дозе 30 мг) добавляют азатиоприн в дозе 50 мг; азатиоприн назначают в течение нескольких месяцев и даже 1—2 лет. Монотерапия азатиоприном в настоящее время не проводится. Начинать и отменять иммуносупрессивную терапию следует только в условиях стационара. Длительная иммуносупрессив-ная терапия способствует наступлению ремиссии у большинства больных с ХАИГ.
При хроническом алкогольном гепатите проводят лечение так называемыми гепатопротекторами (средствами, влияющими на обменные процессы в гепатоците, уменьшающими перекисное окисление липидов и стабилизирующими биологические мембраны). Используют эссенциальные фос-фолипиды — эссенциале Н по 6—8 капсул в день в течение 2—3 мес или растительные флавоноиды — силимар, хофитол по 6—9 таблеток в сутки в течение 2 мес. Применяют также липоевую кислоту или липамид по 0,025—0,05 г 3 раза в день в течение 1 мес.
При холестатическом синдроме, помимо препаратов, воздействующих на обмен печеночных клеток, и средств, оказывающих иммунодепрессив-ное и противовоспалительное действие (при активности процесса), назначают вещества, непосредственно устраняющие синдром внутрипеченочного холестаза. Это препараты урсодеоксихолевой кислоты — урсофальк, его принимают по 250—500 мг на ночь.
Прогноз. Наименее благоприятный прогноз при ХАИГ. При вирусных гепатитах продолжающаяся репликация вируса приводит также к циррозу печени.
Профилактика включает исключение вирусной инфекции (HCV) и вакцинации от гепатита В.
Цирроз печени
ЦИРРОЗ ПЕЧЕНИ (ЦП) — хроническое прогрессирующее диффузное полиэтиологическое заболевание с поражением гепатоцитов, фиброзом и перестройкой архитектоники печени, приводящей к образованию структурно-аномальных регенераторных узлов, портальной гипертензии и развитию печеночной недостаточности.
Цирроз печени — завершающая стадия воспалительно-некротических и дегенеративно-некротических процессов в паренхиме или желчевыводящей системе печени, характеризующихся регенераторной, фибротической и сосудистой перестройкой.
Смертность от ЦП занимает 4—5-е место в структуре общей смертности населения, и ее показатели в разных странах составляют 15—30 на 100 000 населения.
Классификация. В настоящее время рекомендовано использовать клас сификацию, основанную на этиологическом и морфологическом принципах (ВОЗ, 1978).
Различают следующие этиологические факторы ЦП: 1) вирусные (вирусный гепатит В, B+D, С); 2) хроническая алкогольная интоксикация; 3) метаболические нарушения (гемохроматоз, болезнь Вильсона—Конова-
352
лова, недостаточность а,-антитрипсина и др.); 4) длительный внутри- и подпеченочный холестаз; 5) интоксикации, токсические воздействия ле-арСтв; 6) недоедание, белково-витаминный дефицит; 7) нарушение венозного оттока (констриктивный перикардит, веноокклюзионная болезнь, сердечная недостаточность); 8) хронический аутоиммунный гепатит; 9) невыясненные (криптогенный ЦП).
Морфологически выделяют мелкоузловой, крупноузловой и смешанный ЦП-
Для мелкоузлового ЦП характерны мелкие узлы регенерации,
почти одинаковые по размеру, диаметром менее 3 мм, и перегородки (септы) одинаковой ширины. Крупноузловому ЦП свойственны узлы и септы разных размеров, превышающие 3 мм. Узлы часто состоят из многих полек и содержат беспорядочно расположенные портальные тракты. Смешанный ЦП диагностируется, когда количество мелких и крупных узлов приблизительно одинаково.
Мелкоузловой ЦП в основном соответствует портальному ЦП прежних классификаций, крупноузловой — постнекротическому.
По степени функциональных нарушений и портальной гипертензии различают компенсированные и декомпенсированные ЦП.
Этиология. ЦП — полиэтиологическое заболевание. Более половины всех ЦП в Европе связано с хроническим злоупотреблением алкоголем. Количество ЦП вирусной этиологии зависит от региона. До четверти всех ЦП относятся к криптогенным, т.е. этиология неизвестна, однако успехи вирусологии и иммунологии позволяют сокращаться этой группе. Часть криптогенных ЦП, особенно у женщин, является следствием хронического аутоиммунного гепатита, другая — следствием воздействия неизвестного вируса или тщательно скрываемого злоупотребления алкоголем.
Патогенез. Патологической регенерации и деформации дольковой архитектуры печени предшествуют либо мелкоочаговые, либо крупноочаговые некрозы паренхимы, либо прогрессирующее активное фиброзообразо-вание в области деструкции портальных и перипортальных желчных протоков. Некроз гепатоцитов или желчных протоков под воздействием различных этиологических причин — пусковой момент ЦП. Некротический процесс вызывает активную реакцию соединительной ткани, что в свою очередь приводит к некрозу ранее интактных гепатоцитов. Некроз является стимулом регенерации клеток, которая протекает в виде концентрического увеличения сохранившегося участка паренхимы. Упорядоченному регенераторному процессу с восстановлением нормальной структуры дольки мешает образование фиброзных септ в местах некроза. Возникают участки паренхимы, полностью или частично окруженные соединительнотканными прослойками (псевдодольки). Важнейшим условием образования псевдодолек является развитие фиброзных септ между центральными венами и портальными трактами. Часто такие септы образуются на месте мостовидных некрозов. Образование таких септ препятствует восстановлению нормальной структуры. Играют роль и воспалительные инфильтраты, распространяющиеся из портальных полей до центральных зон долек. В рубцующихся зонах нарушается сосудистый и лимфатический аппарат печени. Узлы-регенераты снабжаются кровью преимущественно из печеночной артерии, а ветви воротной вены образуют в септах анастомозы с печеночными вена-Ми, и поэтому портальная кровь недостаточно контактирует с гепатоцита-ми. Развивающаяся фиброзная ткань механически сдавливает венозные сосуды. Эти процессы приводят к нарушению печеночной гемодинамики (портальная гипертензия), затруднению снабжения гепатоцитов порталь-
353
ной кровью и развитию внутрипеченочного окольного кровоснабжения. Эти процессы, способствуя нарушению печеночной гемодинамики и развитию портальной гипертензии, приводят к повторным некрозам, замыкая порочный круг: «некроз — воспаление — неофибриллогенез — нарушение кровоснабжения гепатоцитов—некроз». В развитии портальной гипертензии наибольшее значение имеет сдавление разветвлений воротной вены узлами регенерирующих гепатоцитов или разросшейся фиброзной тканью. Уменьшение количества гепатоцитов и внутрипеченочный шунтовой кровоток снижают функциональную способность печени и обусловливают эн-дотоксемию, бактериемию.
Портальная гипертензия является причиной развития портокавального шунтирования, асцита и спленомегалии.
Между бассейном воротной вены и системным венозным кровотоком развиваются коллатерали (портокавальные анастомозы) при повышении давления в воротной вене до 25—30 мм рт. ст. Наибольшее клиническое значение имеют анастомозы в области нижней трети пищевода и кардиаль-ной части желудка, поскольку кровотечение из варикозно-расширенных вен этой области является одним из самых тяжелых осложнений ЦП, приводящих к летальному исходу.
В развитии асцита главную роль играет внутрипеченочный портальный блок вследствие механического препятствия току портальной крови, обусловленному нарушением архитектоники и в известной мере возрастанием притока артериальной крови. Повышение синусоидального давления приводит к увеличению образования лимфы — до 15—20 л (при норме 8—9 л). Такое количество не может быть удалено, часть жидкости просачивается в полость брюшины, образуя асцит. Так как значительная часть плазмы депонируется в брюшной полости, объем циркулирующей плазмы снижается. При этом из-за снижения содержания альбуминов печени и скопления белка в асцитической жидкости снижается и онкоти-ческое давление плазмы. Все это вызывает активацию ренин-ангиотен-зин-альдостероновой системы, стимулируется секреция антидиуретического гормона, происходит задержка натрия и воды. К повышению уровня альдостерона приводят усиление его продукции вследствие гиповолемии и снижение деградации гормона в печени. При этом снижается почечный кровоток.
Спленомегалия также развивается вследствие портальной гипертензии. Помимо венозного застоя, увеличению селезенки способствуют иммунные реакции и разрастание соединительной ткани.
Гиперспленизм — это чрезмерная интенсификация и нарушение функции селезенки по элиминации «состарившихся» форменных элементов крови. В крови при этом снижается количество тромбоцитов, лейкоцитов, эритроцитов.
Портальная гипертензия ведет также к значительному отеку слизистой оболочки желудка и кишечника, что способствует нарушению всасывания, экссудативной энтеропатии и образованию «гепатогенных» язв желудка и
дпк.
Прохождение с портальной венозной кровью в обход паренхимы печени ряда биологически активных веществ и гормонов (в частности, альдостерона, эстрогенов, инсулина, гастрина, гистамина и др.) приводит к эндокринным и метаболическим расстройствам.
Серьезным последствием портальной гипертензии является «портока-вальная», т.е. экзогенная энцефалопатия, которая может закончиться развитием комы.
354
Помимо «шунтовой» комы, при ЦП возможно развитие и собственно печеночной, или эндогенной, комы. Этот вид комы является проявлением гепатоцеллюлярной недостаточности. При ЦП обычно развивается смешанная кома вследствие обеих названных причин.
Клиническая картина. Симптоматика ЦП зависит от этиологии, выраженности цирротического процесса, степени нарушения функции печени, стадии портальной гипертензии и активности воспалительного процесса. При ЦП, как и при гепатитах, выделяют следующие синдромы: астенический, болевой, диспепсический, цитолитический, иммуновоспалитель-дый, синдром гиперспленизма, холестатический, геморрагический.
Выраженность всех этих синдромов при различных ЦП колеблется в больших пределах, что будет показано при описании клинической картины различных форм цирроза. Общим признаком, с той или иной частотой встречающимся при различных формах ЦП на определенной стадии его развития, является синдром портальной гипертензии. Этот синдром является важнейшим отличием ЦП от ХГ.
Из ранних симптомов портальной гипертензии (до появления асцита) наблюдаются: 1) метеоризм («ветер предшествует дождю»); 2) диспепсические расстройства (снижение аппетита, тошнота).
Другие клинические проявления выражены позднее (спленомегалия, асцит, варикозное расширение вен пищевода, желудка, геморроидальных вен). Нередко больные узнают о болезни после проведения УЗИ, когда выявляют расширение портальной и селезеночной вен и умеренную (не пальпируемую) спленомегалию.
При ЦП в большей степени, чем при ХГ, выражен синдром печеночно-клеточной недостаточности, проявляющийся внепеченочными признаками, геморрагиями, желтухой, печеночной энцефалопатией.
Заболевание в своем развитии проходит ряд определенных стадий. В начальной стадии (компенсированной) ЦП, нередко протекающей латентно, без признаков печеночной недостаточности, портальная гипертензия незначительная. Внепеченочные признаки болезни выражены слабо или отсутствуют, лабораторные показатели мало изменены или находятся в пределах нормы. Вместе с тем при морфологическом исследовании биопта-тов печени обнаруживается характерная для ЦП картина. Клинически начальная стадия компенсированного ЦП — это гепатомегалия и спленомегалия, расширение диаметра воротной вены при УЗИ. В стадии декомпенсации внепеченочные признаки выражены ярко, что сочетается с отчетливыми изменениями лабораторных исследований и явными признаками портальной гипертензии. Больные приобретают «типичный» вид (пониженное питание, атрофия мышц, телеангиэктазии, пальмарная эритема); увеличенная печень (бугристая или сморщенная), спленомегалия, асцит, «голова медузы», желтуха, геморрагии, отеки.
В этой стадии (декомпенсированной) наряду с портальной гипертензи-ей, выраженными внепеченочными признаками имеются клинико-лабора-торные проявления печеночной недостаточности и гиперспленизма.
В клинической картине ЦП (вне зависимости от его этиологии и Формы) принято выделять активность цирротического процесса, что морфологически выражается в лимфогистиоцитарной инфильтрации портальных трактов, увеличении количества некрозов гепатоцитов, усилении ци-толитического и иммуновоспалительного синдромов, появлении признаков печеночной недостаточности. Проведение чрескожной пункции показано главным образом только на начальной стадии болезни, оно Нецелесообразно на поздних, развернутых стадиях и противопоказано
355
при декомпенсации ЦП; активность процесса определяется по ряду признаков.
• Усиление выраженности «внепече ночных знаков».
• Усиление желтухи (гипербилирубинемия за счет конъюгированной фракции).
• Повышение активности в сыворотке крови трансаминаз.
• Увеличение содержания у-глобулинов в крови и положительные «осадочные» пробы.
Не очень четкие понятия «декомпенсация», «субкомпенсация», «компенсация» в настоящее время заменены на степени тяжести, определяемые по классам А, В, С, которые в свою очередь определяются количеством баллов (табл. 20).
Таблица 20. Степень тяжести ЦП по Child-Pugh
| Число баллов | |||
| 1 | 2 | 3 | |
| Билирубин, мг% Альбумины, г/л Протромбиновый индекс, % Асцит Энцефалопатия | < 2 > 3,5 > 70 Отсутствует » | 2-3 2,5-3,5 50-70 Легко контролируется Незначительная | > 3 < 2,5 < 50 Трудно (не) контролируется Выраженная |
Сумма баллов по всем показателям: Класс А — от 5 до 7. Класс В — от 8 до 10. Класс С — 11 и более.
Клиническая картина ЦП эволюционирует в зависимости от развития осложнений.
• Кровотечения из варикозно-расширенных вен пищевода и желудка.
• Печеночная энцефалопатия, прекома, кома.
• Вторичная инфекция (главным образом пневмония, асцит-перитонит).
• Гепаторенальный синдром.
• Трансформация в цирроз-рак.
• Тромбоз воротной вены.
• Образование конкрементов в желчных путях.
Кровотечение из вен пищевода и желудка возникает в период портального гипертонического криза, что приводит к разрыву тонкостенных венозных сосудов. Разрыв может произойти и в результате эрозии вен желудочным рефлюктантом. Варикозное расширение вен пищевода находят У 60 % больных ЦП, а 25 % погибают от кровотечения из них. Острая крово-потеря приводит к появлению гипоксических некрозов печени и развитию эндогенной комы. Наличие крови в кишечнике, ее бактериальное разложение вносят экзогенный компонент. Кровотечение из вен пищевода проявляется рвотой алой кровью или «кофейной гущей», обычно больной теряет 1,5—2 л крови. В ряде случаев первым симптомом является мелена.
Печеночная энцефалопатия — результат токсического влияния на центральную нервную систему продуктов метаболизма азотистых соединений, 356
в норме инактивируемых печенью (аммиак, производные фенола и индола, меркаптаны). В генезе энцефалопатии играет роль накопление в ЦНС ложных нейротрансмиттеров, сходных по структуре с истинными, но в 50 раз менее эффективных. Определенное значение имеет повышение концентрации оксимасляных кислот (р и у).
Непосредственными причинами печеночной энцефалопатии могут быть желудочно-кишечные кровотечения, инфекции, в том числе и суперинфекции HAV, HBV, HCV, HDV, диуретики, седативные средства, анальгетики, а также прогрессирование цирроза печени и развитие гепатоцеллюлярной
карциномы.
Выделяют следующие стадии печеночной энцефалопатии: субклиническую, когда нарушения можно выявить только при психомоторных тестах — «тестах линий и чисел».
В стадии I отмечаются легкая несобранность, беспокойство, плохой сон, легкий тремор, нарушения координации. В стадии II больные сонливы,'дезориентированы, неадекватны, двигательные нарушения включают дизартрию, астериксис (хлопающий, «порхающий» тремор верхних конечностей). В стадии III больной впадает в сопор, полностью дезориентирован. Неврологическое обследование определяет гиперрефлексию, патологические рефлексы. В стадии /Сможет быть кома, ответ на болевые раздражители отсутствует.
При печеночной коме наблюдаются нервно-психические нарушения, усиление желтухи, печеночный запах, лихорадка, геморрагический диатез; непостоянные симптомы — уменьшение размеров печени и усиление болей в правом подреберье.
Гепаторенальный синдром провоцируется остро нарастающей гипово-лемией — кровотечением, рвотой, диареей, избыточным диурезом, удалением большого объема асцитической жидкости при парацентезе. В основе синдрома лежит почечная вазоконстрикция, главным образом в наружном слое корковой зоны почек, что ведет к снижению почечного кровотока и гломерулярной фильтрации, экскреции натрия при сохранении способности к канальцевой реабсорбции.
Мелкоузловой ЦП — часто встречающаяся форма ЦП (до 40 % всех ЦП). Объем получаемой информации на каждом этапе диагностического поиска зависит от степени портальной гипертензии и этиологии ЦП.
На I этапе диагностического поиска в состоянии компенсации жалоб может не быть. При нарастании портальной гипертензии главными являются симптомы желудочной и кишечной диспепсии (потеря аппетита, тошнота, рвота, плохая переносимость пищи, диарея) и астении (слабость, повышенная утомляемость, снижение работоспособности). Частый и стойкий симптом — чувство тяжести и боли в правом подреберье вследствие
гепатомегалии.
При декомпенсации цирроза больной может отмечать увеличение живота, носовые кровотечения как первые проявления болезни. Кровотечения из вен пищевода как драматический дебют болезни наблюдаются нередко. Возможны нарушения сна, резкая раздражительность — проявления «шунтовой» печеночной энцефалопатии.
Этиологический фактор (если цирроз алкогольный) на I этапе на основании анамнестических данных уточнить трудно, так как больные часто скрывают злоупотребление алкоголем. У части больных отмечается перенесенный ранее острый вирусный гепатит; выясняется бывшая ранее белко-во-витаминная недостаточность и т.п.
На II этапе диагностического поиска уже в стадии компенсации могут обнаруживаться «печеночные» знаки: сосудистые звездочки, пальмарная
357
эритема, гинекомастия, отсутствие или снижение оволосения в подмышечных впадинах, у мужчин — на груди, лице. Ногти часто белые и ровные.
При подозрении на алкогольный генез ЦП следует обращать внимание на возможные соматические и неврологические проявления алкоголизма- I контрактуру Дюпюитрена, увеличение околоушных желез, атрофию мыщц' миопатию и полиневриты. Возможны проявления алкогольного панкреатита, болезненность в характерных зонах (подробнее см. «Хронический панкреатит»). Обнаружение перечисленных признаков делает алкогольный генез болезни весьма вероятным.
Одним из наиболее частых объективных симптомов является увеличение печени; край ее заостренный, поверхность ровная, консистенция плотная. Увеличенная селезенка на этой стадии пальпируется у половины больных.
В стадии декомпенсации выявляются желтуха (степень выраженности различна в зависимости от активности цирроза), значительное похудение, развитые венозные коллатерали на груди и передней брюшной стенке, нередко — пупочная грыжа, отеки нижних конечностей, спленомегалия, асцит. Селезенка увеличена больше, чем печень.
На III этапе диагностического поиска клинический анализ крови выявляет анемию, чаще гипохромную, возможно сочетание анемии с лейкопенией и тромбоцитопенией. Микроцитарная анемия — результат возможных кровотечений и/или синдрома гиперспленизма.
При биохимическом исследовании крови в стадии компенсации обнаруживаются незначительные отклонения в функциональных пробах печени: гиперпротеинемия, небольшое повышение билирубина (у части больных). В стадии декомпенсации — выраженная диспротеинемия (гипоальбумине-мия, гипер-у-глобулинемия, положительные осадочные реакции), снижение содержания протромбина и холестерина, повышение билирубина, умеренное повышение активности аминотрансфераз.
Иммунологические нарушения выражены незначительно. У отдельных больных отчетливо повышено содержание IgA (встречается при хроническом алкоголизме).
Для выявления варикозно-расширенных вен пищевода производят рентгенологическое исследование, эзофагогастродуоденоскопию. Ректоскопия выявляет варикозно-расширенные геморроидальные вены.
При УЗИ органов брюшной полости определяют размер и структуру печени. Печень обычно увеличена, эхогенность повышена, структура органа однородна. Диаметр воротной и селезеночной вен увеличен. Размеры селезенки превышают норму.
Лапароскопия проводится при неясном диагнозе, главным образом для исключения онкологической патологии. На ранних стадиях при лапароскопии можно обнаружить увеличенную печень с картиной мелкоузлового цирроза, симптомы портальной гипертензии, на поздних стадиях — картину смешанного (крупно- и мелкоузлового) цирроза. Биопсию следует проводить только на ранних стадиях процесса при дифференциальной диагностике гепатита и цирроза.
Морфологическое изучение биоптата печени при циррозе алкогольного генеза выявляет: а) жировую дистрофию гепатоцитов; б) образование ложных долек; в) обширное развитие фиброза. Признаками алкогольной этиологии ЦП являются тельца Маллори (скопления гиалина в центре долек) и очаговая инфильтрация нейтрофилами портальных трактов.
| 358 |
Крупноузловой ЦП составляет до трети всех ЦП и бывает, как правило, вирусной этиологии. Весьма часто ХАИГ трансформируется в эту форму
ттЦ- Заболевание значительно чаще встречается у лиц молодого и среднего возраста. Для этой формы цирроза характерно быстрое, клинически выраженное прогрессирование. В клинической картине на первый план выступают проявления цитолитического синдрома и печеночно-клеточной недостаточности, признаки портальной гипертензии присоединяются на терминальной стадии.
Симптоматика в период обострения заболевания напоминает острый вирусный гепатит или ХГеп высокой степени активности. Характерны желтуха, лихорадка, астенический, диспепсический и цитолитический синдромы.
На I этапе диагностического поиска главными признаками являются желтуха, боли в животе (в правом подреберье и подложечной области), повышение температуры тела, диспепсические расстройства, слабость. Степень выраженности жалоб прямо коррелирует с активностью процесса; при стихании некроза и воспаления они ослабевают (но полностью не исчезают). Это позволяет уже на данном этапе обследования больного судить об
активности процесса.
В случае развития цирроза как исхода ХАИГеп остается характерная для ХАИГеп полиорганность поражения; с этим связано разнообразие жалоб (артралгии, геморрагические высыпания и др.).
На этом же этапе уточняют этиологию цирроза: у подавляющего большинства больных устанавливается связь с перенесенным вирусным гепатитом В или С, гепатотропными ядами, отмечается лекарственная непереносимость.
Выявляются характерные особенности развития цирроза: 1) прогрессирующее течение; 2) печеночная недостаточность развивается значительно раньше появления признаков портальной гипертензии.
На II этапе диагностического поиска даже в стадии компенсации вне-печеночные признаки выражены в большей степени, нежели у больных
мелкоузловым ЦП.
В стадии декомпенсации ЦП отмечается выраженная желтуха; другие
«печеночные» знаки по-прежнему очень яркие.
При высокой активности процесса возможны полисерозиты, иногда преходящий асцит. На поздней стадии асцит является постоянным признаком болезни.
Печень и селезенка увеличены незначительно. Печень имеет острый и болезненный край, неровную поверхность. Болезненность при пальпации печени усиливается в период обострения.
Данные III этапа диагностического поиска по результатам клинического и биохимического анализов крови выявляют признаки выраженного печеночного цитолиза и функциональной недостаточности гепатоцитов: значительное повышение уровня билирубина (преимущественно за счет связанного), 5—10-кратное повышение уровня аминотрансфераз, ЛДГ и ее 4—5-й Фракций, снижение содержания холестерина и протромбина, диспротеине-мию (резкое увеличение количества гамма-глобулинов и значительное снижение количества альбуминов, изменение осадочных проб, особенно тимоловой). Клинический анализ крови выявляет увеличение СОЭ, «сдвиг» влево в лейкоцитарной формуле, лейкоцитоза обычно не бывает, явления гиперспленизма наблюдаются реже, чем при мелкоузловом ЦП.
Вирусную природу ЦП подтверждает или выявляет обнаружение при серологическом исследовании крови маркеров вирусной инфекции.
Варикозное расширение вен пищевода, желудка и геморроидальных вен выявляют при рентгенологическом исследовании пищеварительного тракта, эзофагогастродуоденоскопии и ректороманоскопии.
359
УЗИ выявляет увеличение или на терминальной стадии уменьшение размеров печени, повышенную эхогенность и неравномерную структуру органа. Селезенка увеличена незначительно.
Лапароскопия помогает обнаружить крупноузловое поражение печени. Билиарные циррозы (БЦ) встречаются у 5—10 % больных ЦП. Различают первичный (истинный) билиарный цирроз (ПБЦ) и вторичный билиар-ный цирроз (ВБЦ). ПБЦ поражает почти исключительно женщин, ВБЦ встречается и у мужчин.
В основе ПБЦ лежит внутрипеченочный холестаз, а в основе ВБЦ -~ внепеченочный (подпеченочный) холестаз (редко — длительное нарушение оттока желчи на уровне крупных внутрипеченочных желчных протоков). Чаще всего ВБЦ развивается при «доброкачественной» обструкции (камень, стриктура), так как «злокачественная» обструкция (карцинома) приводит к смерти раньше, чем успевает развиться цирроз. Этиология ПБЦ неизвестна; это аутоиммунное заболевание с появлением антител к структурам эпителия желчных протоков.
При ПБЦ в печени стадийно, последовательно наблюдают: 1) лимфо-плазмоцитарную инфильтрацию портальных полей. Разрушение эпителия желчных протоков; 2) пролиферацию мелких желчных ходов и протоков; 3) замещение портальных полей рубцовой тканью, очаговые и мостовид-ные некрозы; 4) соединительнотканные септы, «ложные» дольки.
Клинические особенности БЦ состоят в доминировании холестатиче-ского синдрома, позднем проявлении и небольшой выраженности синдромов портальной гипертензии и печеночно-клеточной недостаточности.
На I этапе диагностического поиска выявляют основные жалобы, характерные для длительного холестаза: желтуху, кожный зуд, кровоточивость, боли в костях (особенно в спине и ребрах), диарею. Асцит наблюдается лишь в поздней стадии болезни. Уже на этапе анализа анамнестических данных складывается мнение о первичном или вторичном БЦ.
Для ПБЦ характерным является предшествующий ХГ с холестатиче-ским синдромом, для вторичного — указания на имевшуюся ранее патологию желчевыводящих путей. При ВБЦ наряду с симптомами холестаза отмечаются симптомы холангита — боли в правом подреберье, лихорадка с ознобами; при наличии ЖКБ — приступы желчной колики, «атаки» панкреатита в анамнезе.
На II этапе диагностического поиска отчетливо проявляются симптомы длительного холестаза: желтуха, диффузная «бурая» гиперпигментация кожи, ее утолщение, огрубение, сухость, множественные следы расчесов, ксантелазмы, ксантомы на локтях, подошвах, ягодицах. Болезненность при поколачивании по костям, пальцы в виде барабанных палочек — результат остеомаляции и субпериостальных новообразований костной ткани при длительном холестазе.
Сосудистые звездочки встречаются реже, чем при других видах ЦП, выражены слабо. Печень всегда увеличена, плотная, может достигать огромных размеров. Селезенка также увеличена, но незначительно.
Проявления портальной гипертензии выявляются только на поздней стадии болезни. Асцит при БЦ является поздним симптомом.
На III этапе диагностического поиска выявляют: а) лабораторные признаки холестаза; б) иммунные нарушения, характерные для ПБЦ; в) проявления портальной гипертензии; г) осложнения; д) причины внепеченочно-го холестаза; е) морфологические признаки цирроза.
Лабораторные признаки холестаза выражены резко: 1) гипербилируби-немия достигает высоких цифр, в 5—10 раз превышая норму, преимущест-
венно увеличивается содержание связанного билирубина; 2) значительно возрастает уровень общих липидов, фосфолипидов и холестерина (содержание триглицеридов не увеличивается), у-глобулинов и р-липопротеидов; 3) повышается активность щелочной фосфатазы, гамма-глютамилтранспеп-тидазы (Г-ГТ) в сыворотке крови.
Биохимические признаки цитолиза гепатоцитов с печеночно-клеточной недостаточностью появляются (и прогрессируют) лишь на поздних стадиях процесса. В начальном периоде БЦ подъем активности аминотрансфераз
выражен слабо.
При первичном БЦ закономерно выявляется изменение иммунологических показателей: повышение титра IgG и IgM (больше IgM), резкая ги-пергаммаглобулинемия, повышение СОЭ (при вторичном БЦ СОЭ также повышена, но как результат неиммунного воспаления); весьма специфичным для ПБЦ является появление антимитохондриальных антител в высоком титре.
С помощью иммуноферментного анализа выделены подтипы антимитохондриальных антител: анти-М-8 характерны для наиболее прогрессирующих форм заболевания, анти-М-9 — для более доброкачественных форм
заболевания.
Рентгеноскопия пищеварительного тракта и эзофагогастродуоденоскопия позволяют выявить расширение вен пищевода. Эти методы исследования помогают обнаружить язвы желудка и двенадцатиперстной кишки как проявление осложнений БЦ. Такое осложнение, как остеомаляция, выявляется при рентгенологическом исследовании костей. Рентгенологическими проявлениями билиарной остеопатии являются деминерализация костей, полосы просветления, выявляемые особенно часто в костях таза и лопаток, сдавление и деформация позвонков.
Инструментальные методы исследования (УЗИ, гастродуоденоскопия, эндоскопическая ретроградная холангиопанкреатография, лапароскопия) позволяют в большинстве случаев выявить причины внепеченочного холестаза.
В случае подозрения на опухолевый процесс производят также магнитно-резонансную томографию (МРТ), ангиографию печени и целиакографию. Методы позволяют оценить структуру печени, селезенки, поджелудочной железы и исключить или подтвердить наличие опухоли.
Гистологические признаки цирроза определяются по данным биоптата печени, полученного при лапароскопии или чрескожной пункции. Диагноз ПБЦ подтверждают следующие признаки:
1) деструктивные изменения междольковых желчных протоков;
2) отсутствие междольковых протоков более чем в половине портальных трактов;
3) холестаз преимущественно на периферии дольки;
4) расширение, инфильтрация и фиброз портальных полей.
При вторичном БЦ морфологическими критериями являются:
1) расширение внутрипеченочных желчных ходов;
2) некрозы в периферических частях печеночных долек с образованием
Желчных «озер»;
3) нормальное дольковое строение в отдельных участках печени.
Биопсия печени при ВБЦ чревата желчным перитонитом.
Диагностика. Распознавание цирроза печени основывается на выяв
лении:
1) клинических проявлений главных симптомов: цитолитического, печеночно-клеточной недостаточности, портальной гипертензии, холестати-
Ческого;
361
2) лабораторно-инструментального подтверждения указанных сищ,
ромов; ^~
3) этиологических факторов;
4) морфологических признаков ЦП на начальной, доклинической (п0и отсутствии основных синдромов) стадии болезни.
Дифференциальная диагностика. Трудности в диагностике ЦП обусловлены сходством клинической картины болезни с проявлениями хронического гепатита, а также ряда других заболеваний.
От хронического гепатита ЦП отличают следующие признаки:
а) резкое нарушение архитектоники органа (по данным морфологиче
ского исследования);
б) развитие портальной гипертензии (асцит, спленомегалия, венозные
коллатерали, кровотечения из пищеварительного тракта);
в) глубокие дистрофические и некробиотические изменения паренхимы
органа, обусловливающие большую выраженность функциональных сдви
гов, печеночную недостаточность.
Среди заболеваний, требующих дифференциальной диагностики с ЦП, следует выделить:
• цирроз-рак и первичный рак печени. При этой патологии асцит быстро развивается вследствие тромбоза воротной вены и ее ветвей, метастазов в перипортальные лимфатические узлы, локализующихся в области ворот печени, и карциноматоза брюшины. Отграничить эти процессы от цирроза позволяют обнаружение альфа-фетопротеина, результаты данных лапароскопии и МРТ;
• констриктивный перикардит, сопровождающийся увеличением печени и асцитом. Решающее значение в диагностике перикардита имеют данные рентгенокимографии и эхографии сердца;
• доброкачественный сублейкемический миелоз (миелофиброз, остео-миелосклероз), проявляющийся увеличением печени и особенно селезенки. Диагностическое значение имеют данные трепанобиопсии, выявляющие характерные изменения;
• альвеолярный эхинококкоз, проявляющийся не только увеличением печени, но также селезенки и изменением функциональных печеночных проб. При эхинококкозе обнаруживают специфические антитела при реакции латекс-агглютинации; печень отличается необыкновенной плотностью и характерными изменениями при УЗИ и МРТ;
• амилоидоз, гемохроматоз и болезнь Вильсона—Коновалова, сопровождающиеся гепатолиенальным синдромом, изменениями белкового обмена, обмена железа и меди. Достоверная диагностика этих заболевании основывается на характерных для каждого из них симптомах, определении амилоида в тканях, трансферина и церулоплазмина в крови.
Формулировка развернутого клинического диагноза учитывает следующие пункты:
| 362 |
1) этиология (вирусный, алкогольный, криптогенный и т.д.);
2) морфология: микронодулярный (мелкоузловой), макронодулярныи (крупноузловой), смешанный;
3) класс тяжести по Чайлд—Пью;
4) другие синдромы (указывают при их клинической выраженности, портальная гипертензия (конкретно — асцит, варикозное расширение ве^ нижней трети пищевода III степени и т.д.), холестаз, гиперспленизм (анемия, тромбоцитопения, лейкопения); т тт
5) активность цирроза (оценивается активность трансаминаз — U > III степень);
6) осложнения.
Лечение. Тактика лечения ЦП определяется этиологией, активностью ^логического процесса, основными клиническими проявлениями и степью функциональных расстройств. Для подбора адекватной терапии Пе«но учитывать стадию течения заболевания. 3 Всем больным ЦП показано соблюдение ряда правил.
. Исключение профессиональных и бытовых вредностей, полный от-
аз от алкоголя.
. Соблюдение благоприятного для лечения режима труда, отдыха и ания. g компенсированной стадии ЦП больные могут выполнять рабо-т не связанные с тяжелой физической нагрузкой, длительной ходьбой ть' стоянием, следует избегать воздействия высокой или низкой темпера-^!упъ1 инсоляции. При портальной гипертензии следует избегать любых Физических усилий, вызывающих повышение внутрибрюшного давления. При выраженной активности и декомпенсации процесса показаны постельный режим и стационарное лечение.
• Всем больным показано соблюдение диеты (стол № 5). В случае вы
явления симптомов печеночной недостаточности следует исключать или
ограничивать белок до уровня, при котором исчезают признаки интоксика
ции. Поваренную соль ограничивают, а при развитии асцита — исключают
из рациона.
• Необходимы лечебные мероприятия, направленные на нормализацию процессов пищеварения и всасывания (прием пищеварительных ферментов, не содержащих желчь — мезим, панкреатин, креон), устранение кишечного дисбактериоза (пробиотики, эубиотики), санацию хронических воспалительных процессов органов брюшной полости и других сопутствующих острых и хронических заболеваний, при этом следует избегать ге-патотоксичных антибиотиков и других лекарств.
• Запрещение проведения физиотерапевтических процедур, вакцинации, приема гепатотоксичных препаратов, в том числе психотропных и снотворных средств.
Такое подробное описание мероприятий базисной терапии объясняется тем, что строгое ее соблюдение играет важную роль в лечении ряда больных ЦП.
Решающую роль играет этиотропная терапия. При ЦП, вызванном HBV, показана терапия интерфероном. При наличии противопоказаний (главные — класс С по Чайлд—Пью, почечная недостаточность и др.) показана терапия ламивудином. Уменьшение виремии благоприятно сказывается на прогнозе. При ЦП, вызванном HCV, показана терапия интерфероном и рибавирином. При плохой переносимости и противопоказаниях от терапии отказываются.
При алкогольных ЦП проводят лечение эссенциальными фосфолипи-Дами (эссенциале форте), флавоноидами (препараты расторопши — кар-сил, силимар, артишока — хофитол).
Помимо этиотропной терапии, больные компенсированным неактив-ьщ или с минимальной активностью ЦП в другой лекарственной терапии е нуждаются. Им показано лишь соблюдение правильного образа жизни.
Больные декомпенсированным неактивным или с минимальной актив-остью ЦП нуждаются в строгом соблюдении режима и диеты, лекарственную терапию проводят патогенетическими и симптоматическими средства-и. к ним относятся дезинтоксикационные средства (внутривенное капельное введение гемодеза 200—400 мл или 200—300 мл 5 % раствора глю-козы), эссенциале (по 2 капсулы 3 раза в день) или карсил (легалон) по ■J таблетки 3 раза в день на протяжении 3 мес и более.
363
Больные декомпенсированным ЦП с признаками портальной гапертец зии (кроме вышеперечисленных мероприятий) нуждаются в лечении отеч но-асцитического синдрома. Лечение асцита требует осмотрительности и-!" за многочисленных побочных реакций диуретической терапии. Уменьще ние и особенно устранение асцита способствуют снижению портальног" давления и являются профилактикой портокавальной энцефалопатии ! кровотечений из варикозных вен пищевода.
Следует помнить, что резорбтивная способность брюшины не превы шает 400 мл/сут и потеря большего количества жидкости приводит к обезвоживанию тканей, гипокалиемии и метаболическому алкалозу.
Первым этапом является применение диеты с резким ограничением соли — до 1,5 г натрия хлорида в сутки, но даже если пищу готовить без добавления соли, в ней будет содержаться ее 3—4 г. Поэтому следует исключить продукты, изначально содержащие натрий (колбасы, консервы сыры, морепродукты). Количество вводимой жидкости должно составлять 800—1500 мл. Если на фоне гипонатриевой диеты не наступает снижения массы тела на 300—400 г и нет спонтанного диуреза, назначают антагонисты альдостерона (верошпирон по 75—150 мг/сут). При отсутствии эффекта к верошпирону добавляют фуросемид, далее — этакриновую кислоту (урегид) и триампур (триамтерен+гипотиазид). При резистентном (неконтролируемом) асците, угрозе разрыва тканей живота, дыхательной и сердечной недостаточности вследствие асцита проводят парацентез тонкой иглой с извлечением 3—4 л асцитической жидкости. Выведение больших объемов противопоказано из-за потерь электролитов и белка, ведущих к печеночной недостаточности.
Консервативное лечение портальной гипертензии также предусматривает прием лекарственных препаратов, снижающих портальное давление. Для этого используют пролонгированные нитраты в обычных терапевтических дозах и пропранолол в дозах, снижающих частоту сердечных сокращений в покое на 25 %. Такая терапия проводится в течение длительного времени (месяцы, годы). Это лечение является обязательным для больных с наличием в анамнезе кровотечения из расширенных вен пищевода.
Терапия асцита включает, помимо вышеописанного, введение белковых препаратов: нативную концентрированную плазму и 20 % раствор альбумина. Они способствуют повышению коллоидно-осмотического давления плазмы и содержания альбумина.
Для декомпрессии портальной системы показана операция: наложение портокавальных сосудистых анастомозов; в тактику входит наложение внутрипеченочного шунта. Показаниями к операции являются варикозно-расширенные вены пищевода у больных, перенесших кровотечение, а также высокая портальная гипертензия. Оперативное лечение (спленэктомия) производят также больным с наличием синдрома гиперспленизма.
При билиарном ЦП лечение холестаза проводится аналогично таковому при ХХГеп (см. «Лечение хронического холестатического гепатита»).
Борьба с осложнениями заключается в проведении ряда мероприятий.
I. Остановка пищеводно-желудочного кровотечения включает: 1) переливание свежезаготовленной крови дробно в количестве 100—200 мл, повтори три необходимости капельно; парентеральное введение викасола, хлорид сальция, аминокапроновой кислоты; 2) внутривенное введение питуитрин гаи вазопрессина в 100—200 мл 5 % раствора глюкозы (препарат снихае щвление в воротной вене); 3) обтурационное тампонирование пишевод юндом с баллоном, желудочная гипотермия; при отсутствии эффекта прои юдят эндоскопическое склерозирование вен, обширные трансабдоминал 64
операции по перевязке вен сопровождаются очень высокой летально-Hbl£ • 4) для предупреждения постгеморрагической комы показаны удаление СТЬ1ви из кишечника назначением осмотических слабительных, препаратов К основе лактулозы (дюфалак), промывание желудка и откачивание содер-на г0 Через зонд; прием антибиотиков, не всасывающихся в кишечнике ^намицин, стрептомицин) внутрь, парентеральное введение жидкости (катоМ числе полиглюкина) до 2 л в сутки. Борьба с пищеводно-желудочным ^Б овотечением не всегда заканчивается успешно, несмотря на весь комплекс КР оприятий; в 20—40 % случаев наступает смертельный исход.
II Для лечения печеночной комы внутривенно вводят: 1) глу-миновую кислоту, орницетил для обезвреживания уже поступившего в Тповь аммиака и других метаболитов; 2) эссенциале, витамины группы В и Р липоевую кислоту, препараты калия (в 5 % растворе глюкозы внутривенно капельно, за сутки — до 2—3 л) для улучшения обмена печеночных клеток; 3) постоянно контролируют электролитный баланс, кислотно-основное состояние и своевременно регулируют его введением электролитов [ буферных смесей; при развитии метаболического ацидоза вводят 200—600 мл 4 % раствора гидрокарбоната натрия, а при выраженном метаболическом алкалозе вводят препараты калия до 10 г/сут; 4) антибиотики (мономицин, канамицин, стрептомицин) вводят через желудочный зонд для подавления жизнедеятельности кишечной микрофлоры.
Однако, несмотря на интенсивное лечение, печеночная кома при ЦП чаще всего заканчивается летальным исходом. Профилактика комы сводится к проведению лечебных мероприятий, предотвращающих развитие желудочно-кишечных кровотечений, инфекций, интоксикации; требуется осторожность в назначении диуретиков, седативных и снотворных препаратов.
К факторам плохого прогноза печеночной энцефалопатии относят продолжающееся желудочно-кишечное кровотечение, высокую степень портальной гипертензии («резистентный» асцит, варикозное расширение вен пищевода III—IV степени), длительность цирроза печени более 5 лет, степень тяжести цирроза класса С и отсутствие положительного клинического эффекта в первую неделю лечения.
Прогноз. Сформировавшийся ЦП является необратимым состоянием, однако этиотропная терапия, правильный образ жизни, успешное воздействие на активность процесса, проведение всего комплекса лечебных мероприятий могут способствовать тому, что ЦП длительное время остается компенсированным. Накапливается опыт по применению препаратов — ингибиторов фиброгенеза (колхицин).
Профилактика. Мероприятиями профилактики являются устранение или ограничение действия этиологических факторов (снижение употребления алкоголя, вакцинации от гепатита В, снижение риска гепатита С), своевременное распознавание и лечение хронического гепатита и жировой Дистрофии печени. При наличии цирроза необходимо проводить меро-риятия, направленные на прекращение прогрессирования процесса и профилактику осложнений.
Хронический холецистит
. ХРОНИЧЕСКИ И ХОЛЕЦИСТИТ представляет собой воспаление
гда ЧНого пузыря, преимущественно бактериального происхождения, ино-
Нях ВОзникак)Щее вторично при дискинезии желчных путей, желчных кам-
х или паразитарных инвазиях. В данном разделе будет рассмотрен хро-
|
|
| 18 . ПАТОГЕНЕЗ ХРОНИЧЕСКОГО БЕСКАМЕННОГО ХОЛЕЦИСТИТА |
нический бескаменный холецистит (ХБХ). Хронический калькулезный v лецистит рассматривается в курсе хирургических болезней.
ХБХ — одно из распространенных заболеваний желчевыводящих путе1-встречается во всех возрастных группах, но преимущественно страда{5' лица среднего возраста (от 40 до 60 лет). Заболеваемость составляет 6—7 н 1000 населения. Женщины болеют чаще мужчин в 3—4 раза.
Этиология. Основную роль в развитии ХБХ играет условно-патоген ная микрофлора. Наиболее частым возбудителем является кишечная па лочка (у 40 % больных), несколько реже — стафилококки и энтерококки (по 15 %), стрептококки (у 10 % больных). У трети больных обнаружив^ ется смешанная микрофлора. Очень редко (примерно в 2 % случаев) вы' севаются протей и дрожжевые грибы.
Этиологическая роль лямблий сомнительна. Несмотря на довольно высокую частоту обнаружения лямблий в дуоденальном содержимом, в настоящее время считают, что лямблиоз наслаивается на воспалительный процесс в желчном пузыре.
Для развития ХБХ недостаточно только инфицирования желчи. Предрасполагают к ХБХ застой желчи и повреждение стенок желчного пузыря.
Застою желчи способствуют: 1) нарушение режима питания (ритма, качества и количества употребляемой пищи); 2) психоэмоциональные факторы; 3) гиподинамия; 4) иннервационные нарушения различного генеза; 5) запоры; 6) беременность; 7) нарушения обмена, приводящие к изменению состава желчи (ожирение, атеросклероз, сахарный диабет и пр.); 8) органические нарушения путей оттока желчи.
Повреждение стенок желчного пузыря возможно в результате: 1) раздражения слизистой оболочки желчного пузыря желчью с измененными физико-химическими качествами; 2) травматизации конкрементами (камни могут образоваться в желчном пузыре без предшествующего воспаления); 3) раздражения слизистой оболочки панкреатическими ферментами, затекающими в общий желчный проток; 4) травм желчного пузыря.
Патогенез. Инфекция попадает в желчный пузырь тремя путями: восходящим, гематогенным и лимфогенным.
Восходящим путем инфекция проникает из кишечника. Этому способствуют гипо- и ахлоргидрия, нарушение функции сфинктера Одди, экскреторная недостаточность поджелудочной железы.
Гематогенным путем инфекция может проникнуть в желчный пузырь из большого круга кровообращения по почечной артерии (чаще при хроническом тонзиллите и других поражениях рото- и носоглотки) или из khj шечника по воротной вене. Способствует этому нарушение барьерной функции печени.
Лимфогенным путем инфекция попадает в желчный пузырь при аппендиците, воспалительных заболеваниях женской половой сферы, пневмоний и нагноительных процессах в легких.
Благоприятные условия для развития попавшей в желчный пузырь инфекции создает застой желчи, обусловленный воздействием перечислении причин. Застой желчи изменяет холатохолестериновый индекс (снижен уровня желчных кислот и увеличение концентрации холестерина), что сП собствует образованию холестериновых камней (схема 18).
В патогенезе ХБХ имеют значение также факторы, приводящие к п вреждению стенок желчного пузыря с травматизацией его слизистой о лочки, нарушением кровообращения и развитием воспаления. У ряда °°' ных ХБХ первично происходит повреждение слизистой оболочки желчи
366
пузыря при нарушенном оттоке желчи, а инфекция присоединяется вторично.
Длительный воспалительный процесс, хронический очаг инфекции отрицательно влияют на иммунобиологическое состояние больных, снижают
реактивность организма.
Больным ХБХ свойственны специфическая и неспецифическая сенсибилизация к различным факторам внешней и внутренней среды, развитие аллергических реакций. В результате создается порочный круг: воспаление в желчном пузыре способствует поступлению в кровь микробных антигенов, что приводит к сенсибилизации, а последняя поддерживает хроническое течение холецистита и способствует его рецидивированию.
Если морфологические изменения развиваются только в слизистой оболочке желчного пузыря и носят катаральный характер, то функция желчного пузыря долгое время остается достаточно сохранной. Если же воспалительный процесс захватывает всю стенку желчного пузыря, то происходят утолщение и склероз стенки, сморщивание пузыря, утрачиваются его функции, Развивается перихолецистит. Воспалительный процесс из желчного пузыря Может распространиться на желчные ходы и привести к холангиту.
Помимо катарального воспаления, при холецистите может возникать флегмонозный или даже гангренозный процесс. В тяжелых случаях в стен-Ке Желчного пузыря образуются мелкие абсцессы, очаги некроза, изъязвления, которые могут вызвать перфорацию или развитие эмпиемы.
Длительный воспалительный процесс при нарушении оттока желчи, помимо образования камней, может привести к образованию воспалительных «пробок».
Эти «пробки», закупоривая пузырный проток, способствуют развитию °Дянки желчного пузыря и при бескаменной форме холецистита.
367
 Таким образом, при ХБХ могут развиваться следующие осложнения-1) перихолецистит; 2) холангит; 3) перфорация желчного пузыря; 4) водянка; 5) эмпиема желчного пузыря; 6) образование камней.
Таким образом, при ХБХ могут развиваться следующие осложнения-1) перихолецистит; 2) холангит; 3) перфорация желчного пузыря; 4) водянка; 5) эмпиема желчного пузыря; 6) образование камней.
Вследствие чрезвычайно тесной анатомической и физиологической связи желчного пузыря с близлежащими органами у больных ХБХ поражаются печень (гепатит), поджелудочная железа (панкреатит), желудок и двенадцатиперстная кишка (гастрит, дуоденит).
Классификация. Общепринятой классификации ХБХ не существует Ниже в несколько упрощенном виде приводится классификация, предложенная A.M. Ногаллером (1979).
1. Степень тяжести (форма): 1) легкая; 2) средней тяжести; 3) тяжелая.
2. Стадия заболевания: 1) обострение; 2) стихающее обострение; 3) ремиссия (стойкая, нестойкая).
3. Наличие осложнений: 1) неосложненный; 2) осложненный.
4. Характер течения: 1) рецидивирующий; 2) монотонный; 3) перемежающийся.
Легкая форма характеризуется нерезко выраженным болевым синдромом и редкими (1—2 раза в год), непродолжительными (не более 2—3 нед) обострениями. Боли локализованные, длятся 10—30 мин, проходят, как правило, самостоятельно. Диспепсические явления редки. Функция печени не нарушена. Обострения чаще обусловлены нарушением режима питания, перенапряжением, острой интеркуррентной инфекцией (грипп, дизентерия и пр.).
Для ХБХ средней тяжести характерен болевой синдром. Боли стойкие, иррадиирующие, связаны с нарушением диеты, небольшим физическим и психическим переутомлением. Диспепсические явления выражены, часто бывает рвота. Обострения возникают 5—6 раз в год, носят затяжной характер. Могут быть изменены функциональные пробы печени. Возможны осложнения (холелитиаз).
При тяжелой форме резко выражены болевой и диспепсический синдромы. Частые (1—2 раза в месяц и чаще) и продолжительные желчные колики. Лекарственная терапия малоэффективна. Функция печени нарушена. Осложнения развиваются часто.
При обострении воспалительного процесса в желчном пузыре, помимо выраженных субъективных ощущений (боль, диспепсический синдром), отчетливо проявляются острофазовые показатели (лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ, увеличение содержания а2-глобулинов, положительный СРБ) и изменения биохимических констант (повышение уровня билирубина, преимущественно за счет связанного, активности аминотрансфераз). Печень может быть увеличена. При стихающем обострении все указанные явления выражены в меньшей степени. В период ремиссии клинические симптомы исчезают или значительно уменьшаются, все признаки воспаления отсутствуют.
Хронический холецистит может протекать без осложнений. При длительном течении или тяжелой форме заболевания развиваются осложнения.
При рецидивирующем ХБХ период обострения сменяется полной или относительной ремиссией (все клинические симптомы полностью исчезают или значительно уменьшаются).
Для монотонного течения заболевания характерно отсутствие ремиссий. Больные постоянно испытывают боль, чувство тяжести в правом подреберье или эпигастральной области, жалуются на диспепсические расстройства.
368
При перемежающемся ХБХ на фоне постоянно выраженных клинических симптомов периодически отмечаются обострения той или иной степе-и тяжести с повышением температуры тела или типичной желчной коликой.
Клиническая картина. Проявления болезни определяются наличием
следующих синдромов:
• болевого;
• диспепсического;
• воспалительного (при обострении);
. нарушением функции кишечника (кишечный дискинетический син-
• ' нарушением липидного обмена (по клинико-лабораторным данным);
• холестатического (при закупорке общего желчного протока);
• вовлечением в процесс других органов и систем.
На I этапе диагностического поиска выявляют: а) болевой синдром, уточняя его характеристику; б) диспепсический синдром и его проявления; в) симптомы, отражающие вовлечение в патологический процесс других органов и систем; г) факторы, приведшие к развитию заболевания и его обострению; д) особенности течения заболевания.
Боли при ХБХ:
1) локализуются главным образом в правом подреберье, реже — в подложечной области;
2) иррадиируют в правую лопатку, реже в правую половину грудной клетки, ключицу, поясницу;
3) как правило, тупые;
4) могут беспокоить постоянно или возникают нечасто;
5) продолжительность болей от нескольких минут и часов до нескольких дней;
6) обусловлены нарушением диеты, волнением, охлаждением, инфекцией, физическим напряжением, возникают, как правило, после приема жирной жареной пищи, употребления обильного количества пищи.
Боли, появляющиеся при физической нагрузке или после нее, при тряской езде, больше характерны для желчнокаменной болезни (калькулезно-го холецистита).
У больных вне обострения при легком течении ХБХ болей может не быть. При обострении характер боли становится похожим на приступ острого холецистита, интенсивность резко выражена.
Диспепсические явления часто наблюдаются при ХБХ. Больные жалуются на тошноту, пустую отрыжку, чувство горечи во рту, рвоту, изменение аппетита, плохую переносимость некоторых видов пищи (жиры, алкоголь, продукты, содержащие уксус, и пр.). Рвота при холецистите не приносит облегчения. Кроме того: а) сильные и стойкие боли в эпигастральной области могут свидетельствовать о наличии сопутствующих патологических изменений в желудке; б) боли около пупка или в нижней части живота, сопровождающиеся поносами или запорами, — о хроническом колите; в) боли в левом подреберье или опоясывающие — о хроническом панкреатите.
Больного может беспокоить повышение температуры тела, связанное, Как правило, с развитием воспаления желчного пузыря.
Фебрильная температура с жалобами на кожный зуд даже при отсутствии желтухи характерна для холангита.
При изучении анамнеза выявляются факторы, способствующие развитию заболевания или обострения (наличие в семье больных с патологией
369


 желчных путей, нарушение режима питания и погрешности в диете, пере, несенные вирусный гепатит, дизентерия, заболевания желудка, кишечника и пр.).
желчных путей, нарушение режима питания и погрешности в диете, пере, несенные вирусный гепатит, дизентерия, заболевания желудка, кишечника и пр.).
Определяют характер течения: монотонный, постоянный или волнообразный, рецидивирующий ХБХ.
На I этапе может сложиться достаточно убедительное впечатление о вовлечении в патологический процесс желчевыводящих путей. Характер заболевания, его нозологическую принадлежность определяют только по данным, полученным на последующих этапах обследования.
На II этапе диагностического поиска обнаруживают симптомы поражения желчного пузыря и вовлечения в процесс других органов.
При обследовании больного необходимо обратить внимание на зоны кожной гиперестезии, преимущественно в правом подреберье и под правой лопаткой (характерный симптом ХБХ). В тяжелых случаях зоны кожной гиперестезии более обширны. При дискинезии желчных путей гиперестезия выражена слабо или отсутствует.
Поверхностная пальпация живота позволяет установить степень напряжения мышц брюшной стенки (при обострении ХБХ повышается резистентность брюшной стенки в правом подреберье) и область наибольшей болезненности — правое подреберье.
Основное место в физикальном обследовании больного занимают глубокая пальпация и выявление болевых точек.
Характерным пальпаторным симптомом при воспалительном поражении желчного пузыря является болезненность в области проекции желчного пузыря при вдохе (симптом Кера).
Болезненность при поколачивании по правому подреберью (симптом Лепене), по реберной дуге справа (симптом Грекова—Ортнера) и при надавливании на диафрагмальный нерв между ножками грудино-ключично-сосцевидной мышцы (симптом Георгиевского—Мюсси, или френикус-симптом) также относятся к признакам, встречающимся чаще при обострении воспалительного процесса в желчном пузыре.
При неосложненном течении хронического холецистита желчный пузырь не пальпируется. Если же при пальпации желчный пузырь определяется, то это свидетельствует об осложнениях (водянка, эмпиема желчного пузыря). Увеличенный желчный пузырь может определяться при сдавлении общего желчного протока увеличенной головкой поджелудочной железы (хронический панкреатит, рак головки железы) или же при воспалительных (опухолевых) изменениях фатерова (дуоденального) соска, также обусловливающих нарушение оттока по общему желчному протоку.
При физикальном обследовании брюшной полости можно получить данные, свидетельствующие о вовлечении в процесс печени (увеличение ее размеров, изменение консистенции), поджелудочной железы (болезненность характерных зон и точек), желудка, толстой кишки.
Выявление экстрасистол (особенно у лиц молодого возраста) может быть свидетельством холецистокардиального синдрома.
При закупорке (слизистой пробкой или камнем) общего желчного протока может наблюдаться выраженная желтушность кожных покровов и слизистых оболочек. Субиктеричность склер, небольшая желтушность выявляются при обострении ХБХ без закупорки желчных путей.
Решающее значение для уточнения характера поражения желчного пузыря принадлежит III этапу диагностического поиска. На этом этапе-а) уточняют степень выраженности (активности) воспалительного процесса в желчном пузыре; б) выявляют нарушения липидного и пигментного оо-
^ена; в) уточняют степень вовлечения в патологический процесс печени, поджелудочной железы и других органов; г) выявляют функциональное состояние желчного пузыря (моторная, эвакуаторная, концентрационная функции); д) определяют наличие (или отсутствие) камней, развитие осложнений; е) ставят окончательный клинический диагноз.
Клинический анализ крови вне обострения патологии не выявляет; при обострении отмечаются лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ. При биохимическом исследовании крови обнаруживают повышение других острофазовых показателей (содержание ос2-глобу-тинов, уровень фибриногена). Биохимическое исследование крови позволяет выявить нарушение липидного обмена: увеличение содержания холестерина, триглицеридов.
Признаки холестаза — повышение содержания холестерина, связанного билирубина, ЩФ, ГГТ — характерны для обструкции общего желчного протока (слизистой пробкой или камнем).
При вовлечении в патологический процесс печени незначительно повышен уровень ACT, AJIT, при поражении поджелудочной железы выявляются стеато- и креаторея, в крови повышено содержание амилазы.
О выраженности воспалительного процесса в желчном пузыре можно судить по данным визуального осмотра желчи, полученной при дуоденальном зондировании. Порция В (пузырная желчь) при воспалении бывает мутной, с хлопьями и слизью. При микроскопическом исследовании этой порции в большом количестве обнаруживаются лейкоциты и десквамиро-ванный эпителий. Диагностическая значимость лейкоцитов в желчи невелика. Основное значение дуоденального зондирования заключается в установлении характера сократительной (эвакуаторной и моторной) функции желчного пузыря, определении концентрационной функции.
Отсутствие порции В свидетельствует о нарушении сократительной функции желчного пузыря (наблюдается не только при органических поражениях, но и при функциональных изменениях).
Получение пузырной желчи в количестве более 50—60 мл указывает на застойные явления в желчном пузыре и косвенно свидетельствует о его двигательных расстройствах.
Большое количество кристаллов холестерина, билирубината кальция может косвенно свидетельствовать о снижении стабильности коллоидного раствора желчи и указывать на предрасположенность к холелитиазу на фоне застоя инфицированной желчи. Обнаружение большого количества эозинофилов при микроскопическом исследовании желчи может косвенно Указывать на паразитарную инвазию.
Большую диагностическую значимость по сравнению с традиционным Дуоденальным зондированием придают непрерывному фракционному зонди рованию (проводится в специализированных стационарах), которое позволяет с большей достоверностью судить об изменениях в желчных путях и пузыре.
При бактериологическом исследовании желчи возбудитель обнаруживайся менее чем у 50 % больных. Этиологическое значение микроба подтверждается нарастанием титра антител в сыворотке крови к высеянному Из желчи возбудителю.
Более детально изучить функциональное состояние желчного пузыря и *елчных путей позволяет сочетание дуоденального зондирования с рентгенологическими методами обследования, среди которых главное место принадлежит пероральной холецистографии. У больных ХБХ в 1,5—2 раза медленнее происходит опорожнение желчного пузыря (неизмененный желч-
370
371

 ный пузырь контрастируется до 90 мин, при ХБХ — дольше). Затруднение смещаемости желчного пузыря, неровные контуры и неправильная форма изменение обычного расположения его и пр. служат основными рентгенологическими признаками перихолецистита. При ХБХ иногда выявляются расширение общего желчного протока, задержка в нем контрастированно-го вещества и рефлюкс в печеночный проток. Холецистограмма может быть не изменена, но это не исключает наличия холецистита, холангита или дискинезии желчных путей.
ный пузырь контрастируется до 90 мин, при ХБХ — дольше). Затруднение смещаемости желчного пузыря, неровные контуры и неправильная форма изменение обычного расположения его и пр. служат основными рентгенологическими признаками перихолецистита. При ХБХ иногда выявляются расширение общего желчного протока, задержка в нем контрастированно-го вещества и рефлюкс в печеночный проток. Холецистограмма может быть не изменена, но это не исключает наличия холецистита, холангита или дискинезии желчных путей.
У ряда больных желчный пузырь при холецистографии не контрастируется, что бывает в следующих случаях: при непроходимости желчных протоков вследствие наличия камней или воспалительного процесса; переполнении желчного пузыря камнями; при ослаблении концентрационной способности желчного пузыря.
Иногда отсутствие тени желчного пузыря не связано с его патологией а является нарушением всасывания контрастного вещества в кишечнике (при энтерите, усиленной перистальтике), иначе говоря, «отключенный» желчный пузырь при холецистографии еще не дает полного основания считать его патологически измененным.
Во всех случаях «отключенного» желчного пузыря производят внутри венную холеграфию. Холеграфия выявляет патологические изменения в общем желчном, пузырном и печеночных протоках, а также в большом сосочке двенадцатиперстной кишки (фатеров сосок). При холеграфии легче проследить процесс заполнения желчного пузыря контрастным веществом.
Отсутствие наполнения желчного пузыря при внутривенном введении контрастного вещества свидетельствует о значительных изменениях в жел-чевыделительной системе.
При наличии сморщенного атрофического желчного пузыря, заполнении его полости камнями, закупорке пузырного протока тень желчного пузыря может отсутствовать и при холеграфии, но выявляются общий желчный и печеночные протоки.
Отсутствие контрастирования желчного пузыря и протоков при внутривенной холеграфии наблюдается при желтухе, нарушении экскреторной функции печени, снижении тонуса сфинктера Одци и в некоторых других случаях.
Другие рентгенологические методы (чрескожное контрастирование желчных путей при помощи пункции печени, лапароскопическая холеци-стохолангиография, холангиография на операционном столе) проводят во время операции или в предоперационном периоде при обтурационной желтухе неясного генеза.
Этим же больным осуществляют фибродуоденоскопию, которая позволяет осмотреть большой сосочек двенадцатиперстной кишки и оценить его состояние. С помощью этого метода проводится и ретроградная панкреато- холангиография.
При тяжелых заболеваниях желчного пузыря и желчных путей, когда диагноз не удается поставить по данным клинических, лабораторных и рентгенологических методов исследования, производится лапароскопия. Она позволяет осмотреть желчный пузырь, печень и определить патологию.
Метод ультразвуковой диагностики (УЗИ) имеет большое значение для оценки формы желчного пузыря, состояния его стенок, наличия камней и спаек. После приема желчегонных средств можно судить о сократительной функции желчного пузыря. С помощью эхографии также выявляют расширенный желчный пузырь при патологии большого сосочка двенадцатиперстной кишки, головки поджелудочной железы.
Компьютерная томография (AT) не имеет существенных преимуществ по сравнению с УЗИ в диагностике конкрементов желчного пузыря, однако более точно, чем УЗИ, определяет кальцификацию конкрементов. Это важно для отбора больных для проведения литолитической терапии препаратами желчных кислот.
Диагностика. Диагноз хронического холецистита ставят на основании следующих признаков: 1) характерного болевого синдрома в сочетании с диспепсическими расстройствами; 2) признаков вовлечения в процесс желчного пузыря (болевые точки, зоны кожной гиперестезии); 3) данных лабораторных и инструментальных методов исследования, указывающих на патологию желчного пузыря и отсутствие камней.
Большая вариабельность клинической картины ХБХ, присоединение осложнений, вовлечение в патологический процесс других органов и систем делает диагностику ХБХ достаточно сложной.
Хронический бескаменный холецистит необходимо дифференцировать от желчнокаменной болезни и дискинезии желчного пузыря и желчных
путей.
Для желчнокаменной болезни характерны следующие признаки:
1) особенности болей, приступообразные, интенсивные, с транзиторной желтухой, типа печеночной колики;
2) чаще болеют лица пожилого возраста, среди которых преобладают женщины с ожирением и другими обменными заболеваниями (сахарный диабет, мочекаменная болезнь, артрозы), отягощенный семейный анамнез;
3) особенности дуоденального содержимого: большое количество кри
сталлов холестерина, билирубината кальция, «песок», холатохолестерино-
вый индекс менее 10;
4) выявление камней при рентгенологическом и/или ультразвуковом
обследовании.
Для дискинезии желчного пузыря характерны следующие
признаки:
1) связь болей с волнениями и нервно-психической нагрузкой;
2) болевые точки и зоны кожной гиперестезии, характерные для воспаления желчного пузыря, отсутствуют или выражены нерезко;
3) при дуоденальном зондировании отмечается лабильность пузырного рефлекса; воспалительные элементы в желчи, как правило, отсутствуют;
4) при холецистографии отсутствуют признаки перихолецистита.
Дискинезии желчного пузыря (нарушение его моторики) может проте
кать по гипотоническому и гипертоническому типу.
Дифференциация различных моторных нарушений желчного пузыря и желчевыводящих путей возможна на основании клинических признаков, Данных дуоденального зондирования, результатов рентгенологического исследования (холецистография).
• При гипертоническом типе дискинезии боли схваткообразные, кратковременные, отмечается связь болей с нарушением диеты; периодически возникают приступы желчной колики; может быть преходящая желтуха; в промежутках между приступами болей, как правило, не бывает. Для гипотонического типа дискинезии характерны постоянные боли, которые сопровождаются чувством распирания в правом подреберье. Периодически все эти явления усиливаются; боли нарастают при надавливании на желчный пузырь; приступы желчной колики крайне редки.
• Дуоденальное зондирование: при гипертонической дискинезии увеличено время выделения порции А (гипертония пузырного протока), Уменьшено время выделения порции В (гиперкинезия желчного пузыря)
при сохраненном объеме желчного пузыря или удлиненное, прерывистое выделение желчи («гипертония желчного пузыря»). Исследование часто сопровождается болями в правом подреберье. При гипотонической дискине-зии желчь порции В выделяется в большом количестве и долго, часто возникает повторный рефлекс на опорожнение желчного пузыря.
• Холецистография: при гипертонической дискинезии тень пузыря округлая; опорожнение замедлено («застойный гипертонический желчный пузырь») или ускорено («гиперкинетический желчный пузырь»). Для гипокинетической дискинезии характерен увеличенный пузырь продолговатой формы с замедленным опорожнением, несмотря на неоднократный прием желчегонных средств (например, яичных желтков).
Дискинезии желчного пузыря и желчных путей могут быть самостоятельной нозологической формой (так называемые первичные дискинезии), однако чаще они развиваются при хронических холециститах и желчнокаменной болезни (вторичные дискинезии).
Хронический холецистит редко остается изолированным заболеванием в течение длительного времени. Часто в патологический процесс вовлекаются остальные органы пищеварения (прежде всего печень). При формировании диагностической концепции необходимо уточнить характер их поражения.
Вместе с тем заболевания органов пищеварения нередко предшествуют развитию хронического холецистита, имеют сходные клинические синдромы и затрудняют раннюю диагностику ХБХ.
Формулировка развернутого клинического диагноза: 1) стадия болезни: обострение, стихающее обострение, ремиссия; 2) степень тяжести течения: легкая, средней тяжести, тяжелая; 3) характер течения: рецидивирующий, монотонный, перемежающийся; 4) состояние функции желчного пузыря: сохраненная функция, нефункционирующий или «отключенный» желчный пузырь; дискинезия — гипокинетический или гиперкинетический тип; 5) осложнения; 6) состояние других органов и систем (хронический гепатит, хронический панкреатит и пр.).
При обнаружении конкрементов в желчном пузыре целесообразно говорить о желчнокаменной болезни и указывать осложнения, связанные с миграцией камней.
Лечение. Терапия ХБХ определяется фазой течения процесса — обострение или ремиссия.
В фазе обострения следует уменьшить объем и калорийность пищи с последующим постепенным увеличением суточной калорийности. Рекомендуется частое дробное питание в одни и те же часы, что способствует лучшему оттоку желчи. Исключают жареные, соленые и копченые блюда, яичные желтки, экстрактивные вещества мяса и рыбы.
Для устранения болей назначают парентеральное введение но-шпы, га-лидора, папаверина, метоклопрамида. При выраженных болях используют баралгин (5 мл внутривенно или внутримышечно). При стихании болей переходят на прием перечисленных препаратов внутрь. Как правило, боли купируются в первые 1—2 нед от начала лечения, обычно терапия этими препаратами не превышает 3—4 нед.
Боли при ХБХ зависят не только от выраженных дискинетических расстройств желчного пузыря, сфинктеров билиарного тракта, но и от интенсивности воспалительного процесса в желчевыводящих путях. В связи с этим раннее применение антибактериальной терапии оказывается весьма эффективным. Так как определение чувствительности высеваемой из желчи микрофлоры к антибиотикам, как правило, невыполнимо, целесообраз-
ло в такой ситуации назначать антибиотики широкого спектра действия, не подвергающиеся в печени существенной биотрансформации. Исходя йз этого внутрь назначают антибиотики, проникающие в желчь в очень высоких концентрациях: эритромицин (по 0,25 г 6 раз в сутки), рифампи-цин (по 0,15 г 3 раза в сутки), линкомицин (внутрь по 0,5 г 3 раза в сут-р! за 1—2 ч до еды); антибиотики, проникающие в желчь в достаточно высоких концентрациях: доксициклина гидрохлорид (по 0,05—0,1 г 2 раза в сутки), метациклина гидрохлорид (0,3 г 2—3 раза в сутки). Лечение антибактериальными средствами проводят 8—10 дней. После 2—4-дневного перерыва целесообразно повторить лечение этими препаратами еще
7—8 дней.
В случае обнаружения паразитарной инвазии проводят соответствующую терапию. Так, при лямблиозе назначают метронидазол (по 0,25 г 3 раза в сутки после еды в течение 7 дней) или фуразолидон (по 0,15 г 3—4 раза в сутки).
Назначение антибактриальных препаратов не исключает необходимости проведения комплексного лечения с использованием спазмолитических, желчегонных препаратов, а также физиотерапевтических процедур.
Спазмолитики устраняют спазм желчных путей, облегчают отток желчи и тем самым ликвидируют болевой синдром. В случае редких болевых приступов эти препараты применяют эпизодически. При длительных болях рекомендуется прием препаратов в течение 2—4 нед. Используют премущест-венно миотропные спазмолитики: но-шпа (2 мл внутримышечно или внутрь по 0,04 г 2—3 раза в сутки), бензиклан (2,5 % внутримышечно или внутрь по 0,1—0,2 г 2—3 раза в сутки).
Применение желчегонных препаратов противопоказано в период обострения при выраженных воспалительных процессах в желчном пузыре и желчных протоках. Их назначают при стихании воспалительного процесса или в межприступный период.
Желчегонные препараты — холеретики (средства, стимулирующие образование желчи) используют в фазу ремиссии у больных с признаками гипертонической дискинезии желчного пузыря. Используют препараты, содержащие желчь или желчные кислоты — аллохол по 1 таблетке 3 раза в день после еды; холензим по 1 таблетке 3 раза в день до еды; ряд синтетических веществ — оксафенамид по 0,25 г 3 раза в день, никодин по 0,5 г 3 раза в день до еды; препараты растительного происхождения — фламин (сухой концентрат бессмертника) по 0,05 г 3 раза в день за 30 мин До еды, отвар кукурузных рыльцев по 10 г на 200 мл воды, принимать по 'А стакана 3—4 раза в день за 15 мин до еды.
Если же имеется гипотоническая дискинезия желчного пузыря, то назначают холекинетики (препараты, усиливающие мышечное сокращение желчного пузыря и способствующие выделению желчи в кишечник). Такой подход обусловлен тем, что у многих больных ХБХ в фазе обратного Развития воспалительного процесса наблюдается растяжение желчного пузыря с повышением тонуса сфинктера Люткенса, что и приводит к застою Желчи в желчном пузыре. К холекинетикам относят сорбит или ксилит U0 % раствор по 50—100 мл 2—3 раза в день за 30 мин до еды в течение 1—2 мес), сульфат магния (25 % раствор по 1 столовой ложке натощак в течение 10 дней), карловарская соль (1 чайная ложка на стакан воды за •W мин до еды).
Курс лечения желчегонными средствами после обострения ХБХ составляет 10—30 дней в зависимости от получаемого эффекта. После такой те-Рапии остаточные явления обострения ликвидируются.
474
375
В фазе стихающего обострения ХБХ на область правого подреберья п комендуют грелку, горячие припарки из овса или льняного семени, апптгГ кации парафина, озокерита, торфа, назначают диатермию, индуктотермй>Г
Больным с холестериновыми камнями проводят лекарственное раств рение камней при помощи препаратов хенодезоксихолевой (хенофальк) °~ урсодезоксихолевой кислот (урсофальк). Урсофальк назначают в течениИ нескольких месяцев в суточной дозе от 10 мг/кг (2—5 капсул или 10—25 xf суспензии соответственно) до 12—15 мг/кг. Хенофальк принимают внуто перед сном, не разжевывая, по 15 мгДкгсут), курс лечения от 3 мес д 2 лет. Лекарственное растворение камней можно проводить, если диаметп камней не более 10—15 мм, желчный пузырь наполнен камнями не более чем на Уз, сохранены функция желчного пузыря и проходимость общего и пузырного протоков.
Два-три раза в неделю больным при наличии гипотонической дискине-зии проводится лечебное дуоденальное зондирование или тюбаж без зонда с сульфатом магния (сернокислая магнезия) — 1/2 столовой ложки на полстакана воды или с минеральной водой. Сернокислую магнезию не применяют при гиперкинетической дискинезии. Лечебное дуоденальное зондирование показано при отсутствии камней в желчном пузыре.
При бескаменных холециститах иногда приходится прибегать к операции, что показано: а) при упорном течении заболевания с сохраненной функцией желчного пузыря, но имеющимися спайками, деформацией, пери-холециститом; б) при «отключении» желчного пузыря или резко деформированном пузыре даже при отсутствии резких болей; в) в случае присоединения трудно поддающихся терапии хронического панкреатита, холангита.
В фазе ремиссии лечение включает соблюдение диеты, прием желчегонных препаратов, занятия ЛФК (утренняя гимнастика и дозированная ходьба), прием маломинерализованных щелочных вод, санаторно-курортное лечение на бальнеологических курортах с минеральными водами.
Прогноз. При нечастых обострениях прогноз удовлетворительный. Он значительно ухудшается при частых обострениях с признаками активности воспалительного процесса, выраженном болевом синдроме и развитии реактивного панкреатита.
Профилактика. С профилактической целью рекомендуют рациональное питание, активный образ жизни, физкультуру. Необходимо своевременное и рациональное лечение острого холецистита, заболеваний пищеварительного тракта, очаговой инфекции, интоксикаций, аллергозов, невротических и обменных нарушений.
Хронический панкреатит
ХРОНИЧЕСКИЙ ПАНКРЕАТИТ (ХП) - воспалительно-дистрофическое заболевание железистой ткани поджелудочной железы с нарушением проходимости ее протоков; финальной стадией является склероз паренхимы органа с утратой его экзокринной и эндокринной функций.
ХП является прогрессирующим, хронически протекающим заболевая ем поджелудочной железы. В начальной стадии заболевания преобладаю явления отека, некроза и серозного воспаления паренхимы железы и протоков, в конечной стадии ацинозные клетки погибают, заменяясь с единительной тканью. Склеротические изменения приводят также к о0^е_ терации протоков и образованию кист с обызвествлением самой ткани лезы и формированием камней в оставшихся протоках железы. Все Р 376
тессЫ приводят к уменьшению размеров железы, приобретающей хря-
пр^ю консистенцию.
| Р |
Различают первичные ХП, при которых патологический процесс с са-начала локализуется в поджелудочной железе, и так называемые вто-М°Гные (или сопутствующие), постепенно развивающиеся на фоне ранее Чествовавших заболеваний органов пищеварения (хронического гастри-с- звеННой болезни, хронического холецистита и др.). TS' Частота выявления ХП составляет 3,4—5 на 100 000 населения в год. ■г болевание обычно начинается в среднем возрасте (35—50 лет). 1 Этиология. Причины развития ХП достаточно разнообразны:
1) употребление алкоголя, особенно у мужчин; доказано, что употреб
ив ЧИСТОго алкоголя в суточной дозе 80—120 мл на протяжении
3 Ю лет приводит к развитию ХП;
2) заболевания желчевыводящей системы (желчнокаменная болезнь,
хронический холецистит, дискинезии) — у 25—40 % больных (в основном
у женщин);
3) заболевания зоны большого дуоденального сосочка;
4) рацион с резким ограничением белка (менее 50 г) и жира (менее 30 г)
в сутки;
5) наследственные нарушения обмена аминокислот, вызывающие развитие особой формы ХП (семейного);
6) гиперлипидемия.
Наиболее частой причиной ХП является хроническая алкогольная; следующая по частоте причина — патология желчевыводящих путей.
Патогенез. Одним из главных механизмов реализации многочисленных этиологических факторов при ХП является задержка выделения и внутри-органная активация панкреатических ферментов, в первую очередь трипсина и липазы, осуществляющих постепенный аутолиз паренхимы железы. Подобная активация ферментов возможна лишь при условии нарушения целого ряда защитных механизмов, предохраняющих в норме поджелудочную железу от самопереваривания; к этим механизмам относятся: 1) неизмененный метаболизм ацинозных клеток, так как неповрежденную клетку панкреатические ферменты не повреждают; 2) достаточное содержание ингибиторов ферментов в ткани железы; 3) щелочная среда ткани железы;
4) достаточное образование слизи эпителиальными клетками протоков;
5) неизмененный лимфоотток от железы; 6) нормальный отток панкреатического сока.
Конкретные механизмы активации ферментов при тех или иных этиологических факторах отличаются друг от друга.
При заболеваниях желчных путей возникает рефлюкс желчи в проток
поджелудочной железы, вследствие чего происходит «внутрипротоковая»
активация ферментов. Рефлюкс может сочетаться с повышением внутри-
протокового давления вследствие патологии сфинктера Одди. Сама по себе
нутрипротоковая гипертензия повреждает базальные мембраны ацинусов,
то облегчает процесс самопереваривания.
Прием алкоголя стимулирует продукцию секретина, вызывающего усилие панкреатической секреции с одновременным повышением внутри-потокового Давления. После приема алкоголя развивается преходящий 5 ек стенки двенадцатиперстной кишки и сфинктера Одди, что в еще льщей степени повышает внутрипротоковое давление. Если одновремен-Ни пРинимают пищу с большим содержанием жира, то вследствие усиле-до се„кРеЦии панкреозимина концентрация ферментов в секрете поджелу-чной железы резко возрастает.
377
|
|
378
При заболеваниях, сопровождающихся недостаточной выработкой сек ретина, давление внутри протоков повышается вследствие замедленног оттока секрета, что также вызывает всасывание жидкой части секрета и по° вышение концентрации белковых веществ в секрете. В свою очередь эт приводит к преципитации этого белка и образованию белковых пробой частично или полностью обтурирующих протоки.
При атеросклерозе мезентериальных сосудов и нарушении кровоснаб жения железы, а также при белковом голодании основным патогенетиче" ским механизмом оказываются процессы нарушения метаболизма ацину" сов, развитие атрофии и последующее разрастание соединительной ткани
С позиций патогенеза выделяют два варианта ХА:
• кальцифицирующий:
— алкогольный;
— тропический (связанный с белковой недостаточностью и употреблением потенциально токсических веществ, содержащихся в некоторых пищевых продуктах растительного происхождения;
— наследственный;
— при гиперпаратиреозе;
— идиопатический (ювенильный и старческий);
• обструктивный:
— желчнокаменная болезнь;
— стеноз большого дуоденального сосочка;
— травматический;
— аномалии вирсунгова протока.
Дата: 2018-12-28, просмотров: 382.