Задание 1. Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ с инертными электродами. Значения электродных потенциалов металлов приведены в таблице
|
| 1. LiBr | 11. Al2(SO4)3 | 21. NaOH |
| 2. K3PO4 | 12. Ca(NO3)2 | 22. ZnSO4 |
| 3. Ba(NO3)2 | 13. K2SO4 | 23. Na2CO3 |
| 4. CuCl2 (с Сu анодом) | 14. KMnO4 | 24. Ba(NO2)2 |
| 5. FeBr2 | 15. ZnCl2 | 25. MgCl2 |
| 6. K2CO3 | 16. NiSO4 | 26. CoBr2 |
| 7. СоCl2 | 17. BeSO4 | 27. NiSO4 (c Ni анодом) |
| 8. AgNO3 | 18. Mg(NO3)2 | 28. NaNO2 |
| 9. BaCl2 | 19. KOH | 29. KI |
| 10. Bi(NO3)3 | 20. CaI2 | 30. NaCl |
Примеры решения и оформления заданий
К разделу 11
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
K2SO4 = 2K + + SO42-
| (-) Kатод K+, H2O | (+) Aнод SO4 2-, H2O |
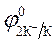 = - 2,92 B ; = - 2,92 B ; 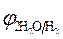 = -1 B.
Так как = -1 B.
Так как  > > 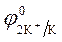 ,
происходит восстановление воды: 2 H 2 O +2ē = H 2 + 2 OH -
Среда щелочная ,
происходит восстановление воды: 2 H 2 O +2ē = H 2 + 2 OH -
Среда щелочная
| Сульфат-ионы не разряжаются, т. к. сера находится в высшей степени окисления.
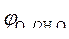 » 1,8 B.
2 H 2 O - 4ē = O 2 + 4 H +
Среда кислая » 1,8 B.
2 H 2 O - 4ē = O 2 + 4 H +
Среда кислая
|
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами: SnCl 2 = Sn 2+ + 2Cl –
| (-) Kатод Sn 2 + , H 2 O | (+) Aнод Cl - , H 2 O |
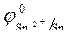 = - 0,136 B ; = - 0,136 B ;
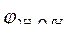 = -1B.
Так как = -1B.
Так как 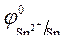 > > 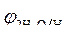 ,идет процесс восстановления ионов олова: Sn 2+ + 2ē = Sn . ,идет процесс восстановления ионов олова: Sn 2+ + 2ē = Sn .
| 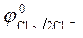 = 1,36 В ; = 1,36 В ; 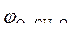 » 1,8 B
Так как » 1,8 B
Так как 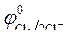 < < 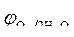 , идет
процесс окисления ионов Сl -:
2 Cl - - 2ē = Cl 2 . , идет
процесс окисления ионов Сl -:
2 Cl - - 2ē = Cl 2 .
|
Пример 3. Электролиз сульфата меди с медным анодом:
CuSO4 = Cu2+ + SO42-
| (-) Kатод Cu 2+, H2O | (+) Aнод С u, SO4 2-, H2O |
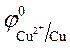 = + 0,34 B ; = + 0,34 B ;
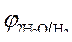 = -1 B.
Так как = -1 B.
Так как 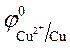 > > 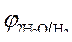 , происходит восстановление ионов меди: Cu 2+ +2ē = Cu . , происходит восстановление ионов меди: Cu 2+ +2ē = Cu .
| 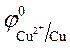 = + 0,34 B; = + 0,34 B;
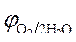 » 1,8 B.
Сульфат-ионы не разряжаются.
Так как » 1,8 B.
Сульфат-ионы не разряжаются.
Так как 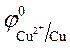 < < 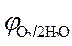 ,
анод растворяется:
Cu - 2ē = Cu 2+ . ,
анод растворяется:
Cu - 2ē = Cu 2+ .
|
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем в 1834 г. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
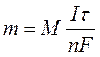 ,
,
где m - масса образовавшегося вещества , г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формула принимает вид:
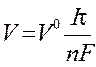 ,
,
где V- объем газа, выделяющегося на электроде, л
V 0 - объем 1 моль газообразного вещества при нормаль ных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4 А.
Решение


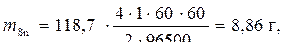
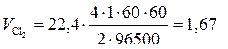 л.
л.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н. В. Общая химия: учебник для вузов /Н. В. Коровин. – 3-е изд., испр. – М.: Высшая школа, 2002. – 558 с.
2. Угай А. Я. Общая и неорганическая химия: учебник для вузов /А. Я. Угай. – 4-е изд., испр. – М.: Высшая школа, 2000. – 527 с.
3. Гельфман М. И. Химия: учебник для студентов, обучающихся по техни-ческим специальностям и направлениям / М. И. Гельфман, В. П. Юстратов. – 3-е изд., стер. – СПб.; М.; Краснодар: Лань, 2003. – 480 с.
4. Глинка Н. Л. Общая химия: учеб. пособие для вузов /Н. Л. Глинка; под ред. А. И. Ермакова. – 30-е изд., испр. – М.: Интеграл-ПРЕСС, 2004. – 728 с.
5. Глинка Н. Л. Задачи и упражнения по общей химии: учеб. пособие для студентов нехимических специальностей /Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубинной. – 26-е изд., испр. – М.: Интеграл–ПРЕСС, 2004. – 204 с.
6. Краткий справочник физико-химических величин / под ред. А. Равделя, А. М. Пономаревой. – Л.: Химия, 1986. – 232 с.
ПРИЛОЖЕНИЕ 1
Таблица П. 1.1.
Дата: 2018-11-18, просмотров: 1201.