Существуют разные методы составления уравнений ОВР. Для реакций, протекающих в растворах электролитов, используют метод электронно-ионного баланса. Рассматривают реакции в кислой, щелочной и нейтральных средах. Важно учитывать, что при составлении уравнений этим методом соблюдаются правила написания ионных уравнений.
ОВР в кислой среде
Как правило, кислая среда создается путем добавления разбавленной H2SO4:
K2Cr2O7 + Na2SO3 + H2SO4 ® Cr3+ + SO42-
Рассмотрим порядок расстановки коэффициентов:
1. Записываем левую часть уравнения в ионном виде согласно правилам написания ионных уравнений:
2K+ + Cr2O72- + 2Na+ + SO32-+ 2H+ + SO42- ® Cr3+ + SO42-
Такая запись необходима для того, чтобы увидеть реально существующие частицы в растворе и использовать их при составлении полуреакций.
2. Рассчитываем степени окисления тех элементов, которые ее изменяют, и определяем окислитель и восстановитель:
+6 +4 +6
K2Cr2O7 + Na2SO3 + H2SO4 ® Cr3+ + SO42-
окислитель восстан. Среда
3. Записываем схемы полуреакций для реально существующих частиц:
+6
(Cr2O7)2- ® Cr3+ ,
+4 +6
SO32-® SO42-
4. Уравниваем число атомов элементов, изменяющих степень окисления:
+6
(Cr2O7)2- ® 2Cr3+
+4 +6
SO32- ® SO42-
5. Записываем число электронов, отданных восстановителем и принятых окислителем:
+6
(Cr2O7)2- +6е ® 2Cr3+ ,
+4 +6
SO32- –2е ® SO42-.
6. Уравниваем число атомов кислорода в левой и правой частях полуреакций. При этом учитываем, что в кислой среде присутствуют ионы Н+ и молекулы Н2О, в состав которых входят атомы кислорода.
Правило: в кислой среде в ту часть уравнения полуреакций, в которой недостает n атомов кислорода, добавляем n молекул Н2О, а в противоположную часть записываем 2n ионов Н+:
+6
(Cr2O7)2- +6е +14Н+ ® 2Cr3+ + 7Н2О;
+4 +6
SO32- –2е +Н2О ® SO42- + 2Н+.
7. Учитывая, что суммарное количество отданных и принятых электронов должно быть равно (принцип электронного баланса), умножаем первое уравнение на два, второе – на шесть и сокращаем на общий множитель – два:
  1 1
| 2 | Cr2O72- +6е +14Н+ ® 2Cr3+ + 7Н2О |
| 3 | 6 | SO32- –2е +Н2О ® SO42- + 2Н+ |
8. Умножаем каждый член первой полуреакции на 1 , второй – на 3 и суммируем:
Cr2O72-+ 3SO32- + 14Н+ +3Н2О ® 2Cr3+ + 3SO42- +6Н+ + 7Н2О
9. Приводим подобные члены (те частицы, которые вводили, - Н+ и Н2О) и получаем краткое ионное уравнение реакции:
Cr2O72-+ 3SO32- + 8Н+ + ® 2Cr3+ + 3SO42- + 4Н2О
10. Переписываем левую часть заданного молекулярного уравнения реакции и ставим полученные коэффициенты перед соответствующими формулами:
K2Cr2O7 + 3Na2SO3 + 4H2SO4 ® Cr3+ + SO42-
Обратите внимание на то, что в правой части были заданы частицы Cr3+ и SO42-, а мы получили их с коэффициентами 2Cr3+ и 3SO42-, а также 4Н2О.
11. При написании правой части уравнения для каждого иона подбираем противоион из левой части уравнения (см. пункт 1), составляем формулу вещества, а затем перед молекулой ставим соответствующий коэффициент. Если в правой части задана или получилась нейтральная частица, то она, естественно, ни с чем не соединяется и переписывается с полученным коэффициентом.
Обратите внимание на то, что в левой части уравнения (пункт 1) в результате протекания ОВР исчезли ионы Cr2O72-, перешедшие в Cr3+, и частицы SO32-, перешедшие в SO42-. Поэтому ионы Cr3+ нужно соединить с SO42- в молекулу Cr2(SO4)3 (соответственно 2Cr3+, полученные в правой части уравнения (пункт 9)), а ионы SO42- соединяем с ионами Na+. Все атомы водорода из левой части (8 атомов) содержатся в 4Н2О, полученных в правой части:
K2Cr2O7 + 3Na2SO3+ 4H2SO4 ® Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4Н2О
12. В конце проверяем количество атомов кислорода (и остальных элементов) справа и слева.
ОВР в щелочной среде
Обычно среда создается добавлением гидроксида натрия или калия. В этой среде присутствуют ионы ОН- и молекулы Н2О и, в отличие от кислой среды, нет ионов Н+, поэтому в полуреакциях также не должно быть Н+!
Правило для щелочной среды:
Недостающие в правой или в левой части n атомов кислорода вводим 2n гидроксид-ионов (ОН-), а в противоположную часть полуреакции записываем n молекул Н2О.
ОВР в нейтральной среде
В нейтральной среде применяются правила уравнивания атомов кислорода для кислой и щелочной среды. Эти правила используют так, чтобы в левых частях обеих полуреакций получились молекулы воды, а в правых – ионы Н+ и ОН-. Это возможно, если недостающие атомы кислорода в левой части полуреакций восполнять молекулами воды, а недостающие атомы кислорода в правой части задавать удвоенным числом ОН--групп.
Сказанное выше можно представить в виде таблицы:
Правила использования среды
| Процессы | Среда в окислительно-восстановительных реакциях в расчете на «О2– »в соединении | ||
| кислая (Н+) | щелочная (ОН-) | нейтральная (Н2О) | |
| Связывание «О2– » NO3–® NO2– | О2– + 2Н+ = Н2О | О2– + Н2О = 2ОН– | О2– + Н2О = 2ОН– |
| Ввод «О2–» SO32– ® SO42– | Н2О = О2– + 2Н+ | 2ОН – = О2– + Н2О | Н2О = О2– + 2Н+ |
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
На границе металл-раствор возникает электрохимический потенциал, называемый электродным. В данном случае металлический электрод непосредственно участвует в реакции
Me – ne 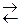 Men+ .
Men+ .
Величина потенциала зависит от природы, концентрации веществ, участвующих в электродном процессе, от температуры и находится по уравнению Нернста:
j = j0 + 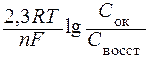 ,
,
где j 0 – стандартный потенциал, В;
R – универсальная газовая постоянная (8,31 Дж/(моль·К));
Т – абсолютная температура, К;
n – число электронов, участвующих в электродном процессе;
F – число Фарадея (96500 Кл/моль);
Сок и Свосст – произведения концентраций (активностей) веществ, моль/л, принимающих участие в соответствующей полуреакции в окисленной и восстановленной формах.
После подстановки значений R, F и T = 298 К в данную формулу электродный потенциал металла в растворе его соли можно рассчитать по формуле
j = j0 + 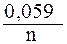 lg [Men+].
lg [Men+].
Из двух электродов, погруженных в раствор своей соли, можно составить систему, которая называется гальваническим элементом. В нем химическая энергия ОВР превращается в электрическую. Электрод, имеющий меньшее значение потенциала в конкретной паре электродов, называется анодом (–), на нем идет процесс окисления, т. е. отдачи электронов. Электрод, имеющий большее значение потенциала, называется катодом (+), на нем протекает процесс восстановления, т. е. приема электронов.
В схеме записи гальванического элемента слева принято записывать анод.
Электродвижущая сила (ЭДС) гальванического элемента – это равновесная разность потенциалов между катодом и анодом, которая всегда положительна по величине.
Пример. Рассмотрим работу и вычислим ЭДС железомедного гальванического элемента Fe / FeSO4 // CuSO4 0,01М / Cu. Вычислим электродные потенциалы и установим роль каждого из электродов.
Решение.
Поскольку концентрация раствора FeSO4 не указана, то она принимается стандартной, т. е. 1 моль/л. Тогда jFe2+/Fe = j0Fe2+/Fe = – 0,44 B (см. таблицу стандартных потенциалов в приложении 1 табл. 1. 5.).
Для расчета электродного потенциала медного электрода воспользуемся уравнением Нернста:
jCu2+/Cu = j0 Cu2+/Cu + 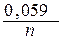 lg [Cu2+] = 0,34 +
lg [Cu2+] = 0,34 +  lg0,01 = 0,34 – 0,059 = 0,281 B.
lg0,01 = 0,34 – 0,059 = 0,281 B.
Сравнивая величины электродных потенциалов, выясняем, что медный электрод является катодом, а железный – анодом (jк > jа).
На аноде идет процесс окисления:
А (-): Fe0 – 2ē = Fe2+.
На катоде идет процесс восстановления:
К(+): Cu2+ + 2ē = Cu0.
Дата: 2018-11-18, просмотров: 762.