Задание 1 Укажите, к какому классу неорганических веществ относятся приведенные в задании соединения.
Задание 2 Напишите в молекулярной форме уравнения возможныx реакций предложенных веществ с H2O, KOH и HNO3 (разб.).
| 1 | N2O3, Li2O; | HCl, Cr(OH)3 |
| 2 | SnO, P2O5; | Cd(OH)2, H2S |
| 3 | MgO, Al2O3; | Cu(OH)2, HBr |
| 4 | SO3, CaO; | H2SO3, Sn(OH)2 |
| 5 | SiO2, NiO; | H2SiO3, Pb(OH)2 |
| 6 | PbO, N2O5; | CH3COOH, KOH |
| 7 | SO2, CuO; | H2Se, Zn(OH)2 |
| 8 | Cr2O3, Cl2O7; | Fe(OH)2, H3AsO3 |
| 9 | CoO, ZnO; | RbOH, HI |
| 10 | P2O3, FeO; | H2Te, Al(OH)3 |
| 11 | BeO, CO2; | Ca(OH)2, HCN |
| 12 | Fe2O3, K2O; | HNO3, Be(OH)2 |
| 13 | MnO, P2O5; | H2SO3, Sn(OH)4 |
| 14 | BaO, Mn2O7; | H3PO4, Ga(OH)3 |
| 15 | CdO, SnO2; | HF, Be(OH)2 |
| 16 | As2O3, CuO; | NaOH, H2CO3 |
| 17 | Al2O3, SiO2; | NH4OH, HClO4 |
| 18 | N2O5, TiO2; | Pb(OH)4, HNO2 |
| 19 | PbO2, MgO; | Mg(OH)2, HClO |
| 20 | As2O5, NiO; | Ga(OH)3, HMnO4 |
| 21 | FeO, Sb2O3; | H3BO3, Mo(OH)2 |
| 22 | BaO, CO2; | Be(OH)2, HBrO |
| 23 | Mn2O7, Cs2O; | Al(OH)3, H2Cr2O7 |
| 24 | CaO, Cl2O; | Cr(OH)3, H3PO3 |
| 25 | CrO, Sb2O5; | RbOH, H2S |
| 26 | Li2O, Br2O; | NH4OH, HClO4 |
| 27 | Na2O, CO; | Ni(OH)2, HCl |
| 28 | MnO, ZnO; | CsOH, H2Te |
| 29 | SrO, CrO3; | Sb(OH)3, H2SO4 |
| 30 | SO3, TiO2; | Sr(OH)2, H3PO3 |
Пример решения и оформления задания раздела 3
Пример. Укажите, к какому классу неорганических веществ относятся указанные в задании соединения.
Na2O – оксид (основной);
MoO3 – оксид (кислотный);
HNO3 – сильная кислота;
Be(OH)2 – амфотерный гидроксид.
Пример. Напишите в молекулярной форме уравнения возможныx реакций предложенных веществ с H2O, KOH и HNO3 (разб.).
1. Na2O + H2O → 2NaOH
Na2O + KOH ≠
Na2O + 2HNO3 → 2NaNO3 + H2O
2. N2O5 + H2O → 2HNO3
N2O5 + 2KOH → 2KNO3 + H2O
N2O5 + HNO3 ≠
3. HNO3 + H2O ≠
HNO3+ KOH → KNO3 + H2O
HNO3 + HNO3 ≠
4. Be(OH)2 + H2O ≠
Be(OH)2 + 2KOH → K2BeO2 + 2H2O
Be(OH)2 + 2HNO3 → Be(NO3)2 + 2H2O
Тема 4 «Растворы электролитов»
Задание 1. Приведите название солей. Напишите уравнения их диссоциации.
| 1 | NiOHCl, NiBr2, NaH2PO4 |
| 2 | CaCl2, (CoOH)2SO4, KHCO3 |
| 3 | BaSO4, Cа(HCO3)2, AlOHCl2 |
| 4 | CaBr2, (SnOH)2SO4, K2HPO4 |
| 5 | NaHSe, CoOHNO3, MgCl2 |
| 6 | Al2(SO4)3, CrOHCl2, KHSO3 |
| 7 | Fe(NO3)3, SnOHNO3, NaHTe |
| 8 | Mn(NO3)2, Bi(OH)2Cl, KHS |
| 9 | ZnCl2, MnOHCl, Ba(HSO3)2 |
| 10 | KHSO3, (PbOH)2SO4, CrBr3 |
| 11 | AlOHBr2, Sr(HS)2, K2SO3 |
| 12 | FeCl2, NaH2AsO4, KCrO2 |
| 13 | Cu(NO3)2, CoOHCl, NaHS |
| 14 | CrOHSO4, SrBr2, CsHSO3 |
| 15 | NaHSe, NiOHNO3, ZnSO4 |
| 16. | CdOHBr, Ni(NO3)2, NaHCO3 |
| 17. | Pb(HSO4)2, NH4NO3, CoOHCl |
| 18. | K2HAsO3, AlOHCl2, K2CO3 |
| 19. | Al(OH)2NO3, Fe2(SO4)3, KHSe |
| 20. | CsHTe, Ca3(PO4)2, MnOHBr |
| 21 | CuOHCl, Ca(H2PO4)2, Rb2SO4 |
| 22 | Ba(HSe)2, ZnCl2, (NH4)2SO4 |
| 23 | FeCl2, Al(NO3)3, (MnOH)2SO4 |
| 24 | FeCl3, NH4HSO3, (CoOH)2SO4 |
| 25 | Fe2(SO4)3, RbHCO3, FeOHSO4 |
| 26 | BeCl2, Ca(HCO3)2, CoOHCl |
| 27 | NH4Cl, NH4HSO3, FeOHCl |
| 28 | (NH4)2CO3, K2HAsO3, BiCl3 |
| 29 | NH4H2AsO3, ZnOHCl, BaSO4 |
| 30 | Be(NO3)2, K2SnO2, BiOHCl2 |
Задание 2. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений:
1. Ni(OH)2 ® (NiOH)2SO4 ® NiSO4 ® Ni(OH)2
2. CuSO4 ® (CuOH)2SO4 ® Cu(OH)2 ® CuOHNO3
3. Bi(NO3)3 ® BiOH(NO3)2 ® Bi(OH)3 ® Bi2O3
4. Co(OH)2 ® CoOHCl ® CoCl2 ® Co(NO3)2
5. Pb(NO3)2 ® PbOHNO3 ® Pb(OH)2 ® K2PbO2
6. NiCl2 ® Ni(OH)2 ®NiOHCl ® NiCl2
7. CrOHCl2 ® CrCl3 ® Cr(OH)3 ® CrOHSO4
8. (SnOH)2SO4 ® SnSO4 ® Sn(OH)2 ® Na2SnO2
9. NiBr2 ® NiOHBr ®Ni(OH)2 ® NiSO4
10. CoSO4 ® Co(OH)2 ® (CoOH)2SO4 ® Co(NO3)2
11. [Cr(OH)2]2SO4 ® CrOHSO4 ® Cr2(SO4)3 ® CrCl3
12. NiSO4 ® (NiOH)2SO4 ® Ni(OH)2 ® NiBr2
13. FeOHSO4 ® Fe2(SO4)3 ® Fe(OH)3 ® FeCl3
14. NiBr2 ® Ni(OH)2 ® NiOHCl ® NiCl2
15. Al(OH)3 ® Al(OH)2Cl ® AlCl3 ® Al(NO3)3
16. Sn(OH)2 ® SnOHCl ® K2SnO2 ® Sn(OH)2
17. CoCl2 ® Co(OH)2 ® (CuOH)2SO4 ® CoSO4
18. Bi(OH)3 ® Bi(OH)2NO3 ® Bi(OH)3 ® Bi2O3
19. Cu(OH)2 ® CuOHCl ® CuCl2 ® Cu(NO3)2
20. CoSO4 ® (CoOH)2SO4 ® Co(OH)2 ® Co(NO3)2
21. Ni(NO3)2 ® NiOHNO3 ® Ni(OH)2 ® (NiOH)2SO4
22. Bi(OH)2NO3 ® Bi(NO3)3 ® Bi(OH)3 ® Bi(NO3)3
23. Cr2(SO4)3 ® CrOHSO4 ® Cr(OH)3 ® K3CrO3
24. SnCl2 ® SnOHCl ® Na2SnO2 ® Sn(OH)2
25. Pb(NO3)2 ® Pb(OH)NO3 ® Pb(OH)2 ® K2PbO2
26. Na2CO3 ® NaHCO3 ® H2CO3 ® K2CO3
27. AlCl3 ® Al(OH)3 ® Al(OH)2Cl ® Al(NO3)3
28. MgO ® Mg(NO3)2 ® Mg(OH)2 ® MgCl2
29. Na2S ® NaHS ® Na2S ® H2S
30. H2SO3 ® KHSO3 ® K2SO3 ® H2SO3
Задание 3. По заданным ионным уравнениям напишите соответствующие молекулярные
| 1. Ca2+ + SO32- = CaSO3 | 16. S2- + H+ = HS- |
| 2. H+ + OH- = H2O | 17. Cd2+ + Br- + OH- = CdOHBr |
| 3. Co2+ + OH- + Cl- = CoOHCl | 18. Zn2+ + 4OH- = ZnO22- + 2H2O |
| 4. Al3+ + 3OH- = Al(OH)3 | 19. Bi3+ + 3OH- = Bi(OH)3 |
| 5. HSO3- + OH- = SO32- = H2O | 20. Cu2+ + S2- = CuS |
| 6. Ag+ + Br - = AgBr | 21. H+ + CO32- = HCO3- |
| 7. Co2+ + S2- = CoS | 22. Fe2+ + 2OH- = Fe(OH)2 |
| 8. Be2+ + 4OH- = BeO22- + 2H2O | 23. 2Cu2+ + SO42- + 2OH- = (CuOH)2SO4 |
| 9. 2H+ + SO32- = H2SO3 | 24. Al3+ + PO43- = AlPO4 |
| 10. Ni2+ + Cl- + OH- = NiOHCl | 25. 2I- + Pb2+ = PbI2 |
| 11. 3Cu2+ + 2PO43- = Cu3(PO4)2 | 26. 3Ca2+ + 2PO43- = Ca3(PO4)2 |
| 12. Fe3+ + 2NO3- + OH- = FeOH(NO3)2 | 27. Co2+ + CO32- = CoCO3 |
| 13. Sr2+ + SiO32- = SrSiO3 | 28. Fe2+ + S2- = FeS |
| 14. CuO + 2H+ = H2O +Cu2+ | 29. FeO + 2H+ = H2O + Fe2+ |
| 15. Mg2+ + SO32- = MgSO3 | 30. Zn2+ + NO3- + OH- = ZnOHNO3 |
Примеры решения задач и оформления задания
Раздела 4.
Пример 1: Приведите название солей. Напишите уравнения их диссоциации.
Al(OH)2Cl – основная соль, дигидроксохлорид алюминия.
Al(OH)2Cl → Al(OH)2Clр-р → Al(OH)+ + Cl–
осадок
Al(OH)+ Û AlOH2+ + OH–
AlOH2+Û Al3+ + OH–
NH4NO3 – средняя соль, нитрат аммония.
NH4NO3 → NH4+ + NO3–
Са(HCO3)2 – кислая соль, гидрокарбонат кальция.
Са(HCO3)2 → Са2+ + 2HCO3–
HCO3– Û H+ + CO32–
Пример 2: Осуществить превращения NаОН ® NаНSО3 ® Nа2SO3 . Решение. NаОН + Н2SO3 = NаНSO3 + Н2O
ОН– + Н2SO3 = НSО3– +Н2О
NаHSO3 +NаОН = Nа2SO3 + Н2O
НSО3– + ОН – = SO32 – + Н2О
Пример 3. Осуществить превращения Ni(ОН)2 ® (NiOH)2SO4 ® NiSO4.
Решение. 2Ni(ОH)2 + Н2SO4 = (NiOН)2SO4 + 2Н2O
2Ni(ОН)2 + 2Н+ + SO42 – = (NiОН)2SO4 + 2Н2O
(NiОН)2SO4 + Н2SO4 = 2NiSO4 + 2Н2О
(NiOН)2SO4 + 2Н+ = 2Ni 2+ + SO42– + 2Н2О
Пример 4. По ионным уравнениям реакций составить молекулярные.
Решение. 1. Са2+ + СО32– = ¯СаСО3
СаCl2 + Nа2СО3 = ¯СаСО3 + 2NаС1
Са(ОН)2 + К2СО3 = ¯СаСО3 + 2КОН
2. Сu2+ + 2OН – = ¯Сu(ОН)2
СuSO4 + 2NаОН =¯Cu(OH)2 + Nа2SO4
СuС12 + 2КОН = ¯Сu(ОН)2 + 2КС1;
3. Сu2+ + S2– = ¯СuS
СuС12 + К2S = ¯СuS + 2КС1
Сu(NO3)2 + Nа2S =¯СuS + 2NаNО3
Тема 5: «Концентрации растворов»
В соответствии с условием решить две задачи по теме «Mолярная и процентная концентрация». Если необходимо, то воспользуйтесь таблицами перевода плотности в процентную концентрацию, приведенными в приложении 1 Табл 1.4.
При решении задач необходимо обращать особое внимание на размерность применяемых величин и обязательно приводить их в соответствие друг другу. Поэтому при подстановке численных значений в формулы надо указывать размерность величин. Решение задач оформлять обязательно в соответствии с приведенными ниже примерами.
Вариант 1
1. Определите молярную концентрацию 30%-ного раствора серной кислоты.
2. К 500 мл раствора соляной кислоты (ρ = 1,10 г/мл) прибавили 2,5 л воды, после чего раствор стал 4%-ным. Определите процентное содержание растворенного вещества в исходном растворе.
Вариант 2
1. Рассчитайте массу хлорида натрия, необходимую для приготовления 12%-ного раствора.
2. Определите молярную концентрацию 10%-ного раствора азотной кислоты (ρ = 1,06 г/мл).
Вариант 3
1. Раствор глауберовой соли (Na2SO4×10H2O) приготовили взяв навеску 20 г на 1 литр воды. Определите массовую долю раствора в процентах.
2. Определите молярную концентрацию раствора сульфата калия, в 200 мл которого содержится 1,74 г растворенного вещества.
Вариант 4
1. Определите молярную концентрацию 10%-ного раствора хлорида аммония.
2. Определите процентное содержание растворенного вещества 1М раствора нитрaта никеля(II), плотность которого составляет 1,08 г/мл.
Вариант 5
1. Какова масса сульфата алюминия, взятого для приготовления 1 литра 10%-ного раствора?
2. Определите молярную концентрацию 10%-ного раствора серной кислоты (ρ = 1,07 г/мл).
Вариант 6
1. Каким объемом требуется разбавить 5М раствор KOH, чтобы достичь концентрации 1М?
2. Сколько миллилитров воды следует прибавить к 100 мл 20%-ного раствора серной кислоты (ρ = 1,14 г/мл) для получения 5%-ного раствора?
Вариант 7
1. Сколько граммов карбоната натрия нужно взять, чтобы приготовить 5 литров 10%-ного раствора?
2. В каком объеме воды следует растворить 32,2 г Na2SO4×10H2O, чтобы получить 5%-ный раствор сульфата натрия?
Вариант 8
1. Определите молярность 10%-ного раствора уксусной кислоты.
2. Определите процентное содержание растворенного вещества 0,9М раствора H3PO4 (ρ = 1,05 г/мл).
Вариант 9
1. До какого объема следует разбавить 500 мл соляной кислоты (30 %), чтобы приготовить 2,5%-ный раствор?
2. Сколько граммов медного купороса СuSO4×5H2O и воды требуется для приготовления 150 г 8%-ного раствора СuSO4 в расчете на безводную соль?
Вариант 10
1. Раствор сульфата натрия приготовили, взяв 200 г соли и 2,5 литра воды. Какова его массовая доля в процентах?
2. Определите молярную концентрацию 27%-ного раствора соляной кислоты (ρ = 1,14 г/мл).
Вариант 11
1. Какой объем 0,25М азотной кислоты необходим для нейтрализации 50 мл 0,5М раствора гидроксида калия?
2. До какого объема следует разбавить 1,5 л 20%-ного раствора хлорида аммония (ρ = 1,06 г/мл), чтобы получить 10%-ный раствор (ρ = 1,03 г/мл)?
Вариант 12
1. Какова массовая доля раствора аммиака, приготовленного растворением 2,5 л аммиака в 120 мл 15%-ного раствора аммиака?
2. Сколько миллилитров 70%-ного раствора нитрата калия (ρ = = 1,16 г/мл) требуется для приготовления 0,5 л 0,2М раствора?
Вариант 13
1. К 40 мл 20%-ного раствора гидроксида натрия добавили 400 мл воды. Определите массовую долю полученного раствора.
2. Сколько граммов кристаллической соды Na2CO3×10H2O надо взять для приготовления 2 л 0,2М раствора Na2CO3?
Вариант 1 4
1. Вычислите молярную концентрацию 12 % раствора сульфата аммония.
2. Cколько миллилитров 36%-ного раствора соляной кислоты (ρ = = 1,18 г/мл) требуется для приготовления 4 л 0,5М раствора?
Вариант 15
1. Сколько миллилитров 10%-ного раствора соляной кислоты требуется для нейтрализации 100 мл 4,5 %-ного раствора гидроксида натрия.
2. К 1 л 20%-ного раствора гидроксида натрия (ρ = 1,22 г/мл) прибавили 10 л воды. Определите процентное содержание растворенного вещества в полученном растворе.
Вариант 16
1. Определите молярную концентрацию 8%-ного раствора сульфата натрия (ρ = 1,08 г/мл).
2. Сколько миллилитров 10%-ного раствора Na2CO3 (ρ = 1,10 г/мл) следует прибавить к 1 л 2%-ного раствора (ρ = 1,02 г/мл), чтобы получить 3%-ный раствор этой соли?
Вариант 17
1. Сколько миллилитров 15%-ного раствора серной кислоты потребуется для нейтрализации 50 мл 2,5М раствора NaOH?
2. Определите процентное содержание растворенного вещества в 2М растворе гидроксида натрия (ρ = 1,08 г/мл).
Вариант 18
1. Сколько миллилитров 30%-ного раствора азотной кислоты нужно для приготовления 500 мл 12%-ного раствора?
2. Сколько миллилитров воды следует прибавить к 25 мл 40%-ного раствора KOH (ρ =1,40 г/мл), чтобы получить 2%-ный раствор?
Вариант 1 9
1. Определите процентную концентрацию 0,25М раствора хлорида кальция.
2. Сколько миллилитров 96 %-ного раствора серной кислоты (ρ = = 1,84 г/мл) требуется для приготовления 300 мл 0,5М раствора?
Вариант 20
1. Вычислите массовую долю раствора фосфорной кислоты, полученной в результате взаимодействия 71 г оксида фосфора (P2O5) и 600 мл воды.
2. Сколько граммов медного купороса СuSO4 ×5H2O следует добавить к 150 мл воды, чтобы получить 5%-ный раствор СuSO4?
Вариант 21
1. Сколько миллилитров 0,2М раствора карбоната натрия требуется для осаждения карбоната кальция из раствора CaCl2 0,02М?
2. Сколько миллилитров 30%-ного раствора азотной кислоты (ρ = = 1,84 г/мл) требуется для приготовления 250 мл 0,5М раствора?
Вариант 22
1. Определите массовую долю 1М раствора нитрата никеля.
2. Определите процентное содержание растворенного вещества в 0,25М растворе гидроксида натрия (ρ = 1,01 г/мл).
Вариант 23
1. Рассчитайте, сколько граммов хлорида калия потребуется для приготовления 2,5 литров 0,5 М раствора.
2. Сколько миллилитров 0,1М раствора HCl можно приготовить из 20 мл 0,5М раствора этой кислоты?
Вариант 24
1. Определите, какова была молярная концентрация раствора сульфата меди, если для осаждения ее гидроксида потребовалось 2 литра 0,5М раствора гидроксида натрия.
2. Определите молярную концентрацию 10%-ного раствора соляной кислоты (ρ = 1,05 г/мл).
Вариант 25
1. Сколько потребуется 4М раствора соляной кислоты, чтобы при взаимодействии с карбонатом кальция получить 4,5 л углекислого газа (н.у.)?
2. Сколько миллилитров 30%-ной азотной кислоты с ρ= 1,18 г/мл требуется для приготовления 250 мл 11%-ного раствора (ρ = = 1,07 г/мл)?
Вариант 26
1. Сколько граммов кристаллической соды Na2CO3×10H2O надо взять для приготовления 2 л 0,2М раствора Na2CO3.
2. Сколько миллилитров 30%-ного раствора KOH (ρ = 1,29 г/мл) требуется для приготовления 300 мл 0,1М раствора?
Вариант 27
1. Определите молярность 0,8%-ного раствора сульфата никеля.
2. К 760 мл 20%-ного раствора NaOH (ρ = 1,22 г/мл) прибавили 140 мл 10%-ного раствора NaOH (ρ = 1,11 г/мл). Определите процентное содержание растворенного вещества.
Вариант 28
1. Какова массовая доля гидроксида кальция, полученного растворением 1 г оксида кальция в 200 мл воды?
2. К 50 мл 96%-ного раствора серной кислоты (ρ = 1,84 г/мл) прибавили 50 мл воды. Определите процентное содержание растворенного вещества в полученном растворе.
Вариант 29
1. Вычислите молярность сульфата цинка (10 %).
2. Определите молярную концентрацию 72%-ного раствора азотной кислоты (ρ = 1,43 г/мл).
Вариант 30
1. Сколько миллилитров 96%-ной серной кислоты следует взять, чтобы приготовить 2 литра 4%-ного раствора.
2. Определите молярную концентрацию 6%-ного раствора фосфорной кис-лоты (ρ = 1,03 г/мл).
Примеры решения типичных задач к разделу 5.
Пример 1. Задача на разбавление
Какой объем 95%-ного раствора серной кислоты (r = 1,84 г/мл) надо взять для приготовления 400 г 10%-ного раствора кислоты? Приготовление раствора означает, что концентрированный раствор разбавляют водой. При этом остается неизменной масса растворенного вещества.
Кратко запишем условия задачи, обозначив параметры исходного раствора с индексом 1, приготовляемого раствора с индексом 2.
 Дано: Решение:
Дано: Решение:
С% 1=95% Из выражения для процентной концентрации r 1 =1,84 г/мл приготовляемого раствора выразим необходимую
m2 Р-РА=400 г массу растворенного вещества (серной кислоты):
 C % 2=10%
C % 2=10% 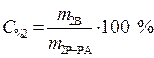
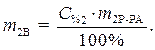 (1)
(1)
Найти: V1=? Определяем массу серной кислоты (m1В) в исход- ном растворе:
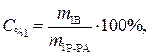 так как m1Р-РА= V1ρ1, то
так как m1Р-РА= V1ρ1, то
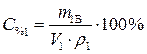
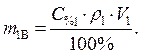 (2)
(2)
Поскольку m1В = m2В, то приравниваем выражения (1) и (2).
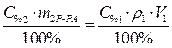
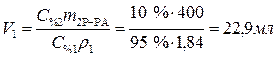
Ответ: Объем 95%-ного раствора серной кислоты равен 22,9 мл.
Пример 2. Задача с расчетом по уравнению химической реакции
Какая масса 25%-ного раствора гидроксида калия расходуется на нейтрализацию 75 г 15%-ного раствора уксусной кислоты?
Обозначим параметры, относящиеся к уксусной кислоте, индексом 1, гидроксиду калия – индексом 2.
 Дано: Решение
Дано: Решение
C % 1= 15% Уравнение реакции нейтрализации:
m1 Р-РА=75 г СH3COOH + KOH = CH3 COOK + H2O
C % 2= 25% Рассчитаем массу растворенного вещества,
содержащегося в растворе уксусной кислоты: 
Найти: m 2Р-РА=?
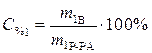 ,
, 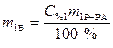 .
.
Определяем количество вещества (уксусной кислоты), содержащееся в растворе:
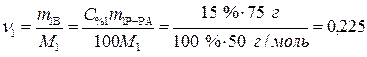 моль
моль
По уравнению реакции 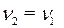 . Рассчитаем
. Рассчитаем 
n2 = n1 = 0,225 моль.
Найдем массу растворенного вещества, содержащегося в растворе гидроксида калия:
m2B = M2n2 = 56 г/моль·0,225 моль = 12,6 г.
Определяем массу раствора гидроксида калия, содержащего данное количество растворенного вещества – гидроксида калия:
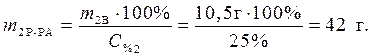
Ответ: 42 г – масса раствора гидроксида калия, которая расходуется на реакцию с уксусной кислотой.
Пример 3. Задача на приготовление раствора соли из кристаллогидрата
В 450 г воды растворили 50 г CuSO4×5H2O. Вычислить процентное содержание кристаллогидрата (CuSO4×5H2O) и безводной соли (CuSO4) в растворе.
Обозначим параметры раствора кристаллогидрата индексом 1, а раствора безводной соли с индексом 2.
 Дано: Решение
Дано: Решение
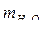 = 450 г Найдем общую массу раствора:
= 450 г Найдем общую массу раствора:
 m1В = 50 г mР-РА= m1Р-РА= m2Р-РА= mH2O+ m1В.
m1В = 50 г mР-РА= m1Р-РА= m2Р-РА= mH2O+ m1В.
Найти: mР-РА = 450 г + 50 г = 500 г.
С% 1, С% 2 = ?
Рассчитаем процентное содержание кристаллогидрата в растворе:
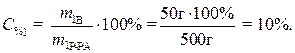
Определим массу безводной соли в растворе:
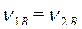 ,
, 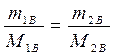 ,
, 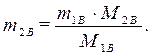
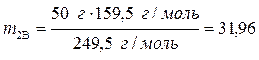 г
г
Процентное содержание безводной соли в растворе:
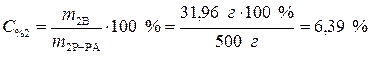
Ответ: 10% – содержание кристаллогидрата в растворе, 6,39% – содержание безводной соли в растворе.
Пример 4. Задача на расчет молярной концентрации, если известна процентная концентрация.
 Определить молярную концентрацию 36,2%-го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Определить молярную концентрацию 36,2%-го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Дано: Решение
С% = 36,2 % Из выражения для процентной
 r = 1,18 г/мл концентрации данного раствора выразим Найти: СМ =? необходимую массу растворенного вещества (HCl):
r = 1,18 г/мл концентрации данного раствора выразим Найти: СМ =? необходимую массу растворенного вещества (HCl):
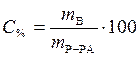 ,
, 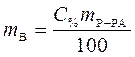 .
.
Подставляем массу соляной кислоты (m В) в формулу, выражающую молярную концентрацию раствора и, учитывая, что mР-РА = V ρ, записываем формулу перехода от процентной концентрации к молярной:
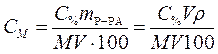 . (2)
. (2)
Для приведения размерности применяемых величин в соответствие выразим плотность раствора в r =1,18·103 г/л, тогда объем раствора получится в литрах и сокращается, формула приобретает следующий вид:
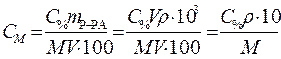 . (3)
. (3)
Производим расчет, используя формулу (3) для перехода от процентной концентрации к молярной:
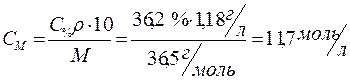
Ответ: 11,7 моль/л.
Пример 5. Задача на определение процентной концентрации, если известна молярная концентрация раствора.
Определить процентное содержание растворенного вещества в 1,68 М растворе H2SO4, плотность которого равна 1,1 г/мл.
 Дано: Решение
Дано: Решение
СМ = 1,68 моль/л
 r = 1,1г/мл Для перехода от молярной концентрации к про центной
r = 1,1г/мл Для перехода от молярной концентрации к про центной
(вывод формулы можно произвести самостоя Найти: С% =? тельно, используя пример на с. 62):
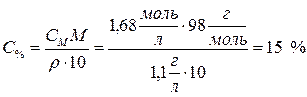 .
.
Ответ: 15 %.
Тема №6: «Гидролиз солей»
Задание 1. Напишите в молекулярной и ионной формах уравнения гидролиза солей, укажите значения рН растворов этих солей (больше или меньше 7).
Задание 2. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза солей.
| Задание 1 | Задание 2 |
| 1. NaNO2, Cu(NO3)2 | 1. Fe2(SO4)3 + Na2CO3 |
| 2. AlCl3, NaHCO3 | 2. Na2S + Al2(SO4)3 |
| 3. Na3PO4, ZnCl2 | 3. SnCl2 + K2SO3 |
| 4. FeCl2, K2S | 4. Cr2(SO4)3 + K2S |
| 5. K2SO3, ZnSO4 | 5. K2CO3 + Bi(NO3)3 |
| 6. NH4Cl, KClO | 6. Na2S + AlCl3 |
| 7. Na2Se, MnCl2 | 7. FeCl3 + K2CO3 |
| 8. ZnSO4, BaS | 8. Cr2(SO4)3 + Na2SO3 |
| 9. Ni(NO3)2, KNO2 | 9. K2SO3 + AlBr3 |
| 10. NH4Br, Na2S | 10. Bi(NO3)3 + Na2CO3 |
| 11. Na2HPO4, Mg(NO3)2 | 11. CrCl3 + K2S |
| 12. Al2(SO4)3, Na2SeO3 | 12. Na2CO3 + Cr(NO3)3 |
| 13. CuSO4, K3PO4 | 13. K2SiO3 + Bi(NO3)3 |
| 14. Na2SO3, Fe2(SO4)3 | 14. Na2SO3 + CrCl3 |
| 15. NaCN, FeSO4 | 15. Be(NO3)2 + Na2SO3 |
| 16. Ba(CH3COO)2, CoSO4 | 16. AlCl3 + Na2SO3 |
| 17. NiSO4, NaF | 17. SnCl2 + Na2CO3 |
| 18. Pb(NO3)2, Ba(NO3)2 | 18. Na2S + Al2(SO4)3 |
| 19. Cr2(SO4)3, NaCH3COO | 19. Fe(NO3)3 + K2CO3 |
| 20. KHS, MgSO4 | 20. Al2(SO4)3 + Na2CO3 |
| 21. CdCl2, NaClO | 21. Na2SO3 + SnCl2 |
| 22. Cr(NO3)3, K2CO3 | 22. NH4Cl + Na2SiO3 |
| 23. KHSO3, MnSO4 | 23. K2SO3 + CrCl3 |
| 24. Li2S, CrCl3 | 24. AlBr3 + Na2SO3 |
| 25. SrS, SnBr2 | 25. BeCl2 + Na2S |
| 26. Ca(HCO3)2, CuBr2 | 26. BeCl2 + Na2SO3 |
| 27. Li2SO3, AlCl3 | 27. Fe2(SO4)3 + K2SO3 |
| 28. Zn(NO3)2, К3PO4 | 28. Na2S + Al(NO3)3 |
| 29. (NH4)2SO4, RbHSO3 | 29. SnCl2 + Na2SO3 |
| 30. SnSO4, KF | 30. SnCl2+ K2CO3 |
Примеры решения задач и оформления задания раздела 6
Пример 1. Гидролиз солей, образованных сильной кислотой и слабым основанием, например NH4NO3:
NH4Cl = NH4++ NO3-
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH Û NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4NO3+ H2O Û NH4OH + HNO3 – кислая среда (рН < 7).
Пример 2. Гидролиз солей, образованных слабой кислотой и сильным основанием, например Na2CO3:
Na2SO3 = 2Na+ + CO32-
Гидролизу подвергается анион слабой кислоты CO32-:
1-я ступень: CO32-+HOH Û HCO3-+OH- (ионы OH- в избытке).
Молекулярное уравнение 1-й ступени:
Na2CO3 + H2O Û NaHCO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
Пример 3. Совместный гидролиз двух солей, например Al(NO3)3 + + Na2S + H2O, протекает необратимо с образованием слабого основания и слабой кислоты:
Итоговое ионное уравнение:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S (рН » 7),
т. к. образуются 2 слабых электролита.
Молекулярное уравнение:
2Al(NO3)3 + 3Na 2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaNO3
Дата: 2018-11-18, просмотров: 770.