Задание 1. Рассчитайте и укажите степень окисления атомов элементов для предложенных частиц. Объясните, какую роль могут выполнять указанные частицы в окислительно-восстановительных реакциях: только окислитель ( Ox ), только восстановитель ( Red ), окислитель и восстановитель ( Ox и Red ).
| 1. CrO33-, MnO2, PbO2, Cr2O72- | 5. ClO4-, Cl-, CrO2-, F2 |
| 2. Fe, AlO2-, N2O, NO3- | 6. Ca, NO3-, BrO-, NO2- |
| 3. Fe2O3, MnO4-, Br-, CrO42- | 7. SO42-, CO, H2S, MnO42- |
| 4. CO2, ClO-, MnO42-, Cl- | 8. CO2, Cr2O72-, BrO-, SeO42- |
| 9. NO3-, NO, Cr2O72-, SO32- | 20. SeO32-, AlO2-, Br-, ClO3- |
| 10. BrO-, Br-, Cd2+, CrO42- | 21. PbO22-, NO2-, H2O, CrO42- |
| 11. Cl2, Cl-, CrO42-, B4O72- | 22. J-, ClO3-, Mg, TiO2+ |
| 12. TiO2+, ClO-, MnO2, MnO4- | 23. SO32-, PbO32-, NO3-, NH3 |
| 13. MnO42-, NO3-, NH4+, ClO3- | 24. N2H4, Cr2O3, CrO42-, NO2 |
| 14. NH2OH, VO2+, Ni, CrO42- | 25. NH2OH, N2, AsO2-, F- |
| 15. H2S, Cl2, SO42-, VO3- | 26. N2O, XeO4, NO, AsO43- |
| 16. SO32-, NO2, ClO4-, Br- | 27. VO3-, MnO, SnO2, Ba |
| 17. CrO2-, ReO4-, PbO2, CrO42- | 28. JO4-, Cr3+, MnO2, Fe2O3 |
| 18. SO42-, MnO2, NO2, Cu | 29. Br2, FeO, SbO2-, P2O5 |
| 19. NO2-, Cl2, Mn2+, ClO- | 30. PO43-, O3, SbO43-, PH3 |
Пример решения задач и оформления задания раздела 7.
Пример 1. Рассчитайте и укажите степень окисления (СО) атомов подчеркнутых элементов в предложенных частицах. Объясните, какую роль могут выполнять указанные частицы в окислительно-восстановительных реакциях: только окислитель (Ох), только восстановитель (Red), окислитель и восстановитель (Ох и Red).
MnO2, NO3– , Cu, H2S
MnO2 х + 2*(- 2) = 0 СО = +4
Марганец – металл VII группы, высшая степень окисления его +7, а низшая – 0; в данном соединении марганец содержится в промежуточной степени окисления, в окислительно-восстановительных реакциях данная частица может быть и окислителем, и восстановителем (Ох и Red):
NO3– х + 3*(–2) = –1 СО = +5.
Азот элемент V группы, высшая степень окисления +5, NO3– в окислительно-восстановительных реакциях может быть только окислителем (Ох):
Cu, СО = 0.
Медь – металл, в свободном состоянии проявляет низшую степень окисления 0, может быть только восстановителем (Red).
H2S , СО = –2.
Сера – неметалл VI группы, высшая степень окисления + 6, низшая степень окисления серы 6 – 8 = – 2, в окислительно-восстановительных реакциях H2S может быть только восстановителем (Red).
+4 высшая СО +7
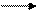
 MnO2 Ох и Red
MnO2 Ох и Red
низшая СО 0
 +5 высшая СО +5
+5 высшая СО +5
 NO3– Ох
NO3– Ох
низшая СО –3
 высшая СО +3
высшая СО +3
 Cu0 Red
Cu0 Red
низшая СО 0
 -2 высшая СО + 6
-2 высшая СО + 6
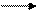 H2S Red
H2S Red
низшая СО -2
Задание 2. Составьте электронную схему и молекулярное уравнение реакции. Укажите окислитель и восстановитель.
| Номер варианта | 1-я реакция | 2-я реакция |
| 1 | KMnO4+KI+H2O ® MnO2, J2 | Ni+HCl |
| 2 | Cr2O3+KNO3+NaOH ® CrO42-, NO2- | Ni+H2SO4конц., t° ® |
| 3 | MnO2+KNO3+KOH ® MnO42-, NO2- | Co+HNO3разб. |
| 4 | KMnO4+KI+NaOH ® MnO42-, IO3- | Co+H2SO4разб. |
| 5 | K2Cr2O7+FeSO4+H2SO4 ® Fe3+, Cr3+ | Co+HCl |
| 6 | KMnO4+V2(SO4)3+H2O ® MnO2, VO2+ | Co+H2SO4конц. |
| 7 | K2MnO4+Na2SO3+H2O ® MnO2, SO42- | Fe+H2SO4разб. |
| 8 | MnSO4+PbO2+HNO3 ® MnO2, Pb2+ | Fe+H2SO4конц., t° ® |
| 9 | Cr2(SO4)3+NaClO+NaOH ® CrO42-, Cl- | Fe+HCl |
| 10 | Mn(NO3)2+NaBiO3+H2SO4 ® MnO4-, Bi3+ | Fe+HNO3разб. |
| Номер варианта | 1-я реакция | 2-я реакция |
| 12 | K2Cr2O7 +H2S+H2SO4 ® Cr3+, S | Ni + O2 +H2O |
| 13 | FeCl3+Cl2+KOH ® FeO42-, Cl- | Sn + H2O + O2 |
| 14 | Ni(OH)2+NaClO + H2O ® Ni(OH)3, Cl- | Co + NaOH + O2 + H2O |
| 15 | Co(OH)3+HCl ® Co2+, Cl2 | Ni + NaOH + O2 |
| 16 | Na2SO3+K2Cr2O7+H2SO4 ® Cr3+, SO42- | Cr + H2O |
| 17 | HCl + HNO3 ® Cl2, NO | Cr + H2O + O2 |
| 18 | Fe2O3+KNO3+NaOH ® FeO42-, NO2- | Sn + NaOH + O2 + H2O |
| 19 | H2S + Cl2+H2O ® SO42-, Cl- | V+HNO3разб. |
| 20 | Fe2(SO4)3+Na2S+H2SO4 ® Fe2+, S | Ti+H2SO4конц. |
| 21 | K2Cr2O7 +HCl ® Cr3+, Cl2 | V+H2SO4конц. |
| 22 | KCrO2 + Cl2 + KOH ® CrO42-, Cl- | Ti+HNO3конц. |
| 23 | NaNO3 + Zn + NaOH ® ZnO22-, NH3 | Ti+O2+NaOH + H2O |
| 24 | SO2 + NaJO3 + H2O ® SO42-, I- | Cu + H2SO4конц. |
| 25 | FeCl2+KMnO4+H2SO4 ® Fe3+, Mn2+ | Al + NaOH + H2O |
| 26 | FeCl2 + HNO3 + HCl ® Fe3+, N2O | Fe + H2O + O2 |
| 27 | MnO2+KClO3+KOH ® MnO42-,Cl- | Zn + HCl + O2 |
| 29 | KMnO4+Na3SO3+NaOH ® MnO42-, SO42- | Cu + O2+NaOH + H2O |
| 30 | K2Cr2O7+SnCl2+H2SO4 ® Sn4+, Cr3+ | Be+HNO3разб. |
Примеры решения и оформления заданий к разделу 7.
Пример 1. Среда кислая
Na2SO3 + KMnO4 + H2 SO4 ® Na2SO 4 + MnSO4 + .....
Red Ox среда
 5 SO32–- 2ē + Н2О = SO42– + 2Н+
5 SO32–- 2ē + Н2О = SO42– + 2Н+
2 MnO4– + 5ē + 8Н + = Mn2+ + 4 H2O

5SO32– + 2MnO4– + 5Н2О + 16Н+ = 5SO4 2– + 2Mn 2+ + 10Н+ + + 8Н2О
5SO32– + 2MnO4–+ 6Н+ = 5SO42– + 2Mn 2+ + 3Н2О
5Na2SO3 + 2KMnO4 + 3H2SO 4 = 5Na2SO 4 + 2MnSO 4 + 3Н2О + + K2SO4
Пример 2. Среда щелочная
KCrO2 + KClO3 + KOH® K2CrO 4 + KCl + ...
Red Ox среда
 2 CrO 2– - 3ē + 4ОН–= CrO4 2– + 2Н2О
2 CrO 2– - 3ē + 4ОН–= CrO4 2– + 2Н2О
1 ClO3 – + 6ē + 3Н2О = Cl – + 6ОН–

2CrO2– + ClO3–+ 8ОН – + 3Н2О = 2CrO42– + Cl –+ 4Н2О + 6ОН–
2CrO2– + ClO3–+ 2ОН – = 2CrO42 - + Cl–+ Н2О
2KCrO2 + КClO3 + 2КОН = 2К2СrО 4 + КСl + Н2О
Пример 3. Среда нейтральная
КMnO4 + Na2SO3 + Н2О ® MnO2 + SO42–.....
Ox Red среда
 3 SO32– - 2ē + Н2О = SO42– + 2Н+
3 SO32– - 2ē + Н2О = SO42– + 2Н+
 2 MnO4–+ 3ē + 2Н2 О = MnO2 + 4ОН ˉ
2 MnO4–+ 3ē + 2Н2 О = MnO2 + 4ОН ˉ
 3SO32– + 2MnO4–+ 7Н2О = 2MnO2 + 3SO42– + 6Н+ + 8ОН ˉ
3SO32– + 2MnO4–+ 7Н2О = 2MnO2 + 3SO42– + 6Н+ + 8ОН ˉ
6Н2О + 2ОН ˉ
3 SO32– + 2MnO4–+ Н2О = 2MnO2 + 3SO42– + 2OН ˉ
3Na2SO3 + 2KMnO4 + Н2О = 2MnO2 + 3Na2SO4 + 2KOH
Дата: 2018-11-18, просмотров: 1086.