Рассчитайте ЭДС, если концентрация раствора не указана, потенциал примите стандартным. Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, укажите направление движения электронов и ионов в следующих гальванических элементах:
1. Ag / AgNO3, 0,001M // Zn(NO3)2 / Zn
2. Cd / CdSO4, 0,1M // CuSO4, 0,01M / Cu
3. Zn / ZnSO4, 0,01M // FeSO4, 0,1M / Fe
4. Cu / CuSO4 // Fe2(SO4)3, FeSO4 (С)
5. Fe / FeSO4 // FeSO4, 0,001M / Fe
6. Co / CoSO4, 0,01M // CoSO4 / Co
7. Ti / Ti2(SO4)3, 0,5M // AgNO3 / Ag
8. Ag / AgNO3, 0,01M // H2SO4 / H2 (Pt)
9. Pb / Pb(NO3)2 // Cd(NO3)2, 0,1M / Cd
10. Al / Al2(SO4)3, 0,005M // NiSO4, 0,01M / Ni
11. Sn / SnSO4, 0,01M // SnSO4 / Sn
12. (Pt) H2 / H2SO4 // ZnSO4, 0,01M / Zn
13. Ag / AgNO3 // Cr2(SO4)3, 0,05M / Cr
14. Cu / CuSO4 // V2(SO4)3, 0,05M / V
15. Ni / NiSO4, 0,1M // H2SO4 / H2 (Pt)
16. (Pt) H2 / H2SO4 // Al2(SO4)3, 0,5M / Al
17. Ni / NiSO4 // NiSO4, 0,001M / Ni
18. Ag / AgNO3, 0,1M // AgNO3, 0,0001M / Ag
19. Sn / SnSO4 // Cr2(SO4)3, 0,05M / Cr
20. Co / CoSO4 // ZnSO4, 0,01M / Zn
21. Cu / CuSO4, 0,1M // Al2(SO4)3, 0,5M / Al
22. Ag / AgNO3, 0,01M // Pb(NO3)2 / Pb
23. (Pt) H2 / H2SO4 // Al2(SO4)3, 0,005M / Al
24. Zn / ZnSO4, 0,1M // ZnSO4, 0,0001M / Zn
25. Cr / Cr2(SO4)3, 0,005M // CdSO4 / Cd
26. Cu / CuSO4, 0,1M // H2SO4 / H2 (Pt)
27. Cu / CuSO4 / SnCl2 0,01M /Sn
28. V / V2(SO4)3, 0,5M // H2SO4 / H2 (Pt)
29. Cr / Cr2(SO4)3, 0,005M // ZnSO4 / Zn
30. Co / CoSO4, 0,01M // NiSO4 / Ni
Примеры решения и оформления заданий к разделу 8
Пример 1. Медно-цинковый гальванический элемент
1. Схема Zn / ZnSO4 //CuSO4 /Cu
Условия стандартные, т. е. 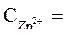 1 моль/л,
1 моль/л, 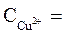 1 моль/л,
1 моль/л,
2. Электродные потенциалы:
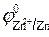 = - 0,76 В при
= - 0,76 В при 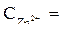 1 моль/л,
1 моль/л, 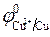 = + 0,34 В (при
= + 0,34 В (при 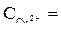 1 моль/л).
1 моль/л).
3. Направление движения электронов по внешний цепи - от цинкового электрода в медному, т. к. потенциал цинкового электрода меньше. Расчет величины ЭДС.
ЭДС = φ0Ox - φ0Red = 0,34 - (- 0,76) = 1,1 В.
Пример 2 Гальванический элемент с водородным электродом.
1. Схема Zn / ZnSO4 // H2SO4 , Н2 / Pt.
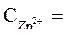 1 моль/л,
1 моль/л, 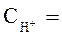 1 моль/л, Т = 298 К, P = 101,3 кПa .
1 моль/л, Т = 298 К, P = 101,3 кПa .
2. Электродные потенциалы
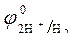 = 0 В ,
= 0 В , 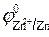 = - 0,76 В при
= - 0,76 В при 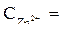 1 моль/л.
1 моль/л.
3. Направление движения электронов по внешней цепи - от цинкового электрода к водородному, т. к. потенциал цинкового электрода меньше.

4. Уравнения электродных процессов.
Zn (-): Zn - 2ē = Zn 2+ - процесс окисления;
Pt (+): 2Н ++ 2ē = Н 2 - процесс восстановления.
5. Суммарное уравнение:
Zn + 2Н + = Zn 2+ + Н 2
Zn + H2SO4 = ZnSO4 + Н 2
6. Расчет величины ЭДС:
ЭДС = φ0Ox - φ0Red = 0 - (- 0,76) = 0,76 В.
Пример 3. Концентрационный гальванический элемент.
Оба электрода из одного металла. Но растворы солей, в которые погружены электроды, разной концентрации.
1. Схема гальванического элемента.
Ni / NiSO 4( 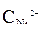 = 10-4 моль/л)// NiSO 4 (
= 10-4 моль/л)// NiSO 4 ( 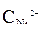 =1 моль/л) / Ni
=1 моль/л) / Ni
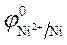 = -0,25 В.
= -0,25 В.
2. Вычисление электродных потенциалов по уравнению Нернста.
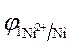 =
= 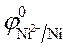 +
+ 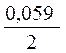 · lg
· lg 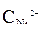 = - 0,25 +
= - 0,25 + 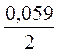 lg 10 -4 = = - 0,309 B.
lg 10 -4 = = - 0,309 B.
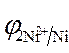 =
= 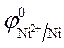 = - 0,25 B.
= - 0,25 B.
3. Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, т. к. 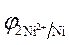 >
> 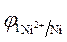 .
.

4. Уравнения электродных полуреакций.
Ni1 (-): Ni - 2ē = Ni 2+ - процесс окисления;
Ni2 (+): Ni2+ + 2ē = Ni - процесс восстановления.
Токообразующая реакция не имеет смысла.
5. Расчет величины ЭДС.
ЭДС = 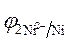 -
- 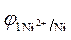 = - 0,25 - (- 0,309) = 0,059 В.
= - 0,25 - (- 0,309) = 0,059 В.
Пример 4. Гальванический элемент на основе окислительно-восстановительной реакции с инертным (С) электродом:
Zn / ZnSO4 // K2Cr2O7, Cr2(SO4)3, H2SO4 (C)
1. Сокращенная схема гальванического элемента
- Zn / Zn 2+ (1 M) // Cr2O72 -, Сr 3+, H+ (1 M) / C +
2. Используем значения стандартных электродных потенциалов, т. к. концентрации ионов в растворе равны 1 моль/л.
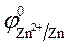 = - 0,76 B;
= - 0,76 B; 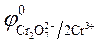 = 1,36 B.
= 1,36 B.
3. Направление движения электронов - от цинкового электрода к
угольному, так как 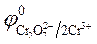 >
> 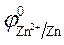 .
.
| |
Zn / ZnSO4 // K2Cr2O7, Cr2(SO4)3, H2SO4 (C)
4. Уравнения электродных процессов:
Zn (-): Zn - 2ē = Zn 2+ - процесс окисления;
С (+): Cr2O 7 2 - + 6ē + 14Н+ = 2Cr 3+ + 7Н2О - процесс восстановления.
5. Суммарные уравнения:
3Zn + Cr2O72 - + 14Н+ = 3Zn 2+ + 2Cr 3+ + 7Н2О
3Zn + K2Cr2O7+ 7H2SO4 = 3ZnSO4 + Cr2(SO4)3 + 7Н2О + K2SO4
6. Расчет величины ЭДС:
ЭДС = Е0Ox - Е0Red = 1,36 - (- 0,76) = 2,12 В.
Дата: 2018-11-18, просмотров: 857.