И растворами щелочей»
Используя потенциалы (см. таблицу «Окислительно-восстановительные потенциалы водорода, кислорода и
некоторых металлов в разных средах»), допишите уравнения реакций (по две для каждого варианта) и составьте к ним электронно-ионные схемы. Для реакций металлов с H2SO4 концентрированной и HNO3 значение потенциала окислителя примите равным более 1 В. Оцените практическую устойчивость металлов в данной среде.
| 1. Al + HCl H2SO4конц. + Сu | 13. Sn + H2O + O2 H2SO4конц. + Bi |
| 2. Al + H2O + O2 H2SO4конц. + Sn | 14. Co + NaOH + H2O + O2 H2SO4конц. + Co |
| 3. Al + H2O H2SO4конц. + Zn | 15. Sn + NaOH + H2O + O2 H2SO4конц. + Be |
| 4. Al + KOH + H2O HNO3разб. + Be | 16. Ni + H2O + O2 HNO3разб. + Pb |
| 5. Al + NaOH + H2O HNO3разб. + Cd | 17. Pb + KOH + H2O + O2 HNO3разб. + Cr |
| 6. Cu + H2O + O2 HNO3разб. + Mg | 18. Cr + KOH + H2O + O2 H2SO4конц., t° + Al |
| 7. Cu + NaOH + H2O + O2 HNO3конц. + Ba | 19. Pb + H2O + O2 HNO3разб. + Bi |
| 8. Fe + H2O + O2 HNO3конц. + Pb | 20. Bi + KOH + H2O + O2 HNO3конц., t° + Ni |
| 9. Cr + H2O HNO3разб. + Fe ® Fe3+ | 21. Cr + HCl H2SO4конц. + Mg |
| 10. Zn + H2O H2SO4конц., t° + Al ® | 22. Al + HCl Zn + NaOH + H2O |
| 11. Zn + NaOH + H2O H2SO4конц., t° + Ni ® | 23. Ti + H2SO4конц., t° Cd + KOH + H2O + O2 |
| 12. Zn + H2SO4разб. +O2 HNO3конц., t° + Fe ® Fe3+ | 24. Ti + HNO3разб. Cd + KOH + H2O |
| 25. Cr + H2O + O2 HNO3разб. +Cu | 28. Cd + HCl + O2 Be + H2SO4конц. |
| 26. Zn + NaOH + H2O + O2 H2SO4конц., t° + Fe ® Fe3+ | 29. Fe + KOH + H2O + O2 Ag + HNO3 конц. |
| 27. Cr + NaOH + H2O HNO3разб. + Sn | 30. Ni + KOH + H2O + O2 Mn + H2SO4конц. |
Примеры решения и оформления заданий к разделу 9
Пример 1
Рассмотрите возможность растворения кальция в воде. Составьте электронно – ионную схему, ионное и молекулярное уравнения.
Ca + H2O →
Red Ox
Восстановителем в данном процессе является металл – Са.
φСа2+/ Ca = –2,84 В;
Окислителем является Н2О. φ2Н2О/H2 = - 0,41 В.
Реакция теоретически возможна, т. к. разность потенциалов окислителя и восстановителя Dφ2Н2О/H2 - φСа2+/ Ca = – 0,41 – (– 2,84) = 2,43 В > 0. В воде практически растворяются щелочные и щелочно-земельные металлы, гидроксиды которых являются растворимыми соединениями.
Электронно – ионная схема, ионное и молекулярное уравнения:
| 1 1 | Ca – 2ē = Ca2+ 2Н2О + 2ē = Н2 + 2ОН - |
Ca + 2Н2О = Ca2+ + 2ОН - + Н2
Ca + 2Н2О = Ca(OH)2 + Н2
Пример 2.
Рассмотрите возможность растворения цинка и меди в соляной кислоте.
Восстановителем в рассматриваемых окислительно-восстановительных реакциях могут быть Zn и Cu:
φZn2+ /Zn = – 0,76 В , φCu2+ /Cu = + 0,34 B.
Окислителем является Н+. φ2Н+/ H2 = 0.
Медь не растворяется в соляной, а также серной кислоте разбавленной, т. к. разность потенциалов Dφ = φ2Н+/ H2 – φCu2+ /Cu = 0 – 0,36 = – 0,36 В меньше нуля.
Цинк растворяется в растворах разбавленных кислот, т. к. в этом случае Dφ = φ2Н+/ H2 – φZn2+ /Zn = 0 – (– 0,76) = + 0,76 В больше нуля.
Электронно-ионная схема, ионное и молекулярное уравнения:
| 1 1 | Zn – 2ē = Zn2+ 2Н+ + 2ē = Н2 |
Zn + 2Н+ = Zn2+ + Н2
Zn + 2HCl = ZnCl2 + Н2
Пример 3
Рассмотрите возможность растворения алюминия в растворе щелочи.
Al + NaOH + H2O
Red среда Ox
Восстановитель – Al. φ AlO2–/ Al = – 2,36 B.
Окислитель – Н2О. φ 2Н2О/H2 = – 0,41 B.
Возможность протекания процесса:
Dφ = Е2Н2О/H2 – φ AlO2–/ Al = – 0,41 – (– 2,36) = 1,95 В. Разность потенциалов больше нуля, следовательно, реакция теоретически возможна. Практически она также осуществима, так как гидроксид алюминия проявляет амфотерные свойства.
Электронно-ионная схема, ионное и молекулярное уравнения:
| 2 3 | Al – 3ē + 4OH– = AlO2– + 2Н2О 2Н2О + 2ē = Н2 + 2ОН - |
2Al + 8 OH – + 6Н2О = 2AlO2– + 3Н2 + 4Н2О + 6 OH –
2Al + 2OH– + 2Н2О = 2AlO2– + 3Н2
2Al + 2NaOH + 2Н2О = 2NaAlO2 + 3Н2
Пример 4
Допишите правую часть предполагаемого взаимодействия, используя схемы, предложенные выше: запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции:
Al + H2SO4 (конц) "
Red Ox
Al + H2SO4 (конц) " Al2(SO4)3 + H2S + H2O
| 8 3 | Al – 3ē = Al3+ SO42– + 8ē + 10H+ = H2S + 4H2O |
8Al + 3SO42– + 30H+ = 8Al3+ + 3H2S + 12H2O
8Al + 15H2SO4 (конц) = 4Al2(SO4)3 + 3H2S + 12H2O
Пример 5
Допишите правую часть предполагаемого взаимодействия, используя схемы, предложенные выше, запишите электронно-ионные уравнения полуреакций, ионное и молекулярное уравнения реакции:
Zn + HNO3 (разб.) "
Red Ox
Zn + HNO3 (разб.) " Zn(NO3)2 + N2 + H2O
| 5 1 | Zn – 2ē = Zn2+ 2 NO3– + 10ē + 12H+ = N2 + 6H2O |
5Zn + 2NO3– + 12H+ = 5Zn2+ + N2 + 6H2O
5Zn + 12HNO3 (разб.) = 5Zn(NO3)2 + N2 + 6H2O
Тема 10 «Электрохимическая коррозия
Металлов»
Задание 1. Используя потенциалы (см. таблицу «Окислительно-восстановительные потенциалы водорода, кислорода и
некоторых металлов в разных средах»), укажите анод и катод гальванопары, направление движения электронов, рассчитайте ЭДС,
Задание 2. Напишите уравнения анодного и катодного процессов, молекулярное уравнение коррозии.
Гальванопары
| Коррозионная среда | ||
| H2O + O2 | NaOH + H2O | H2O |
| 1. Zn/Sn | 11. Al/Cu | 21. Pb/Sn |
| 2. Pb/Zn | 12. Cu/Zn | 22. Fe/Mg |
| 3. Fe/Zn | 13. Zn/Fe | 23. Ni/Zn |
| 4. Fe/Cu | 14. Fe/Cr | 24. Cu/Pb |
| 5. Fe/Ni | 15. Co/Al | 25. Zn/Sn |
| 6. Zn/Cu | 16. Cr/Ni | 26. Mg/Cd |
| 7. Pb/Fe | 17. Al/Fe | 27. Cr/Bi |
| 8. Bi/Ni | 18. Zn/Al | 28. Co/Mg |
| 9. Mg/Fe | 19. Cr/Bi | 29. Mg/Fe |
| 10. Ni/Mg | 20. Co/Cu | 30. Sn/Bi |
Примеры решения и оформления заданий к разделу 10
Пример 1. Гальванопара алюминий-железо в воде (среда нейтральная). В воде растворен кислород.
Решение
1. Схема гальванопары: Al / H2O, O2 / Fe.
2. Потенциалы: 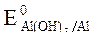 = -1,88 B;
= -1,88 B; 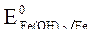 = -0,46B;
= -0,46B;
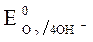 = +0,814B.
= +0,814B.
Восстановитель – Al, окислитель - О2.
 3. Al(-): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
3. Al(-): 4 Al - 3ē + 3Н2О = Al(OH)3+ 3Н+ - процесс окисления;
Fe(+): 3 О2 + 4ē + 2Н2 О = 4ОН- - процесс восстановления
 4Al + 3О 2 + 6Н2О = 4Al(OH)3
4Al + 3О 2 + 6Н2О = 4Al(OH)3
4. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
 ē
ē
 (-) Al/ Fе (+) ē
(-) Al/ Fе (+) ē
 О2 , Н2О
О2 , Н2О
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+), если нарушена сплошность покрытия.
Решение
1. Схема гальванопары
Fe / Н2 О, О2, Н+ / Sn.
2. Потенциалы 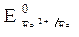 = -0,44 B;
= -0,44 B; 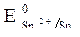 = -0,136 B;
= -0,136 B;
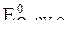 = +1,228 B.
= +1,228 B.
Восстановитель – железо, окислитель – кислород.
 3. Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления;
3. Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления;
Sn(+): 1 О2 + 4ē + 4Н+ =2Н2О – процесс восстановления
 2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4НCl = 2FeCl2 + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.

 4. Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом: ē
4. Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом: ē
(-) Fe/ Sn (+) ē
 О2 , Н+
О2 , Н+
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Решение
1. Схема гальванопары:
Al / КОН/ Fe
2. Потенциалы: 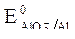 = -2,36 B;
= -2,36 B; 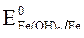 = -0,874 B;
= -0,874 B;
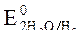 = -0,827 B.
= -0,827 B.
Восстановитель - алюминий, окислитель - вода.
3.
| Al(-): | 2 | Al - 3ē + 4OH – = AlO2– + 2H2O – процесс окисления; |
| Fe(+): | 3 | 2H2O + 2ē = 2OH – + H2 – процесс восстановления |
| 2Al + 8 OH – + 2H2O = 2AlO2– + 3H2 |
2Al + 8 КOH + 2H2O = 2КAlO2 + 3H2
Разрушается алюминий.
4. Направление перемещения электронов в системе:
ē


(-) Al/ Fe (+) ē
 H2O, KOH
H2O, KOH
Дата: 2018-11-18, просмотров: 1513.