При взаимодействии металлов с растворами щелочей металл также является восстановителем, вода – окислителем; щелочь создает среду.
Стандартный потенциал восстановления водорода (из молекулы воды) в щелочной среде составляет –0,83 В. В соответствии с этим теоретически реагировать с растворами щелочей могут все металлы, потенциалы которых меньше –0,83 В. Однако в действительности в щелочных средах окисляются только металлы, оксиды и гидроксиды которых являются амфотерными – алюминий, цинк, олово, хром, свинец и др. Металлы, образующие нерастворимые гидроксиды основного характера, в водных растворах щелочей не окисляются.
Пример Взаимодействие Al с водным раствором щелочи
Стандартный потенциал алюминия в щелочной среде ниже потенциала водорода:
j(AlO2-/Al) = -1,88 В,
j(2Н2О/Н2) = -0,83 В,
j(AlO2-/Al) < j(2Н2О/Н2).
Реакция теоретически возможна, и она осуществляется на практике, так как гидроксид алюминия амфотерен и растворяется в щелочах с образованием растворимых алюминатов МеAlO2 или [Al(OH)4]–.
Уравнение реакции:
| 0 +3 | |
| 2 | Al + 4OH- -3e ® AlO2- + 2H2O |
| +1 0 | |
| 3 | 2H2O + 2e ® H2 + 2OH- |
2Al + 8OH- + 6H2O ® 2AlO2- + 4H2O + 3H2 + 6OH-
2Al + 2OH- + 2H2O ® 2AlO2-+ 3H2
2Al + 2NaOH + 2H2O ® 2NaAlO2+ 3H2
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия металлов – самопроизвольный окислительно-восстановительный процесс разрушения металла под действием окружающей среды.
|
Коррозия
| |
 Химическая
Возникает в отсутствии электролита:
2Fe + 3Cl2 = 2FeCl3
4Al + 3O2 = 2Al2O3 Химическая
Возникает в отсутствии электролита:
2Fe + 3Cl2 = 2FeCl3
4Al + 3O2 = 2Al2O3
| Электрохимическая Происходит в присутствии электролита и сопровождается возникновением микротоков в микрогальваноэлементах |
Пример Рассмотрим электрохимическую коррозию, происходящую при контакте цинка с медью в щелочном растворе в присутствии кислорода:
| Zn | Cu |
| NaOH + H2O + O2 | |
|
| |
Выписываем окислительно-восстановительные потенциалы обоих металлов в щелочной среде по таблице «Стандартных окислительно-восстановительные потенциалов ряда металлов».
j(ZnO22-/Zn) = -1,22 В, j(Cu(OH)2/Cu) = -0,22 В.
Определяем по потенциалам более активный металл – Zn. Цинк разрушается в первую очередь, является восстановителем:
Zn0 – 2e + 4OH- ® ZnO22- + 2H2O.
Второй металл (Cu) не разрушается, он является проводником электронов:
 е
е
 Zn Zn
| Cu |
| NaOH + H2O + O2 | |
Окислителем в данном примере может быть O2 и H2O. Выписываем потенциалы окислителей для щелочной среды из таблицы «Стандартных окислительно-восстановительные потенциалов ряда металлов»:
 j(2Н2О/Н2) = -0,83 В
j(2Н2О/Н2) = -0,83 В
j(О2/4OH-) > j(2Н2О/Н2).
j(О2/4OH-) = +0,40 В
Окислитель выбираем с большим потенциалом (О2).
Процесс восстановления кислорода происходит на меди:
на Cu : O2 + 4e + 2H2O ® 4OH-
Суммарный процесс при коррозии латуни в щелочной среде в присутствии кислорода записываем в следующей форме:
| 2 | Zn0 – 2e + 4OH- ® ZnO22- + 2H2O |
| На Cu: 1 | O2 + 4e + 2H2O ® 4OH- |
| 2Zn0 + 8OH- + O2 + 2H2O ® 2ZnO22- + 4H2O + 4OH- | |
| 2Zn + 4OH- + O2 ® 2ZnO22- + 2H2O | |
Молекулярное уравнение коррозии:
2Zn + 4NaOH + O2 ® 2Na2ZnO2 + 2H2O
Более активный металл Zn – анод, Cu – катод:
 е
е
 (А) - Zn (А) - Zn
| Cu + (К) |
| NaOH + H2O + O2 | |
ЭЛЕКТРОЛИЗ РАСТВОРОВ
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрохимия открыла принципиально новые и чрезвычайно перспективные методы получения многих веществ. При электролизе расплавов получают щелочные и щелочноземельные металлы, алюминий, бериллий, магний.
В связи с растущей потребностью в жаростойких и сверхпрочных материалах важное значение приобретает получение порошков чистых тугоплавких металлов (вольфрама, молибдена, титана, циркония, ванадия, тантала, ниобия и др.) в результате электролиза расплава соответствующих веществ.
Современная техника предъявляет большие требования к чистоте материалов, в частности металлов. В цветной металлургии для очистки металлов от примесей применяют электролиз с растворимым анодом. Электролитическому рафинированию подвергают железо, медь, серебро, золото, свинец, олово, никель и другие металлы.
Важнейшая область прикладной электрохимии – гальванотехника, которая объединяет два направления: гальваностегию – получение гальванических покрытий на металлах и гальванопластику – электрохимическое получение точных металлических копий с рельефных поверхностей. Гальванопластика используется для нанесения металлических рисунков на полупроводники и непроводящие покрытия (например, в производстве печатных радиосхем для миниатюрных радиоприемников).
Гальванические покрытия наносят для защиты металлов от коррозии, а также в декоративных и специальных целях (увеличение отражательной способности волноводов и рефлекторов, уменьшение сопротивления электрических контактов). Покрытие осуществляют электролизом растворов как с растворимым анодом (никелирование, кадмирование, цинкование, лужение, серебрение), так и с нерастворимым (хромирование, золочение). Покрываемое изделие всегда является катодом.
Катодом называют электрод, на котором происходит восстановление; он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом; он заряжен положительно.
При электролизе водных растворов протекают процессы, связанные с электролизом воды (растворителя).
Катодные процессы
На катоде возможно восстановление:
· катионов металла Меn+ + nē = Me ;
· катиона водорода (свободного или в составе молекул воды).
2H+ + 2ē = H 2 ( в кислой среде) ;
2H2O + 2ē =H 2+ 2 OH – ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода. Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжении: 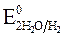 » - 1 В, т.е. потенциал выделения водорода на катоде гораздо более отрицательный, чем равновесный потенциал, отвечающий рН данного раствора.
» - 1 В, т.е. потенциал выделения водорода на катоде гораздо более отрицательный, чем равновесный потенциал, отвечающий рН данного раствора.
Перенапряжением называют сдвиг потенциала электрода от данного равновесного значения, вызванный замедленностью электрохимической реакции разряда или образования ионов при данной плотности тока.
Перенапряжение водорода очень сильно зависит от природы катода и состояния его поверхности. Самым незначительным оказывается перенапряжение водорода на гладкой платине. При выделении металлов на катоде, как правило, перенапряжение невелико.
Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы:
1. Активные металлы (Li - Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Неактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме - nē = Men+;
· молекул воды 2H2O - 4ē =О 2+ 4H+ ;
· анионов солей 2Cl - - 2ē = Cl2; NO2- - 2ē + H2O = NO3- + 2H+.
Анионы кислородосодержащих кислот, имеющие в своем составе атом элемента в высшей степени окисления (SO4 2-, NO3- и др.), при электролизе водных растворов на аноде не разряжаются. С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
Тема 1 Строение атома
Задание 1. Напишите электронные формулы атомов и ионов. Укажите валентные электроны атомов.
Задание 2. Распределите по квантовым ячейкам валентные электроны и определите какой это элемент.
Задание 3. Укажите значение главного и орбитального (побочного) квантовых чисел для подуровней
| Номер варианта | Задание 1 | Задание 2 | Задание 3 |
| 1 | Ag, Ba2+ | 2s22p2 | 2p |
| 2 | As, Ti4+ | 2s22p6 | 4f |
| 3 | Sr, In3+ | 3s23p3 | 3d |
| 4 | Xe, Br- | 3s2 | 3s |
| 5 | Cs, Ga3+ | 2s22p1 | 4p |
| 6 | F, Mg2+ | 3s23p1 | 5d |
| 7 | S, Li+ | 6s2 | 4s |
| 8 | N, S2- | 5s25p3 | 3p |
| 9 | Ne, Al3+ | 5s25p2 | 4d |
| 10 | Si, Na+ | 4s23d2 | 5p |
| 11 | O, I - | 5s24d2 | 5s |
| 12 | P, F- | 4s13d10 | 5f |
| 13 | Mg, Ar | 6s25d2 | 2s |
| 14 | K, S2- | 6s25d5 | 1s |
| 15 | Ca, Cl- | 6s26p3 | 5d |
| 16 | Al, Te2- | 5s25p1 | 1s |
| 17 | C, K+ | 6s25d4 | 6d |
| 18 | Se, Be2+ | 5s25p6 | 5f |
| 19 | Mn, Se2- | 6s15d10 | 7s |
| 20 | Cl, Si4+ | 5s14d10 | 4p |
| 21 | Si, Ge4+ | 5s25p4 | 5s |
| 22 | Na, B3+ | 6s26p6 | 6s |
| 23 | Zn, Hg2+ | 3s23p5 | 2p |
| 24 | Ar, Zn2+ | 2s22p2 | 3d |
| 25 | He, Hf | 3s23p3 | 2s |
| 26 | B, Y3+ | 3s23p1 | 3p |
| Номер варианта | Задание 1. | Задание 2. | Задание 3 |
| 27 | Au, P5+ | 3s23p6 | 4s |
| 28 | Cd, Br- | 2s22p4 | 4f |
| 29 | Ne, Sn2+ | 3s23p5 | 1s |
| 30 | At, Cr3+ | 4s1 | 5d |
Пример решения и оформления задания раздела 1.
1. Пример. Напишите электронные формулы атомов и ионов. Подчеркните валентные электроны.
4Ве: 1s22s2
9F–: 1s22s22p6.
2. Пример. Распределите по квантовым ячейкам валентные электроны и определите какой это элемент.
1s22s22p4 – это кислород 8O (8-й порядковый номер)

3. Пример. Укажите значение главного и орбитального (побочного) квантовых чисел для подуровней.
6d: n = 6
l = 2
Тема 2. Закономерности химических процессов
Термохимия
Задание 1. Приведите значение теплового эффекта реакции при стандартных условиях, укажите – это экзо- или эндотермическая реакция, (см. таблицу «термодинамических величин» в приложении).
Задание 2. Определите температуру, при которой устанавливается химическое равновесие реакции (см. таблицу «термодинамических величин» в приложении).
Задание 3. Сделайте вывод о возможности протекания данной реакции при стандартных условиях и при температуре 1500 К.
| Номер варианта | Реакция |
| 1 | 2SO2(г)+O2(г)Û2SO3(г) |
| 2 | 4NH3(г)+5O2(г)Û4NO(г)+6H2O(ж) |
| 3 | CO2(г)+C(графит)Û2CO2(г) |
| 4 | 4NO(г)Û2N2O(г)+O2(г) |
| 5 | CH4(г)ÛC(графит)+2H2(г) |
| 6 | CaO(тв)+H2(г)ÛCa(тв)+H2O(г) |
| 7 | 4HCl(г)+O2(г)Û2H2O(г)+2Cl2(г) |
| 8 | N2(г)+3H2(г)Û2NH3(г) |
| 9 | 2HNO3(г)ÛH2(г)+N2(г)+3O2(г) |
| 10 | 2N2(г)+O2(г)Û2N2O(г) |
| 11. | C(графит)+H2O(г)ÛCO(г)+H2(г) |
| 12 | CO(г)+H2O(г)ÛCO2(г)+H2(г) |
| 13 | 2Ag2O(тв)Û4Ag(тв)+O2(г) |
| 14 | SiF4(г)ÛSi(тв)+2F2(г) |
| 15 | 2CO(г)+O2(г)Û2CO2(г) |
| 16 | 3S(тв)+2H2O(ж)ÛSO2(г)+2H2S(г) |
| 17 | SO2(г)+NO2(г)ÛSO3(г)+NO(г) |
| 18 | C(графит)+2F2(г)ÛCF4(г) |
| 19 | 2H2S(г)+O2(г)Û2S(тв)+2H2O(г) |
| 20 | Cl2(г)+2O2(г)Û2ClO2(г) |
| 21 | 2H2(г)+O2(г)Û2H2O(г) |
| 22 | 2NO2(г)Û2NO(г)+O2(г) |
| 23 | O2(г)+2F2(г)Û2OF2(г) |
| 24 | H2S(г)+Cl2(г)Û2HCl(г)+S(тв) |
| 25 | CO(г)+H2(г)ÛC(графит) + H2O(г) |
| 26 | SO2(г)+2H2S(г)Û3S(тв)+2H2O(ж) |
| 27 | С(алмаз)+H2O(г)ÛCO(г)+H2(г) |
| 28 | 2N2O(г)+O2(г)Û4NO(г) |
| 29 | Si(тв)+3F2(г)ÛSiF6(г) |
| 30 | CO(г)+Cl2(г)ÛCOCl2(г) |
Пример решения и оформления задания раздела
Пример. Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в реакции CO2(г) + С (графит) = 2CO(г). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении.
Решение :
· Производим расчет стандартного изменения энтальпии реакции по следствию из закона Гесса:
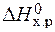 = å (n
= å (n 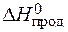 ) – å (m
) – å (m 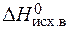 ) = 2
) = 2 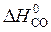 – (
– ( 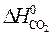 +
+ 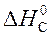 ) =
) =
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
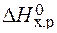 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Стандартное изменение энтропии реакции также определяем по следствию из закона Гесса:
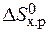 = å (n
= å (n 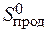 ) – å (m
) – å (m 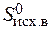 ) = 2
) = 2 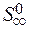 – (
– ( 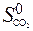 +
+ 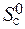 ) = 2× 197,5 – (213,7 + 5,7) = 175,6 Дж/К = 176,5×10-3 кДж/К.
) = 2× 197,5 – (213,7 + 5,7) = 175,6 Дж/К = 176,5×10-3 кДж/К.
· Стандартное изменение энергии Гиббса реакции равно:
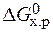 =
= 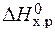 – Т×
– Т× 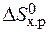 = 172,5 –298×176,5×10-3 = 120,2 кДж.
= 172,5 –298×176,5×10-3 = 120,2 кДж.
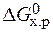 > 0, при Т = 298К прямая реакция невозможна.
> 0, при Т = 298К прямая реакция невозможна.
· Определим температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями DН и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 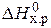 – Т×
– Т× 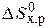
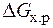 =
= 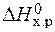 – Т×
– Т× 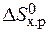 = 0 Þ Т =
= 0 Þ Т = 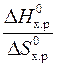 =
= 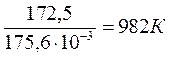 .
.
Химическое равновесие
Задание 1. Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций.
Задание 2. Укажите направление смещения равновесия при изменении условий:
а) при увеличении парциального давления одного из исходных газообразных веществ;
б) понижении давления;
в) повышении температуры.
| Номер варианта | Уравнение реакции | DН0, кДж/моль |
| 1 | 2N2O (г) + O2 (г)  4NO (г) 4NO (г)
| 196 |
| 2 | 4NH3(г) + 5 O2 (г)  4NO (г) + 6 H2O (г) 4NO (г) + 6 H2O (г)
| 908 |
| 3 | 2H2S (г) + 3 O2 (г)  2 SO2 (г) + 2 H2O (г) 2 SO2 (г) + 2 H2O (г)
| 1038 |
| 4 | CO2 (г) + H2 (г)  CO(г) + H2O(г) CO(г) + H2O(г)
| 41 |
| 5 | 2 H2 (г) + O2 (г)  2 H2O (г) 2 H2O (г)
| – 484 |
| 6 | 2 SO2 (г) + O2(г)  2SO3(г) 2SO3(г)
| – 196 |
| 7 | 2NO (г) + O2 (г)  2 NO2 (г) 2 NO2 (г)
| – 112 |
| 8 | Fe3O4 (т) + H2 (г) 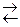 3 FeO (т) + H2O (г) 3 FeO (т) + H2O (г)
| 62 |
| 9 | FeO (т) + H2 (г)  Fe (т) + H2O (г) Fe (т) + H2O (г)
| – 272 |
| 10 | C( графит) + H2O (г) 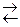 CO (г) + H2 (г) CO (г) + H2 (г)
| 131 |
| 11 | CO (г) + H2O (г)  CO2 (г) + H2(г) CO2 (г) + H2(г)
| – 41 |
| 12 | SO3 (г) + H2 (г)  SO2 (г) + H2O (г) SO2 (г) + H2O (г)
| – 144 |
| 13 | H2 (г) + Cl2 (г)  2HCl (г) 2HCl (г)
| – 184 |
| 14 | FeO (т) + CO (г)  Fe (т) + CO2 (г) Fe (т) + CO2 (г)
| – 11 |
| 15 | 2ZnS (т) + 3 O2 (г) 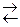 2 ZnO (т) + 2SO2 (г) 2 ZnO (т) + 2SO2 (г)
| – 878 |
| 16 | N2 (г) + 3 H2 (г)  2 NH3 (г) 2 NH3 (г)
| – 92 |
| 17 | СaCO3 (т)  СaO (т) + CO2 (г) СaO (т) + CO2 (г)
| 175 |
| 18 | 2 MgCl2 (т) + O2 (г)  2 MgO (т) + 2 Cl2 (г) 2 MgO (т) + 2 Cl2 (г)
| 82 |
| 19 | Сa(OH)2 (т)  CaO (т) + H2O (г) CaO (т) + H2O (г)
| 48 |
| 20 | H2O (г) + CO (г) 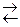 CO2 (г) + H2 (г) CO2 (г) + H2 (г)
| – 41 |
| 21 | Si(тв) +3F2(г)  SiF6(г) SiF6(г)
| 1614 |
| 22 | CO (г) + H2 (г)  C( графит) + H2O (г) C( графит) + H2O (г)
| – 131 |
| 23 | SO2 (г) + H2O (г)  SO3 (г) + H2 (г) SO3 (г) + H2 (г)
| 144 |
| 24 | MgO (т) + CO2 (г)  MgCO3 (т) MgCO3 (т)
| – 98,5 |
| 25 | СaO (т) + CO2 (г)  СaCO3 (т) СaCO3 (т)
| – 175 |
| 26 | 2 MgO (т) + 2 Cl2 (г)  2 MgCl2 (т) + O2 (г) 2 MgCl2 (т) + O2 (г)
| – 82 |
| 27 | СaO (т) + SO3 (г)  СаSO4 (т) СаSO4 (т)
| – 393,7 |
| Номер варианта | Уравнение реакции | DН0, кДж/моль |
| 28 | 2HCl (г)  H2 (г) + Cl2 (г) H2 (г) + Cl2 (г)
| 184 |
| 29 | C( графит) + 2F2 (г)  CF4 (г) CF4 (г)
| 1614 |
| 30 | Fe2O3 (т) + H2 (г)  2FeO (т) + H2O (г) 2FeO (т) + H2O (г)
| – 26 |
Пример решения и оформления задания раздела
Пример. Напишите математическое выражение Кс (константы равновесия) для обратимой реакции N2 + 3H2  2NH3; DH 0х.р = – 92 кДж и укажите направление смещения равновесия при изменении условий:
2NH3; DH 0х.р = – 92 кДж и укажите направление смещения равновесия при изменении условий:
1) при увеличении концентрации NH3;
2) при увеличении давления; 
3) при понижении температуры.
Константа равновесия записывается следующим образом:
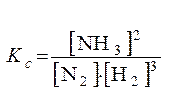
При изменении параметров равновесие смещается:
 1) с увеличением
1) с увеличением 
 (влево) в обратном направлении;
(влево) в обратном направлении;
 2) с увеличением общего давления (вправо) в прямом направлении;
2) с увеличением общего давления (вправо) в прямом направлении;
 3) при понижении температуры (вправо) в прямом направлении.
3) при понижении температуры (вправо) в прямом направлении.
Дата: 2018-11-18, просмотров: 1162.