1. Основания взаимодействуют с кислотами, образуя соль и воду:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
2. С кислотными оксидами, образуя соль и воду:
Ca(OH)2 + CO2 = CaCO3 + H2O
3. Щелочи реагируют с амфотерными оксидами и гидроксидами, образуя соль и воду:
2NaOH + Cr2O3 = 2NaCrO2 + H2O
KOH + Cr(OH)3 = KCrO2 + 2H2O
4. Щелочи взаимодействуют с растворимыми солями, образуя либо слабое основание, либо осадок, либо газ:
2NaOH + NiCl2 = Ni(OH)2¯ + 2NaCl
слабое
основание
2KOH + (NH4)2SO4 = 2NH3 + 2H2O + K2SO4
газ
Ba(OH)2 + Na2CO3 = BaCO3¯ + 2NaOH
осадок
5. Щелочи реагируют с некоторыми металлами, которым соответствуют амфотерные оксиды:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
6. Действие щелочи на индикатор:
OH- + фенолфталеин ® малиновый цвет
OH- + лакмус ® синий цвет
7. Разложение некоторых оснований при нагревании:
t
Сu(OH)2 ® CuO + H2O
Амфотерные гидроксиды – химические соединения, проявляющие свойства и оснований, и кислот. Амфотерные гидроксиды соответствуют амфотерным оксидам (см. п. 3.1). Амфотерные гидроксиды записывают, как правило, в форме основания, но их можно представить и в виде кислоты:
Zn(OH)2 Û H2ZnO2
основание кислота
Химические свойства амфотерных гидроксидов:
1. Амфотерные гидроксиды взаимодействуют с кислотами и кислотными оксидами:
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + SO3 = BeSO4 + H2O
2. Взаимодействуют со щелочами и основными оксидами щелочных и щелочноземельных металлов:
Al(OH)3 + NaOH = NaAlO2 + 2H2O;
H3AlO3 кислота метаалюминат натрия
(H3AlO3 ® HAlO2 + H2O)
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Все амфотерные гидроксиды являются слабыми электролитами.
Соли
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. Соли представляют собой продукты полного или частичного замещения ионов водорода ионами металла (или аммония) у кислот. Типы солей: средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения катионов водорода у кислот ионами металла (или аммония) : Na2CO3, NiSO4, NH4Cl и т. д.
Химические свойства средних солей :
1. Соли взаимодействуют с кислотами, щелочами и другими солями, образуя либо слабый электролит, либо осадок, либо газ:
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
Na2SO4 + Ba(OH)2 = BaSO4¯ + 2NaOH
CaCl2 + 2AgNO3 = 2AgCl¯ + Ca(NO3)2
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH
слабая
кислота
NiSO4 + 2KOH = Ni(OH)2¯ + K2SO4
слабое
основание
NH4NO3 + NaOH = NH3 + H2O + NaNO3
газ
2. Соли взаимодействуют с более активными металлами. Более активный металл вытесняет менее активный из раствора соли (приложение 1 Табл. 1. 5.).
Zn + CuSO4 = ZnSO4 + Cu
Кислые соли – это продукты неполного замещения катионов водорода у кислот ионами металла (или аммония): NaHCO3, NaH2PO4, Na2HPO4 и т. д. Кислые соли могут быть образованы только многоосновными кислотами. Практически все кислые соли хорошо растворимы в воде.
Получение кислых солей и перевод их в средние:
1. Кислые соли получают при взаимодействии избытка кислоты или кислотного оксида с основанием:
H2CO3 + NaOH = NaHCO3 + H2O
CO2 + NaOH = NaHCO3
2. При взаимодействии избытка кислоты с основным оксидом:
2H2CO3 + CaO = Ca(HCO3)2 + H2O
3. Кислые соли получают из средних солей, добавляя кислоту:
· одноименную
Na2SO3 + H2SO3 = 2NaHSO3 ;
· другую
Na2SO3 + HCl = NaHSO3 + NaCl
4. Кислые соли переводят в средние, используя щелочь:
NaHCO3 + NaOH = Na2CO3 + H2O
Основные соли – это продукты неполного замещения гидроксогрупп (ОН-) основания кислотным остатком: MgOHCl, AlOHSO4 и т.д. Основные соли могут быть образованы только слабыми основаниями многовалентных металлов. Эти соли, как правило, труднорастворимы.
Получение основных солей и перевод их в средние:
1. Основные соли получают при взаимодействии избытка основания с кислотой или кислотным оксидом:
Mg(OH)2 + HCl = MgOHCl¯ + H2O
гидроксо-
хлорид магния
Fe(OH)3 + SO3 = FeOHSO4¯ + H2O
гидроксо-
сульфат железа (III)
2. Основные соли образуются из средней соли при добавлении недостатка щелочи:
Fe2(SO4)3 + 2NaOH = 2FeOHSO4 + Na2SO4
3. Основные соли переводят в средние, добавляя кислоту (лучше ту, которая соответствует соли):
MgOHCl + HCl = MgCl2 + H2O
2MgOHCl + H2SO4 = MgCl2 +MgSO4 + 2H2O
ЭЛЕКТРОЛИТЫ
Электролиты – это вещества, распадающиеся на ионы в растворе под влиянием полярных молекул растворителя (Н2О). По способности к диссоциации (распаду на ионы) электролиты условно делят на сильные и слабые. Сильные электролиты диссоциируют практически полностью (в разбавленных растворах), а слабые распадаются на ионы лишь частично.
К сильным электролитам относятся:
· сильные кислоты ;
· сильные основания – щелочи ;
· практически все растворимые соли.
К слабым электролитам относятся:
· слабые кислоты ;
· основания – не щелочи;
· Н2О.
Одной из основных характеристик слабого электролита является константа диссоциации – К. Например, для одноосновной кислоты,
HA Û H+ + A- ,
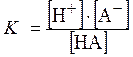 ,
,
где [H+] – равновесная концентрация ионов H+;
[A-] – равновесная концентрация анионов кислоты А-;
[HA] – равновесная концентрация молекул кислоты,
Для слабого основания
MOH Û M+ + OH- ,
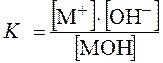 ,
,
где [M+] – равновесная концентрация катионов M+;
[OH-] – равновесная концентрация гидроксид ионов ОН-;
[MOH] – равновесная концентрация молекул слабого основания.
Константы диссоциации некоторых слабых электролитов (при t = 25 °С)
| Вещество | К | Вещество | К |
| 1 | 2 | 3 | 4 |
| HCOOH | K = 1,8×10-4 | H3PO4 | K1 = 7,5×10-3 |
| CH3COOH | K = 1,8×10-5 | K2 = 6,3×10-8 | |
| HCN | K = 7,9×10-10 | K3 = 1,3×10-12 | |
| H2CO3 | K1 = 4,4×10-7 K2 = 4,8×10-11 | HClO H3BO3 | K = 2,9×10-8 K1 = 5,8×10-10 |
| 1 | 2 | 3 | 4 |
| HF | K = 6,6×10-4 | K2 = 1,8×10-13 | |
| HNO2 | K = 4,0×10-4 | K3 = 1,6×10-14 | |
| H2SO3 | K1 = 1,7×10-2 | H2O | K = 1,8×10-16 |
| K2 = 6,3×10-8 | NH3× H2O | K = 1,8×10-5 | |
| H2S | K1 = 1,1×10-7 | Al(OH)3 | K3 = 1,4×10-9 |
| K2 = 1,0×10-14 | Zn(OH)2 | K1 = 4,4×10-5 | |
| H2SiO3 | K1 = 1,3×10-10 | K2 = 1,5×10-9 | |
| K2 = 1,6×10-12 | Cd(OH)2 | K2 = 5,0×10-3 | |
| Fe(OH)2 | K2 = 1,3×10-4 | Cr(OH)3 | K3 = 1,0×10-10 |
| Fe(OH)3 | K2 = 1,8×10-11 | Ag(OH) | K = 1,1×10-4 |
| K3 = 1,3×10-12 | Pb(OH)2 | K1 = 9,6×10-4 | |
| Cu(OH)2 | K2 = 3,4×10-7 | K2 = 3,0×10-8 | |
| Ni(OH)2 | K2 = 2,5×10-5 |
Правила составления уравнений диссоциации электролитов:
1. При диссоциации сильных электролитов ставится знак « = » (равенства) или « ® » (одна стрелочка). Этот знак обозначает полную диссоциацию.
2. При диссоциации слабых ( и средней силы) электролитов используется знак « Û » (обратимости). Этот знак обозначает частичную диссоциацию.
Правила написания ионных уравнений:
На ионы расписываются:
1.) сильные кислоты;
2.) щелочи;
3.) растворимые соли.
| Сильные электролиты | Слабые электролиты |
| Основания: Са(OH)2 = Ca2+ + 2OH- Кислоты: HCl = H++Cl- Соли: Na2CO3=2Na++CO32- | Основания: Fe(OH)2 ÛFeOH+ + OH- I ступень FeOH+ÛFe2++OH- II ступень |
| Сильные электролиты | Слабые электролиты |
| KH2PO4=K++H2PO4- анион слабой кислоты H2PO4-ÛH++HPO42- HPO42-ÛH++PO43- AlOHCl2ÛAlOHCl2 = AlOH2++2Cl- осадок растворимая катион слабого часть основания AlOH2+ÛAl3++OH- | Кислоты:
H2CO3ÛH++HCO3- I ступень
HCO3-ÛH++CO32- II ступень
Амфотерные гидроксиды:
1.  Zn(OH)2ÛZnOH++OH- по осн. Zn(OH)2ÛZnOH++OH- по осн.
 ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл. HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH- ZnOH+ÛZn2++OH- типу
2. H2ZnO2ÛH++HZnO2- по кисл. HZnO2-ÛH++ZnO22- типу
Вода:
H2OÛH++OH-
|
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Важнейшей характеристикой количественного содержания компонентов в системе является концентрация растворов.
Концентрацией растворов называют определенное массовое (или объемное) содержание растворенного вещества в определенном массовом (или объемном) количестве растворителя или раствора.
Существуют несколько методов выражения концентрации растворов. Рассмотрим самые распространенные из них.
Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора:
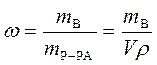 ,
,
где w - массовая доля растворенного вещества, безразмерная величина;
mВ - масса растворенного вещества, г;
mР-РА - масса раствора, г;
V - объем раствора, мл;
ρ - плотность раствора, г/мл.
Процентная концентрация:

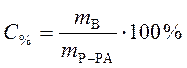 ,
,
где С% - процентная концентрация, %;
mВ - масса растворенного вещества, г;
mР-РА - масса раствора, г.
Молярная концентрация, или молярность, – число молей растворенного вещества в 1 дм3 (1 литр) раствора:
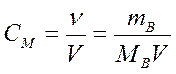 ,
,
где СМ – молярная концентрация, или молярность (иногда обозначают М);
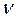 - количество (число моль) растворенного вещества, моль;
- количество (число моль) растворенного вещества, моль;
mВ - масса растворенного вещества, г;
МВ - молярная масса растворенного вещества, г/моль;
V - объем раствора, дм3 (л).
ГИДРОЛИЗ СОЛЕЙ
Гидролиз – это процесс взаимодействия соли с водой, в результате которого происходит смещение ионного равновесия воды и изменение значения рН раствора. Возможность и характер протекания гидролиза определяется природой основания и кислоты, образующих соль.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их водные растворы нейтральны.
KNO3+H2O ¹; pH=7.
В гидролизе участвуют ионы слабого основания и/или слабой кислоты.
Гидролиз солей, образованных сильной кислотой и слабым основанием, например NH4Cl:
NH4Cl = NH4++Cl-
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH Û NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4Cl + H2O Û NH4OH + HCl – кислая среда (рН < 7).
Гидролиз солей, образованных слабой кислотой и сильным основанием, например Na2SO3:
Na2SO3 = 2Na+ + SO32-
Гидролизу подвергается анион слабой кислоты SO32-:
1-я ступень: SO32-+HOH Û HSO3-+OH- (ионы OH- в избытке).
Молекулярное уравнение 1-й ступени:
Na2SO3 + H2O Û NaHSO3 + NaOH – щелочная среда (рН > 7).
При обычных условиях гидролиз протекает главным образом по первой ступени.
Гидролиз солей, образованных слабым основанием и слабой кислотой, Например (NH4)2CO3, Al2S3 и т. д. Гидролиз соли происходит как по катиону, так и по аниону. В этом случае гидролиз соли протекает до конца: в уравнении происходит замена знака «Û» на «=», а рН среды определяется силой кислоты и основания:
NH4ClO = NH4+ + ClO-
NH4+ + ClO- + HOH = NH4OH + HClO
NH4ClO + H2O = NH4OH + HClO
K (HClO) = 3×10-8 < K (NH4OH) = 1,8×10-5, так как основание является более сильным электролитом, чем кислота. Среда слабощелочная рН > 7.
Совместный гидролиз двух солей Если в растворе одновременно присутствуют ионы, связывающие Н+ и ОН-, то в соответствии с принципом Ле Шателье равновесие смещается в сторону усиления процесса гидролиза. Гидролиз может протекать необратимо с образованием малорастворимого и газообразного веществ.
В качестве примера можно рассмотреть совместный гидролиз следующих солей:
Al2(SO4)3 + K2S + H2O ®
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S
Al2(SO4)3 + 3K2S + 6H2O = 2Al(OH)3¯ + 3H2S + 3К2SO4, pH » 7
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ (ОВР)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ. Например:
+4 -1 +2 0
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Дата: 2018-11-18, просмотров: 704.