Гидрирование алкинов и алкенов протекает примерно в одних и тех же условиях. Каталитическое гидрирование алкинов в присутствии таких катализаторов, как никель, платина, палладий, происходит с образованием алкана.
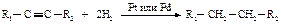
Можно подобрать условия, в которых каталитическое присоединение водорода к алкинам может происходить в одну стадию с образованием алкена.
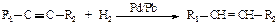
При этом используют специальные “отравленные” катализаторы – катализаторы с пониженной активностью. Примером такого катализатора является палладий, нанесенный на карбонат кальция и дезактивированный ацетатом свинца. Это катализатор Линдлара, который позволяет восстанавливать алкины до алкенов, предотвращая дальнейшее восстановление до алкана. Гидрирование на этом катализаторе протекает стереоселективно с образованием до 96 % цис-алкенов и 5-10 % транс-алкена.
Реакция, предпочтительно приводящая к одному из нескольких возможных пространственных изомеров, называется стереоселективной
Восстановление алкинов в жидком аммиаке ведёт преимущественно к образованию транс-алкена.
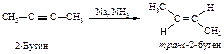
Это объясняется тем, что реакция протекает через образование более устойчивого (пространственно незатруднённого) радикала.
Сначала натрий отдает электрон углероду тройной связи и образуется анион-радикал.
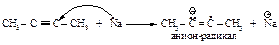
Затем анион-радикал взаимодействует с аммиаком и образуется радикал.
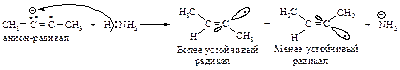
Реакция завершается переносом электрона от натрия и взаимодействием образовавшегося аниона с аммиаком.
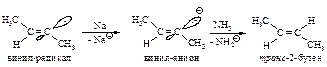
Таким же образом алкины восстанавливаются литийалюминийгидридом.
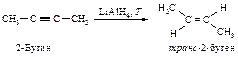
Реакции электрофильного присоединения
Галогенирование
Алкины, как и алкены, имеют доступные для атаки p-электроны и вступают в реакции электрофильного присоединения. Но из-за повышенной электроотрицательности sp-гибридизованных атомов углерода и укороченности связей поляризуемость p -электронов тройной связи СºС уменьшена, поэтому тройная углерод-углеродная связь по сравнению с двойной связью С=С менее реакционноспособна в отношении электрофильных реагентов.
Электрофильное присоединение галогенов (хлора, брома) к алкинам протекает аналогично реакции присоединения к алкенам.
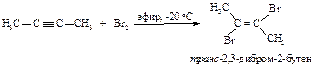
В первой быстройстадии p-электроны тройной связи отталкивают электроны ближайшего атома брома к удалённому атому брома; происходит поляризация молекулы брома и образование p-комплекса.
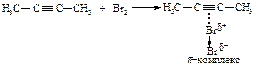
Во второй стадии p-комплекс перестраивается в циклический бромониевый катион, который является простейшим устойчивым сопряжённым соединением (число p-электронов равно двум). Эта стадия является медленной скорость лимитирующей.
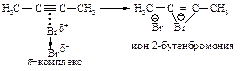
На третьей стадии происходит присоединение аниона брома преимущественно в транс-положение, со стороны, противоположной брому образовавшегося катиона, так как цис-присоединение стерически затруднено из-за большого объёма электронных оболочек брома.
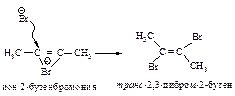
Эта реакция является примером реакции с высокой степенью стереоселективности.
При избытке брома в качестве конечного продукта бромирования ацетилена получается 2,2,3,3-тетрабромбутан.
Гидрогалогенирование
Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом) подобно алкенам. Присоединение происходит в две стадии, по правилу Марковникова.
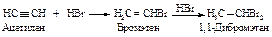
Механизм реакции. Образующийся в первой быстрой стадии p-комплекс во второй медленной стадии превращается в s -комплекс - карбокатион.
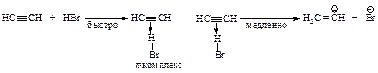
В третьей стадии происходит стабилизация карбокатиона – взаимодействие с анионом брома.
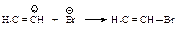
Взаимодействие бромалкена со второй молекулой бромоводорода происходит также по правилу Марковникова.
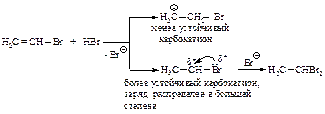
Гидратация
Присоединение воды к алкинам протекает в присутствии серной кислоты и солей двухвалентной ртути (реакция Кучерова).
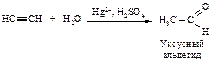
Гидратация гомологов ацетилена происходит в соответствии с правилом Марковникова.
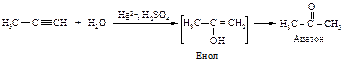
Ионы ртути образуют с молекулами алкинов p-комплексы, которые увеличивают растворимость алкинов в воде. Присоединение протона к алкину является стадией, определяющей скорость реакции. При этом разрывается p -связь, и образуется ненасыщенный спирт с группировкой, содержащей при углероде в sp2 -состоянии группу -ОН (енол).
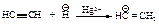
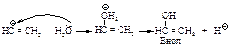
Енолы обычно неустойчивы и быстро превращаются в карбонильные соединения. В случае этенола, образующегося из ацетилена, конечным продуктом является ацетальдегид, из енолов, получающихся из других алкинов, образуются кетоны.
Механизм превращения енола I в альдегид состоит в следующем: протон присоединяется к углероду при двойной связи с образованием карбокатиона II, стабилизация которого происходит за счёт отрыва протона от кислорода с образованием уксусного альдегида.
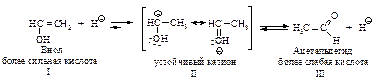
Перегруппировка енола в альдегид является примером превращения более сильной кислоты в более слабую. Протон легко отщепляется от кислорода енола I. Обратная реакция – отщепление протона от атома углерода с образованием енола I происходит очень трудно.
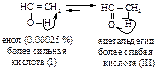
Равновесие между енолом и карбонилсодержащим соединением представляет собой прототропное равновесие, т.е. равновесие между структурами, которые отличаются положением водорода и кратной связи. Этот тип превращений называют также кето-енольной таутомерией (динамическая изомерия).
Каталитическая гидратация алкинов протекает легче, чем гидратация алкенов. Примером селективной гидратации тройной связи в присутствии двойной связи может служить реакция превращения винилацетилена в метилвинилкетон.
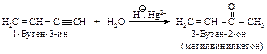
Гидроборирование
Другой способ присоединения элементов воды (Н и ОН) состоит в реакции присоединения борана по тройной связи с последующим окислением триалкенилборана пероксидом водорода в щелочной среде.
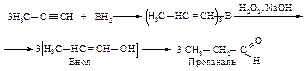
Образовавшийся виниловый спирт изомеризуется в более устойчивый альдегид (если алкин имеет концевую тройную связь) или кетон.
Дата: 2018-12-21, просмотров: 432.