|
|
Соединение
Связи между атомами С
Связи С–Н
СºС
ºС–С
Н–Сº
Сsp3–Н
Особый интерес представляет связь ºС-Н. Эта связь короче и прочнее аналогичных связей углерод-водород в алкенах и алканах (табл. 10.2).
Таблица 10.2
Характеристики связей С-Н в алканах, алкенах и алкинах
| Углеводород | Длина, l×102, нм | Энергия Е, кДж/моль | Доля s-орбитали атома углерода, % | Дипольный момент m, Д |
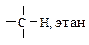
| 11,0 | 405 | 25,0 | 0,3 |
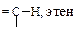
| 10,9 | 435 | 33,3 | 0,6 |
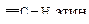
| 10,6 | 464 | 50,0 | 1,08 |
Связь ºС–Н имеет заметную полярность, связанную с большей долей s-состояния гибридной орбитали и, вследствие этого, с большей близостью электронной пары связи ºС–Н к углероду.
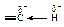
В результате смещения электронного облака s-связи от атома водорода к атому углерода атом водорода становится отчасти положительно заряженным - кислотным.
Энергия диссоциации связи углерод-водород в ацетилене ºС–Н больше, чем в этилене; sp-гибридизация затрудняет гомолитический разрыв связи ºС–Н с образованием радикалов, но облегчает гетеролитический разрыв этой связи с образованием ионов.
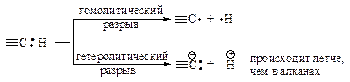
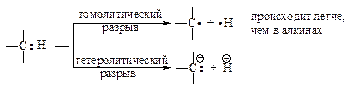
Физические свойства
Алкины малополярные соединения, их физические свойства сходны со свойствами алканов и алкенов: они также нерастворимы в воде, но растворимы в таких органических растворителях, как эфир, четырёххлористый углерод, бензол; плотность их меньше плотности воды. Низшие алкины - газы; температуры кипения алкинов повышаются с увеличением числа атомов углерода; разветвление цепи в молекуле изомера понижает температуру кипения.
Отличительным свойством ацетилена и его гомологов с одной алкильной группой является поглощение в области 3300 см-1 , соответствующее валентным колебаниям n (ºС–Н). Увеличение частоты в ряду n (Сsp3 –H), n (Сsp2 –H), n (Сsp –H) объясняется увеличением доли s-состояния гибридных орбиталей атомов углерода, образующих связи С–Н, при этом связь ºС–Н становится более короткой, прочной и более жёсткой.
Благодаря наличию частичных положительных зарядов на атомах водорода групп ºС–Н между атомом водорода ацетилена и атомами кислорода и азота других органических соединений (кетонов, эфиров, аминов) возникает сильное диполь-дипольное взаимодействие.
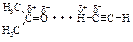
Поэтому ацетилен достаточно хорошо растворим в полярных органических растворителях.
Химические свойства
Химические свойства алкинов обусловлены их способностью реагировать двумя путями:
1). Посредством раскрытия кратной связи - реакции присоединения;
2). Посредством замещения атома водорода при углероде с тройной связью.
Реакции присоединеня
Дата: 2018-12-21, просмотров: 362.