По результатам двух параллельных определений в опыте 2 вычислите среднее значение рНср раствора. В соответствии с формулой:
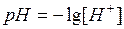
рассчитайте концентрацию ионов водорода;
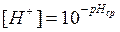 .
.
Вычислите относительную ошибку эксперимента, сравнив полученные значения рНср с точным значением рНточн, определенным в опыте 3 при помощи иономера:

Контрольные вопросы
1. Что такое произведение растворимости?
2. В чем состоит процесс автопротолиза воды?
3. Каков физический смысл понятия «ионное произведение воды»? Каков математический смысл понятия «водородныйпоказатель»?
4. При какой температуре рН нейтрального водного раствора равно 7?
5. Как изменяется ионное произведение воды с повышением температуры?
6. Рассчитайте рН 0,001 н. раствора одноосновной кислоты, приняв степень ее диссоциации равной 20%.
7. Рассчитайте рН 0,01 н. раствора аммиака, степень диссоциации которого 1%.
8. Определите, какие индикаторы и в какой последовательности Вы будете применять при определении рН: а) 0,003 н. раствора азотной кислоты; б) 0,003 н. раствора гидроксида кальция.
9. На чем основано действии рН индикаторов?
10. На чем основана работа иономера?
Гидролиз солей
Цель работы:
Проведение гидролиза некоторых солей, изучение влияния состава солей и внешних условий на полноту их гидролиза.
Теоретическая часть
Гидролиз соли – процесс взаимодействия соли с водой, приводя щий к образованию слабодиссоциирующих частиц (молекул или ионов). Гидролиз солей качественно можно рассматривать как результат поляризационного взаимодействия ионов соли с их гидратной оболочкой и упрощенно представить следующими схемами:
К n+ + НОН Û КОН(n–1)+ + Н+,
А n– + НОН Û НА(n–1)– + ОН– .
Гидролиз обусловлен образованием малодиссоциирующих частиц КОН(n–1)+ и НА(n–1)–
Чем больше заряд и меньше радиус ионов соли, тем сильнее их поляризационное взаимодействие с водой, слабее диссоциация образующихся частиц КОН(n–1)+ и НА(n–1)–, и в большей степени происходит гидролиз.
Поляризующее влияние на молекулы воды невелико у катионов щелочных и щелочноземельных металлов (сильные основания), однозарядных анионов, и некоторых двухзарядных (сильные кислоты). Поэтому соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются.
Возможны следующие случаи гидролиза солей:
1. по аниону,
2. по катиону,
3. по катиону и аниону одновременно.
Гидролиз по аниону. Ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (К2СО3, Na2S, Na2SO3, K3PO4 и др.). При гидролизе создается щелочная среда (рН > 7). Например:
CH3COONa → СН3СОО– + Na+,
Na+ + НОН → реакция не идет,
СН3СОО– + НОН ↔ СН3СООН + ОН– .
Молекулярное уравнение гидролиза:
CH3COONa + НОН ↔ СН3СООН + NaOH.
Данный процесс обратимый, равновесие гидролиза сильно смещено влево, поскольку К(Н2О) < К(СН3СООН).
Гидролиз многозарядного аниона протекает ступенчато и при обычных условиях главным образом идет только по первой ступени. Например:
Na2SO3 → 2Na+ + SO32–,
Na+ + НОН → реакция не идет,
SO32– + НОН ↔ H S О3– + ОН– (1 ступень),
HSO3– + НОН ↔ H2SO3 + ОН– (2 ступень).
Молекулярные уравнения соответственно имеют вид:
Na2SO3 + HOH ↔ NaHSO3 + NaOH,
NaHSO3 + НОН ↔ H2SO3 + NaOH.
Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.). Среда при гидролизе кислая (рН < 7). Например:
С u С12 → С u2+ + С l–,
С l– + НОН → реакция не идет,
С u2+ + НОН ↔ С u ОН+ + Н+ (1 ступень).
Молекулярное уравнение первой ступени гидролиза
С u С l2 + НОН ↔ CuOHCl + HCl.
Гидролизом по второй ступени при обычных условиях можно пренебречь.
Гидролиз по катиону и аниону. По катиону и аниону гидролизуются соли, образованные катионом слабого основания и анионом слабой кислоты. Например:
CH3COONH4 → СН3СОО– + NH4+,
СН3СОО– + НОН ↔ СН3СООН + ОН– ,
NH4+ + НОН ↔ NH4OH + Н+,
СН3СОО– + NH4+ + НОН ↔ СН3СООН + NH4OH.
Молекулярное уравнение
CH3COONH4 + НОН ↔ СН3СООН + NH4OH.
Гидролиз в данном случае протекает довольно интенсивно. Образующиеся при гидролизе ионы Н+ и ОН– связываются в молекулы Н2О, что усиливает гидролиз и по катиону, и по аниону. Реакция среды зависит от соотношения констант диссоциации образующихся кислоты и основания.
Если кислота и основание, образующиеся в процессе гидролиза, уходят из зоны протекания реакции (в виде осадка или газа), то гидролиз может протекать практически необратимо. Так, например, А12S3 при контакте с водой полностью превращается в малорастворимый гидроксид алюминия и в газообразный сероводород:
Al2S3 + 6HOH → 2Al(OH)3↓ + 3H2S↑.
По этой же причине, смешивая водные растворы А l С l3 и Na2S, нельзя получить А l2S3:
2А l С l3 + 3Na2S + 6HOH → 2Al(OH)3↑ + 3H2S↓ + 6NaCl,
2Al3+ + 3S2– + 6H2O → 2Al(OH)3 + 3H2S.
Из-за взаимного усиления гидролиза по катиону и по аниону (совместного гидролиза) в водном растворе также невозможно синтезировать карбонаты алюминия, хрома(III), железа (III), сульфид хрома (III), некоторые другие соли. Приведем еще один пример совместного гидролиза:
2А l С l3 + 3Na2CO3 + 3НОН → 2А l(ОН)3↓ + 3CO2↑ + 6NaCl,
2А l3+ + 3СО32– + 3НОН → 2А l(ОН)3↓ + 3СО2↑.
Приборы и реактивы
1. Универсальная индикаторная бумага.
2. Пробирки.
3. Пипетки.
4. Спиртовая горелка.
5. Растворы солей: хлорид калия, сульфат алюминия, нитрат свинца (II), карбонат натрия, сульфат железа (II), хлорид железа (III), сульфит натрия, хлорид сурьмы (III), сульфид натрия.
6. Вода дистиллированная.
Порядок выполнения работы
Дата: 2018-12-21, просмотров: 683.