В четыре конические пробирки внесите по 5 – 7 капель растворов хлорида железа (III) и роданида калия (или аммония). Раствор перемешайте, встряхивая пробирки, и поставьте в штатив. Одну пробирку с полученным раствором сохраните в качестве контрольной. В остальные пробирки добавьте следующие реактивы: в первую – 1 каплю насыщенного раствора хлорида железа (III), во вторую – 1 каплю насыщенного раствора роданида калия (или аммония), в третью – сухого хлорида калия (или аммония). Сравните интенсивность окраски полученных растворов с эталонной окраской контрольной пробирки. На основании проведенного сравнения сделайте выводы о направлении смещения химического равновесия.
Обработка результатов эксперимента
Опыт 1
Рассчитайте молярную концентрацию тиосерной кислоты, образующейся при сливании растворов тиосульфата натрия с серной кислотой в колбах 1, 2, 3.
Рассчитайте относительную среднюю скорость реакции в колбах 1, 2, 3.
Постройте график 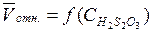 , используя экспериментальные данные. При построении графика следует помнить:
, используя экспериментальные данные. При построении графика следует помнить:
а) график отражает линейную зависимость: 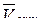 от
от 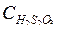 ;
;
б) его нельзя строить по двум экспериментальным точкам;
в) прямая должна проходить через начало координат.
Опыт 2
При взаимодействии растворов хлорида железа (III) и роданида калия происходит реакция, которую можно описать следующим сокращенным ионным уравнением:
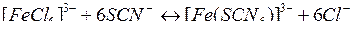
Характерная красная окраска принадлежит в растворе ионам 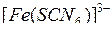 или продуктам их частичного распада. С учетом сказанного сделайте следующее:
или продуктам их частичного распада. С учетом сказанного сделайте следующее:
1. Отметьте, как изменяется интенсивность окраски растворов по сравнению с окраской раствора в контрольной пробирке.
2. Укажите, в каком направлении смещается равновесие при добавлении: а) хлорида железа (III); б) роданида калия, (или аммония); в) хлорида калия (или аммония).
3. Напишите выражение константы равновесия, основываясь на сокращенном ионном уравнении протекающей реакции.
Контрольные вопросы
1. Что подразумевается под понятием «скорость химической реакции»?
2. Закон действующих масс для гомогенных и гетерогенных систем.
3. Принцип Ле-Шателье.
4. Напишите выражения для константы равновесия гетерогенной и гомогенной реакции на любых примерах.
5. Перечислите факторы, влияющие на величину константы скорости реакции.
6. Как изменится скорость прямой и обратной реакции системе С(графит) + СО2(г) ↔ 2СО(г) при повышении давления в 2 раза?
7. Напишите математическое выражение правила Вант-Гоффа, отражающего зависимость скорости реакции от температуры.
8. Что такое катализатор, и какие виды катализа вы знаете?
9. Вычислите, как изменилась скорость реакции между уксусной кислотой и этиловым спиртом при постоянной температуре, если их исходные концентрации составляли 0,7 моль/л, а через некоторое время стали равными0,05 моль/л.
10. Укажите, как нужно изменить температуру, давление и концентрацию реагентов, чтобы увеличить выход хлора в системе: 4HCl(г) + O2(г) ↔2H2O(г) + Cl2(г), 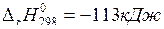 .
.
Дата: 2018-12-21, просмотров: 683.