Цель работы:
Освоить технику приготовления растворов заданной концентрации, научиться измерять плотности жидкостей с помощью ареометра. Выработать навыки работы с мерной посудой, научиться основам объемного анализа растворов (метод титрования).
Теоретическая часть
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в определенных пределах может непрерывно изменяться. Различают газообразные, твердые и жидкие растворы.
Газообразные растворы обычно представляют собой смеси газов и реже — растворы жидкостей или твердых веществ в газах. Газы способны смешиваться во всех отношениях при любых условиях.
Твердые растворы образуются при кристаллизации жидких расплавов или при растворении газов в твердых веществах. Различают твердые растворы замещения, внедрения и вычитания.
Твердые растворы замещения, которые образуются при сохранении структуры кристаллической решетки растворителя, являются наиболее распространенными. При образовании твердых растворов замещения в узлах кристаллической решетки данного вещества атомы, молекулы и ионы замещаются частицами другого вещества. Образование таких растворов возможно, если оба вещества близки по кристаллохимическим свойствам и размерам частиц. При образовании твердых растворов замещения оба вещества часто неограниченно растворяются друг в друге, при этом в системе образуется непрерывный ряд твердых растворов. Тип решетки и число частиц в кристаллической ячейке при этом остаются неизменными, но изменяются ее объем и плотность.
Твердые растворы внедрения получаются путем внедрения частиц одного вещества в междоузлия кристаллической решетки другого вещества (растворителя). Растворы внедрения образуются в том случае, когда размеры частиц внедряемого вещества меньше размеров частиц растворителя. Такие растворы обычно возникают при растворении неметаллов (водорода, азота, углерода, кислорода, бора, кремния) в металлах. При внедрении новых частиц в промежутки между атомами металла происходит увеличение напряжений в кристаллической решетке, в связи с чем область существования твердых растворов внедрения невелика. При образовании твердых растворов этого типа растворимость внедряющегося компонента ограничена, вследствие чего в системе образуется прерывный ряд твердых растворов. Число частиц в элементарной кристаллической ячейке и ее объем увеличиваются.
Твердые растворы вычитания встречаются значительно реже. Они получаются при выпадении некоторых атомов из кристаллической ячейки, в связи с чем эти растворы иногда называют твердыми растворами с дефектной решеткой.
Взаимная растворимость веществ, образующих твердые растворы, зависит от внешних условий и особенно от температуры. С понижением температуры взаимная растворимость веществ часто уменьшается, а это приводит к разделению исходного твердого раствора на два насыщенных твердых раствора — раствора первого вещества во втором и второго в первом. Такой процесс называется разрывом сплошности твердых растворов.
Различают твердые растворы с неограниченной и ограниченной растворимостью компонентов в твердом состоянии. Наиболее распространенными являются системы, в которых образуются твердые растворы с ограниченной растворимостью компонентов. Такого типа твердые растворы встречаются среди металлических, солевых и органических систем, например, Со—Mo, Bi—Sn, KNO3—NaNO3. Системы, в которых образуются твердые растворы с неограниченной растворимостью веществ в твердом состоянии, встречаются реже. К таким системам относятся системы Ag—Аu, AgCl—NaCl, CaSiO3—MnSiO3 и др.
На практике наиболее часто приходится встречаться с жидкими растворами. В жидком растворе обычно различают растворитель и растворенное вещество, хотя с термодинамической точки зрения все компоненты раствора равноценны. Под растворителем понимают вещество, которое имеется в растворе в большем количестве. Остальные компоненты, присутствующие в растворе в меньших количествах, называются растворенными веществами. Такое деление на растворитель и растворенное вещество крайне условно, особенно если количества компонентов в растворе соизмеримы.
Важной характеристикой раствора является его состав или концентрация компонентов. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Обычно растворитель обозначают индексом (1), а растворённое вещество индексом (i).
Для выражения концентраций раствора применяются различные способы:
1. Молярная (мольная) доля (х,), или молярное (мольное) содержание (хг,%), данного компонента, выраженное в процентах:
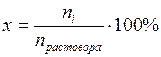
где ni – количество i-го компонента, моль.
2. Массовая доля (ω), или массовое содержание (ω,%), данного компонента, выраженное в процентах:
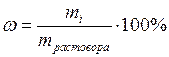
где mi – масса i-го компонента.
3. Объемная доля ( j ), или объемное содержание ( j ,%), данного компонента, выраженное в процентах:
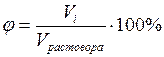
где Vi – объем i-го компонента.
4. Молярная концентрация или молярность (ci) — количество i-го компонента в молях в 1 л раствора:
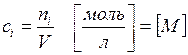
где V – объем раствора, л.
5. Концентрация эквивалента или нормальность (сЭ) – эквивалентное количество i-го компонента, растворенное в 1 дм3 раствора:
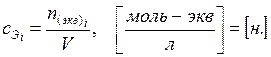 .
.
Молярность и нормальность связаны между собой соотношением:
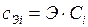 ,
,
где Э – значение эквивалента вещества.
6. Моляльностъ (m i) — количество i-го компонента в молях в 1000 г растворителя:
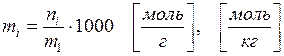
где m1 — масса растворителя, г, кг.
7. Состав раствора может быть выражен через разбавление (разведение) (r) — количество растворителя в молях, приходящееся на 1 моль растворенного вещества:
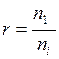
8. Титром раствора (Т) называют число граммов растворенного вещества в 1 см3 (мл) раствора.
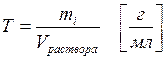
В физико-химических исследованиях концентрации компонентов раствора чаще выражают через молярные доли или через моляльность, между которыми существует соотношение
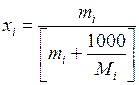 ,
,
где Мi — молекулярная масса растворителя
Определение концентрации раствора по его плотности. Между плотностью раствора ρ и концентрацией растворенного вещества существует непосредственная зависимость. Для наиболее часто применяемых кислот, растворимых оснований и солей данная зависимость установлена и приводится в справочниках в виде таблиц. Благодаря этому ориентировочное определение концентрации растворенного вещества в пределах точности ±0,5% может быть проведено путем экспериментального измерения плотности раствора и последующего нахождения концентрации вещества по табличным данным. Более точно концентрация растворенного вещества определяется методами аналитической химии.
Определение концентрации раствора титрованием. Среди многочисленных методов определения концентрации растворов самым простым и достаточно точным является метод титрования. Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. Титриметрические методы дают большой выигрыш во времени, поэтому их так широко используют в химических лабораториях. В титриметрическом анализе реакцию проводят между двумя растворами и как можно точнее определяют момент завершения реакции между обоими веществами. Зная концентрацию одного, можно установить и точную концентрацию другого. Титриметрический анализ заключается в точном измерении объемов реагирующих веществ. Например, при определении концентрации серной кислоты достаточно знать ее объем и объем и концентрацию щелочи. Реакция между кислотой и щелочью протекает мгновенно, окончание реакции фиксируется точно, поэтому измерения объемов и вычисления можно провести менее чем за 15 мин. Важным моментом в титриметрии является установление момента завершения реакции (точки эквивалентности). Точность титриметрических определений в значительной степени зависит от правильности установления точки эквивалентности, или, иначе говоря, от индикации точки эквивалентности. Все способы индикации точки эквивалентности можно разделить на три группы: 1) самоиндикация; 2) использование специальных индикаторов; 3) физико-химические способы.
К индикаторам относят большой круг органических и неорганических веществ, которые позволяют установить точку эквивалентности по изменению цвета, появлению или исчезновению мути, свечения. В большинстве случаев индикатор вводят в анализируемый раствор, тогда его называют внутренним. Если отбирают каплю раствора и смешивают ее с индикатором на белой фарфоровой пластинке или фильтровальной бумаге, то индикатор называют внешним. В настоящее время все более широкое применение находят физико-химические методы индикации, так как некоторые из них можно полностью автоматизировать. Их можно применять и тогда, когда нет полноты протекания реакции между титрантом и титруемым веществом.
В зависимости от приемов определения точки эквивалентности выделяют несколько методов титрования:
1. Прямое титрование, когда непосредственно (прямо) реагируют два раствора, концентрация одного из которых известна, а концентрация другого неизвестна. Например, раствор кислоты (НС l, H2SO4) с известной концентрацией приливают по каплям к раствору щелочи с неизвестной концентрацией. В большинстве случаев используют прямое титрование.
2. Обратное титрование (титрование по остатку). В некоторых случаях нельзя применить прием прямого титрования, например, если раствор А не реагирует с раствором В или же реагирует очень медленно, но существует третье вещество С, которое реагирует с А и В. В этом случае осуществляют реакцию между веществом А и веществом С, которое берут с заведомым избытком, и избыток вещества С заставляют прореагировать с веществом В. Если концентрации веществ В и С известны, то можно определить и концентрацию вещества А.
3. Метод замещения. Если вещества А и В не взаимодействуют между собой, можно найти вещество С, которое при взаимодействии с веществом А выделяет эквивалентное количество вещества D, которое взаимодействует с веществом В. По количеству выделенного вещества D можно определить количество вещества А.
Приборы и реактивы
1. Мерные цилиндры вместимостью 10—20, 100—200 мл.
2. Колбы мерные вместимостью 100—200 мл.
3. Колбы конические вместимостью 100—200 мл.
4. Пипетки вместимостью 15, 20, 25 мл.
5. Штатив с бюреткой вместимостью 50 мл.
6. Стеклянная воронка.
7. Набор ареометров.
8. Титрованный раствор гидроксида натрия.
9. Индикатор метиловый оранжевый или фенолфталеин.
10. Раствор серной кислоты (10—15%).
11. Фильтровальная бумага.
12. Резиновая груша.
13. Вода дистиллированная.
Порядок выполнения работы
Дата: 2018-12-21, просмотров: 799.