Провести два опыта, отличающихся порядком смешивания реагентов.
Опыт №1. Приготовить два сухих взвешенных стакана объемом 250 мл. В один из них налить 50 мл ≈1 М раствора NaOH и взвесить стакан с раствором на весах с точностью 0,1 г.
В другой стакан налить ≈0,5 М раствора H2SO4. Количество добавляемой кислоты должно содержать 25–30 %-й избыток по сравнению со стехиометрическим количеством. Второй стакан также взвесить.
Растворы щелочи и кислоты выдержать 10–15 мин при комнатной температуре, после чего измерить температуру каждого из них термометром.
Собрать калориметр, как показано на рисунке 3, учитывая, что внутренний стакан – это стакан с раствором щелочи. Включить магнитную мешалку, и через воронку быстро влить раствор кислоты в раствор щелочи и внимательно следить за температурой реакционной смеси. Отметить максимальный скачок температуры (Δt).
Опыт №2. Повторить эксперимент, изменив порядок смешивания реагентов. В два сухих взвешенных стакана поместить соответственно 50 мл 0,5 М раствора H2SO4 и рассчитанное с 25 %-м избытком по отношению к теоретическому количеству 1 М раствора NaOH. Взвесить каждый из них и далее все операции выполнить, как в первом опыте. В калориметре должен находиться стакан с раствором кислоты.
Оценить тепловой эффект реакции нейтрализации в предположении, что удельная теплоемкость водного раствора с массой m равна 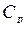 = 4,18 Дж/г. Тогда количество выделившейся теплоты
= 4,18 Дж/г. Тогда количество выделившейся теплоты
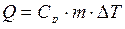 .
.
Измерить плотность ( 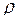 ) конечного раствора. Из данных теплового эффекта реакции нейтрализации вычислить энтальпию реакции
) конечного раствора. Из данных теплового эффекта реакции нейтрализации вычислить энтальпию реакции 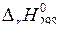 . Полученные результаты занести в таблицу:
. Полученные результаты занести в таблицу:
| № опыта | Раствор NaOH | Раствор H2SO4 | Δ t, ºС | Q, Дж | Плотность ( |
| ||
| m, г | C, г/моль | m, г | C, г/моль | |||||
| 1 | ||||||||
| 2 | ||||||||
Рассчитать среднее значение энтальпии реакции нейтрализации. Используя справочные данные, рассчитать теоретическую величину энтальпии реакции нейтрализации и сравнить с экспериментальным значением.
Контрольные вопросы
1. Сформулируйте первый закон термодинамики.
2. Понятие об энтальпии.
3. Какие виды энтальпии вы знаете?
4. Экзотермические и эндотермические процессы.
5. Что такое теплоемкость и как она определяется?
6. Какие виды теплоемкости вы знаете?
7. Закон Гесса.
8. Закон Кирхгоффа.
9. Отличаются ли энтальпии реакций нейтрализации сильной и слабой кислот? Если да, то почему?
10. Пользуясь данными о стандартных энтальпиях образования веществ в реакции 2Mg(K) + СО2(Г) = 2MgO(K) + С (графит), вычислите тепловой эффект реакции.
Скорость химической реакции и равновесие
Цель работы:
Убедиться в справедливости закона действующих масс и принципа Ле-Шателье. Приобрести навыки измерения объемов растворов и расчета их концентраций, познакомиться с элементами нефелометрического анализа, используемыми в работе.
Теоретическая часть
Скорость химической реакции измеряется изменением концентрации одного из реагирующих веществ в единицу времени. Концентрацию С выражают числом молей в 1 л, время – в секундах. Средняя скорость реакции 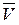 определяется как:
определяется как:
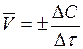 .
.
В самом общем виде при бесконечно малом временном интервале 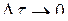 мгновенная истинная скорость V оказывается равной
мгновенная истинная скорость V оказывается равной
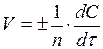 ,
,
где n – стехиометрический коэффициент в уравнении, описывающем данную реакцию.
Таким образом, скорость химической реакции есть первая производная от концентрации по времени.
Скорость реакции зависит от природы реагирующих веществ и от условий протекания реакции – концентрации реагентов, температуры, присутствия катализаторов и некоторых других причин, характерных для гетерогенных процессов (интенсивности перемешивания, степени измельчения и т.п.).
Зависимость скорости реакции от концентрации выражается законом действующих масс, являющимся основным законом химической кинетики: скорость химической реакции в гомогенных системах прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам. Так, при взаимодействии вещества А и В в соответствии с уравнением:
mA + nB = dD,
математическое выражение для скорости реакции имеет вид:
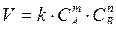 .
.
Убедиться в справедливости этого можно, проделав опыт 1 настоящей работы.
Многие химические реакции обратимы, т.е. протекают в противоположных направлениях, и не идут до конца. В таких реакциях устанавливается подвижное химическое равновесие, когда скорости прямого и обратного процессов становятся равными. Концентрации реагирующих веществ, которые устанавливаются в момент химического равновесия, называются равновесными. Обычно их обозначают при помощи квадратных скобок, т. е. [А] и [В] в отличие от неравновесных концентраций CA и С B в вышеприведенной формуле.
Используя закон действующих масс для химического равновесия, можно рассчитать константу равновесия, равную отношению произведения равновесных концентраций продуктов реакции к произведению, равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам. Так, для системы:
mA + nB ↔ dD
значение константы равновесия будет равным
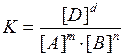
При заданной температуре К – величина постоянная, не зависящая от присутствия катализатора.
Меняя условия протекания реакции (температуру, концентрацию реагентов, давление), можно сместить химическое равновесие. Направление смещения равновесия в общем виде определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать извне какое-либо воздействие, то в системе возникает сдвиг равновесия в сторону процесса, ослабляющего оказанное воздействие. Убедиться в справедливости этого принципа позволяет опыт 2 данной лабораторной работы.
Приборы и реактивы
1. Три конические колбы на 100 мл.
2. Три мерных цилиндра на 10 и 50 мл.
3. Секундомер.
4. Рисунок в виде сетки.
5. Хлорид калия или аммония.
6. Растворы: тиосульфата натрия (0,25 М), серной кислоты (2 н.), хлорида железа (0,0025 н. и насыщенный), роданида калия или аммония (0,0025 н. и насыщенный).
Порядок выполнения работы
Дата: 2018-12-21, просмотров: 633.
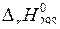 , кДж/моль
, кДж/моль