Цель работы:
Научится определять тепловой эффект реакции по экспериментальным данным.
Теоретическая часть
Суть первого закона термодинамики заключается в том, что тела могут обмениваться между собой энергией в виде тепла и работы, при этом энергия не исчезает и не возникает ниоткуда. Отсюда видно, что этот закон представляет собой одну из форм закона сохранения энергии.
Рассмотрим другой вариант: система совершает незамкнутый процесс, переходя из состояния I в состояние II. При этом она поглощает теплоту Q и совершает работу А. В общем случае состояния I и II могут отличаться значениями своих параметров, т. е. в самой системе могли произойти какие-то изменения, и в общем случае сумма количества теплоты, поглощенного системой, и работы, которую система при этом совершила, не равна нулю и приводит к изменению внутренней энергии:
Q = D U +A (1)
Основываясь на этой формуле можно дать следующую формулировку первого начала термодинамики:
Количество энергии, которое выделяется или поглощается в форме теплоты и работы, равно изменению внутренней энергии.
Различные химические реакции могут протекать как при постоянном объеме, так и при постоянном давлении. Определим, изменению каких функций состояния соответствуют при этом их тепловые эффекты.
Пусть система совершает работу только против сил внешнего давления, тогда изменение внутренней энергии будет равно:
D U=Q – p D V, (2)
где р — внешнее давление,
D V — изменение объема.
Произведение p D V=A – работа.
Если реакция протекает при постоянном объеме, то изменение объема равно нулю, следовательно, произведение p D V=Q. Таким образом, тепловой эффект химической реакции, протекающей при постоянном объеме, равен изменению внутренней энергии системы:
QV= D U. (3)
Рассмотрим, чему будет равен тепловой эффект реакции при постоянном давлении. В этом случае уравнение [3] примет вид:
U2 – U1, = Qp – p(V2 – V1).
Отсюда
Qp = (U2 – pV2} – (U1 – pV1).
Выше отмечалось, что параметры системы подпадают под определение функции состояния, так как их изменение зависит только от значений в начальном и конечном состояниях системы. Поэтому произведение давления на объем будет функцией состояния системы, а сумма этого произведения с внутренней энергией также будет представлять функцию состояния, которая называется энтальпией (H):
H=U+pV. (4)
Тепловой эффект реакции при постоянном давлении можно представить в виде изменения свойства системы, т. е.
Qp=H2-H1= D H, (5)
где H1 — энтальпия исходных веществ,
H2 — энтальпия продуктов реакции.
Иными словами, Qp, так же как и Qv, не зависит от пути протекания реакции.
Из уравнений [4] и [5], учитывая уравнение Менделеева-Клапейрона:
pV= n RT,
получим соотношение между тепловыми эффектами реакций между идеальными газами, протекающих при постоянных давлении и объеме:
Qp = Q V + n RT. (1)
Теплоемкость — количество теплоты, поглощаемое телом при нагревании на 1 градус (1°С или 1 К).
Теплоемкость единицы массы вещества называют удельной теплоемкостью [Дж/кг∙К]
Теплоемкость 1 моля вещества — молярная (мольная) теплоемкость [Дж/моль∙К].
Количество теплоты, поглощенное телом при изменении его состояния, зависит не только от начального и конечного состояний, но и от условий перехода между ними. Различают теплоемкость при постоянном объеме (СV) и теплоемкость при постоянном давлении (СP,). При постоянном давлении нагревание приводит к тому, что часть теплоты идет на совершение работы расширения тела, а часть — на увеличение его внутренней энергии, тогда как при нагревании при постоянном объеме вся теплота расходуется на увеличение внутренней энергии.
Для идеальных газов:
Cp = CV+R.
По знаку теплового эффекта реакции делятся на: эндотермические – реакции, протекающие с поглощением тепла, и экзотермические – реакции, в результате которых тепло выделяется.
Запись термохимических уравнений отличается от записи уравнений химических реакций. При написании термохимических уравнений реакций необходимо указать дополнительную информацию:
а) для всех участников процесса – и для реагентов (веществ, вступивших в реакцию), и для продуктов (веществ, образовавшихся в результате реакции), используя нижние индексы, указывают их агрегатные состояния:
«к» – кристаллическое;
«ж» – жидкое;
«г» – газообразное;
«р» – раствор.
б) в правой части уравнения указывают тепловой эффект реакции. Например:
2NaK + Н2ОЖ = 2NaOHp + Н2г + 368 кДж
В термохимических таблицах обычно приводятся тепловые эффекты реакций при постоянном давлении, которые обозначаются D r HT0, где нижний индекс Т соответствует температуре, к которой относится данное значение теплового эффекта (обычно для Т= 298 К). Верхний индекс «°» означает, что все участники реакции находятся в стандартных состояниях. Этот тепловой эффект реакции называют изменением энтальпии реакции или чаще просто энтальпией реакции.
Различают следующие виды энтальпии:
1. Стандартная теплота (энтальпия) образования соединения. Эта величина является одной из ключевых величин в термодинамике. Стандартной энтальпией образования химического соединения называют стандартное изменение энтальпии в результате реакции образования 1 моля этого вещества из простых веществ, взятых в том агрегатном состоянии, в котором они находятся при стандартных условиях. Стандартные энтальпии образования простых веществ принимаются равными нулю. Энтальпия образования измеряется в кДж/моль.
2. Стандартная энтальпия сгорания. Эта величина чаще всего определяется при термохимических измерениях в калориметрах (специальных приборах). Стандартной энтальпией сгорания называется энтальпия реакции сгорания вещества в кислороде с образованием оксидов элементов, имеющих высшую степень окисления, или простых веществ, если они более устойчивы в данных условиях, чем оксиды.
3. Стандартная энергия (энтальпия) химической связи. Это изменение энтальпии в реакции образования одного моля двухатомных молекул (или других двухатомных частиц) из атомов веществ, находящихся в газообразном состоянии. Образование химической связи — процесс экзотермический, и поэтому энтальпия его всегда имеет отрицательное значение.
4. Стандартная энтальпия сублимации, испарения и плавления. Она равна стандартному изменению энтальпии при переходе одного моля твердого (жидкого) вещества в газообразное состояние. Так как большинство металлов переходит в газ в атомарном состоянии, для металлов эту величину еще называют энтальпией атомизации.
В основе всех термохимических расчетов лежит закон Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний системы и не зависит от пути перехода (от промежуточных состояний).
Этот закон справедлив для реакций, протекающих либо: при постоянном объеме — в этом случае тепловой эффект реакции равен изменению внутренней энергии системы, либо при постоянном давлении — тогда тепловой эффект реакции равен изменению энтальпии, т. е. разности между алгебраическими суммами энтальпий образования продуктов и исходных веществ:
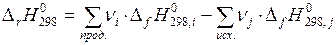
С помощью закона Гесса можно определить энтальпии образования веществ, которые невозможно измерить непосредственно.
На практике тепловые эффекты реакций определяются при различных температурах. При этом для любой химической реакции имеет место равенство:
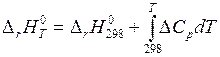
являющееся математическим выражением закона Кирхгофа.
Приборы и реактивы
1. Химические стаканы, 250 и 500 мл.
2. Воронка.
3. Штатив.
4. Магнитная мешалка.
5. Бюретка.
6. Термометр.
7. 1 М раствор NaOH и 0,5 М раствор H2SO4.
8. Вода дистиллированная.
Порядок выполнения работы
Приготовление растворов.
Приготовить в мерных колбах на 250 мл 1 М раствор NaOH и 0,5 М раствор H2SO4. Точные концентрации полученных растворов определить методом титрования их контрольными растворами (см. л.р. №5 «Приготовление растворов и определение их концентрации методом титрования»). Перед титрованием разбавить исходные растворы в 10 раз.
Лабораторная установка.
Работа выполняется в простейшем калориметре:

|
Рисунок 3. Калориметр: 1 – штатив, 2 – воронка, 3 – термометр, 4 – внешний стакан , 5 – внутренний стакан , 6 – якорь мешалки, 7 – магнитная мешалка.
Реакция нейтрализации является экзотермической реакцией. За счет выделяющейся теплоты нагреваются реакционная смесь и стенки стакана. Если скачок температуры измерить достаточно быстро, то можно пренебречь нагреванием стенок стакана. Для измерения температуры реагентов и реакционной смеси использовать термометр с ценой деления 0,1°С или внешний контактный термометр (сенсор).
Дата: 2018-12-21, просмотров: 689.