Цель работы:
Определение молярной массы углекислого газа.
Теоретическая часть
Равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул (закон Авогадро). Отсюда следует, что массы равных объемов двух газов относятся друг к другу, как их молекулярные или численно им равные молярные массы:
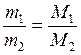
где m1 и m2 – массы газов;
M1 и M2 – молярные массы этих газов.
Отношение массы данного газа к массе того же объема другого газа, взятого при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Например, масса одного литра диоксида углерода равна 1,98 г, а масса одного литра водорода при тех же условиях составляет 0,09 г, следовательно, плотность CO2 по водороду равна:
1,98 : 0,09 = 22
Обозначим относительную плотность газа буквой D. Тогда:
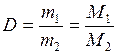 ,
,
откуда
М1 = D·М2,
то есть молярная масса газа равна его плотности по отношению ко второму газу, умноженному на молярную массу второго газа.
Чаще всего плотность газов определяют по отношению к самому лёгкому газу – водороду. Молярная масса водорода равна 2 г/моль, поэтому уравнение для расчета молярных масс газов имеет вид
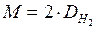
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, известна его средняя молярная масса, равная 29 г/моль. В этом случае уравнение для расчета молярных масс газов имеет вид
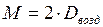
Молярную массу газа можно определить также через молярный объем, равный 22,4 л/моль. Для этого находят объем, занимаемый при нормальных условиях определенной массой газообразного вещества, а затем вычисляют массу 22,4 л этого вещества. Полученная величина является его молярной массой.
Измерения объемов газов обычно проводят при условиях, отличающихся от нормальных. Для приведения объема газа к нормальным условиям (н.у.) используется объединенный газовый закон:
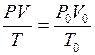
где V – объем газа при давлении P и температуре T;
V0 – объем газа при нормальном давлении P0 (101325 Па) и температуре T0 (273 К).
Молярную массу газа можно также вычислить по уравнению состояния идеального газа (уравнению Менделеева-Клапейрона)
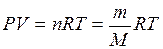
где P – давление газа (Па);
V – его объем (м3);
m – масса (г);
n – количество вещества, моль;
M – молярная масса (г/моль);
T – температура (К);
R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Приборы и реактивы
1. Аппарат Кипа.
2. Склянка Дрекселя.
3. Колба объемом 1 л.
4. Весы технические.
5. Мраморная крошка.
6. Соляная кислота, 0,1 М раствор.
7. Серная кислота, 1М раствор.
8. Вода дистиллированная.
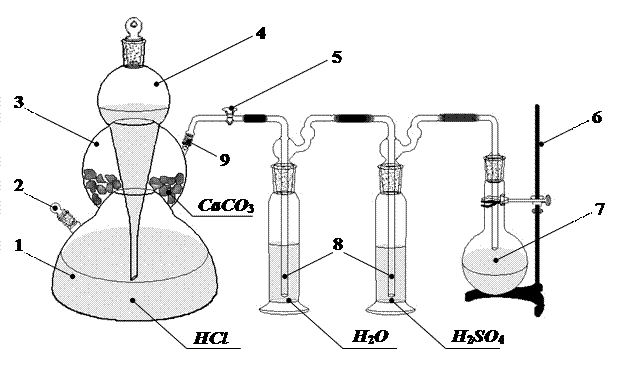
|
Рисунок 1. Схема лабораторной установки для получения углекислого газа в аппарате Киппа. 1, 3 – соединённые между собой резервуары, 2, 9 – тубусы, 4 – шарообразная воронка, 5 – кран, 6 – штатив, 7 – колба-приёмник,. 8 – склянка Дрекселя,
Порядок выполнения работы
1. Ознакомиться с установкой для получения углекислого газа в аппарате Кипа и убедиться в том, что она работает.
2. Колбу-приемник закрыть пробкой и отметить чертой уровень, до которого пробка вошла в горло колбы. Взвесить на технохимических весах колбу с пробкой с точностью до 0,01 г (m1).
3. Наполнить колбу диоксидом углерода из аппарата Киппа.
4. Через 5 мин, не закрывая кран у аппарата Киппа, медленно вынуть газоотводную трубку из колбы и тотчас закрыть колбу пробкой; после этого закрыть кран 5.
5. Взвесить колбу с диоксидом углерода на тех же весах и с той же точностью, что и колбу с воздухом (m2).
6. Измерить рабочий объем колбы V1, для чего наполнить колбу дистиллированной водой до черты на шейке колбы и замерить объем воды, вылив её в мерный цилиндр.
7. Записать значения атмосферного давления и температуры, при которых проводится опыт, а также уравнение получения углекислого газа при взаимодействии мрамора с соляной кислотой.
8. Вычислить объем газа V0 при н.у. по уравнению объединенного газового закона.
9. Вычислить массу воздуха (m3) в объеме колбы, учитывая, что при 0 °C и 101,3 кПа масса одного литра воздуха равна 1,293 г.
10. Найти массу пустой (без воздуха) колбы с пробкой: m4 = m1 – m3
11. Найти массу диоксида углерода в объеме колбы m5 = m2 – m4
12. Определить относительную плотность CО2 по воздуху:
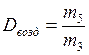
13. Вычислить молярную массу CO2 тремя способами:
а) по воздуху:
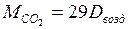 ,
,
б) по закону Авогадро:
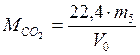 ,
,
в) по уравнению Менделеева–Клапейрона:
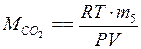 .
.
14. Вычислить среднее значение молярной массы углекислого газа с точностью до одного знака после запятой.
15. Определить погрешность опыта, сравнивая среднее опытное значение с теоретической величиной (44,0 г/моль), и оформить отчёт.
Контрольные вопросы
1. Закон Авогадро.
2. Следствия из закона Авогадро.
3. Нормальные и стандартные условия.
4. Объединенный газовый закон и уравнение Менделеева-Клайперона.
5. Во сколько раз углекислый газ тяжелее воздуха?
6. В аппарате Киппа для получения СО2 из мрамора используется соляная кислота. Почему нельзя использовать более дешевую серную кислоту?
7. При постоянном давлении и температуре масса одного литра водорода равна 0,082 г, а одного литра воды – 1 кг. Возможно ли определение плотности воды по водороду? Если невозможно, то почему?
8. Масса одного литра газа равна 2,86 г. Определите его молярную массу.
9. Плотность газа 1,96 г/л. Определите его молярную массу.
10. Установите формулу газообразного вещества, содержащего углерод (81,82 %) и водород (остальное), масса одного литра которого при нормальных условиях равна 2,6 г.
Дата: 2018-12-21, просмотров: 1054.