Цель работы
Установление эквивалентной и атомной массы неизвестного металла.
Теоретическая часть
Раздел химии, посвященный изучению количественных соотношений между реагирующими веществами, называется стехиометрией. Стехиометрические расчеты базируются на нескольких фундаментальных законах.
Закон сохранения массы веществ (М.В. Ломоносов, 1748 – 1756 г.г., А. Лавуазье, 1777 г.): «Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции».
Закон постоянства состава (Ж.Л. Пруст, 1801г.): «Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав».
Из закона постоянства состава следует, что элементы взаимодействуют между собой в строго определенных количественных соотношениях. Поэтому можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-всстановительных реакциях.
В общем случае эквивалент любого вещества X может быть записан как (1/Z)X, где Z – число эквивалентности, равное тому количеству ионов водорода в кислотно-основных реакциях, или электронов в окислительно-восстановительных реакциях, которое эквивалентно частице X. Для кислот, оснований, солей число эквивалентности Z равно соответственно основности, кислотности или количеству элементарных зарядов катионов или анионов, а для элемента – степени окисления, проявляемой им в данном соединении.
Масса 1 моля вещества эквивалента (1/Z)X называется молярной массой эквивалента М[(1/Z)X] и представляет собой отношение массы m вещества X к количеству вещества эквивалента n[(1/Z)X]:
М[(1/Z)X] = 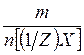 (г/моль)
(г/моль)
Молярная масса вещества X и молярная масса эквивалента (1/Z)X связаны следующим соотношением:
М[(1/Z)X] = 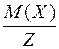
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Так для реакции:
| a А + | b В + | c С + | dD |
| m(A) | : m(B) | : m(C) | : m(D) |
М 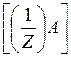
| :М 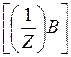
| :М 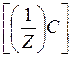
| :М 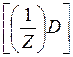
|
Иначе говоря, массы взаимодействующих без остатка веществ относятся друг к другу, как их эквивалентные массы:
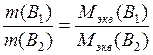
Эквивалентные массы элементов и соединений используются при выражении концентрации растворов (молярная концентрация эквивалентов), при оценке жесткости воды, в расчетах по электролизу и т. д.
Через эквивалентную массу элемента может быть определена его атомная масса, так как они связаны между собой соотношением:
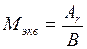 или
или 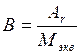 ,
,
где В – валентность элемента.
При этом эквивалентная масса определяется экспериментально, а атомная масса рассчитывается приблизительно по закону Дюлонга-Пти, который гласит: атомная теплоемкость (т.е. произведение удельной теплоемкости С и атомной массы Аr) простых веществ в твёрдом состоянии примерно одинакова и составляет в среднем около 26 Дж/(моль ⋅ К), то есть C·Аr ≈ 26.
Разделив приблизительную атомную массу на эквивалентную массу, получают валентность элемента, которую округляют до ближайшего целого числа. После этого умножением эквивалентной массы на валентность получают более точное значение атомной массы.
Пример 1. Один атом хлора соединяется с одним атомом водорода, образуя хлороводород (НСl). Следовательно, эквивалент хлора в этом соединении равен 1.
Пример 2. Кислород с водородом образует два соединения: Н2О2 (пероксид водорода) и Н2О (вода). В первом соединении эквивалентом кислорода является его атом и эквивалентная масса равна шестнадцати, а во втором – эквивалентом кислорода является 1/2 атома и эквивалентная масса равна восьми.
Пример 3. Серная кислота содержит два атома водорода. В реакции замещения одного из них эквивалентом кислоты является её молекула с эквивалентной массой 98, а в реакции замещения двух атомов водорода – половинка молекулы (условная частица) с эквивалентной массой 49.
Пример 4. При взаимодействии 59,5 мг металла с серной кислотой выделилось 21,9 мл водорода (объем измерен при температуре 17°С и давлении750 мм рт. ст.). Удельная теплоемкость металла 0,39 Дж/(г·К). Вычислить атомную массу металла и определить, какой это металл.
Решение.
1) Переводим экспериментальные данные в систему СИ:
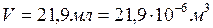 ,
,
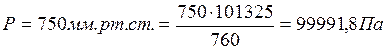 .
.
2) По уравнению Менделеева-Клапейрона вычисляем массу водорода:
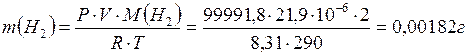 .
.
3) По закону эквивалентов определяем эквивалентную массу металла:
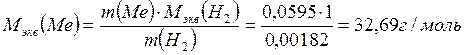 .
.
4) По закону Дюлонга-Пти находим приблизительную атомную массу металла:
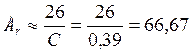 .
.
5) Определяем приблизительное значение валентности
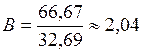
и округляем его до целого числа 2.
6) Рассчитываем точную атомную массу:
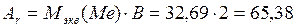
По периодической системе определяем металл – это цинк.
Приборы и реактивы
1. Эвдиометр,
2. Весы аналитические,
3. Барометр,
4. Термометр,
5. Анализируемый металл,
6. Серная кислота,
7. Вода дистиллированная.
Порядок выполнения работы
Эквивалентная масса металла определяется по водороду, который выделяется при взаимодействии металла с серной кислотой. Теплоемкость металла сообщает преподаватель. Взвешивание металла производится с точностью 0,001 г на аналитических весах.
Опыт проводится на приборе, называемом эвдиометром, изображенном на рисунке 2.
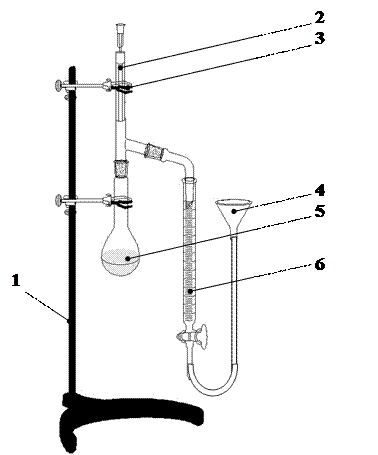
|
Рисунок 2. Схема установки для определения эквивалентной массы металла: 1 – штатив, 2 – пробирка, 3 – зажим, 4 – уравнительная воронка, 5 – колба Вюрца, 6 – мерная бюретка.
Установка собрана на химическом штативе (1). Она состоит из стеклянного реакционного сосуда (4), в котором находится кислота, мерной бюретки (5) для сбора выделяющего водорода и уравнительной воронки (6). Реакционным сосудом (4) является колба Вюрца объемом 50 мл с присоединенной пробиркой (2). Они соединены поливинилхлоридной трубкой, которую можно пережимать съемным зажимом (3).
Ход измерения.
1. Получив от преподавателя кусочек металла массой 0,02–0,03 г, взвесить его на аналитических весах и узнать у преподавателя его теплоёмкость. Массу и теплоемкость записать в таблицу 1.
2. Снять пробирку (2), поднять и закрепить уравнительную воронку (6) на штативе в таком положении, при котором уровень столбика воды в мерной бюретке (5) находится вблизи крайнего верхнего деления. При необходимости долить в воронку воду. После этого перекрыть полихлорвиниловую трубку зажимом (3), положить в пробирку (2) металл и вставить пробирку в полихлорвиниловую трубку.
3. Проверить прибор на герметичность. Для этого опустить уравнительную воронку (6) вниз примерно до 1/3–1/2 высоты штатива, наблюдая за уровнем воды в мерной бюретке (5). Если уровень воды не изменяется, то прибор герметичен, и на нем можно продолжить работу. Если уровень воды все время понижается, то прибор не герметичен. В этом случае устранить неисправность или попросить заменить установку.
4. Возвратить воронку (6) в исходное (верхнее) положение и записать уровень воды в мерной бюретке (5). Открыв зажим, сбросить металл в кислоту. Наблюдать протекание реакции и выделение водорода по понижению уровня воды в мерной бюретке (5). Передвигать уравнительную воронку (6) вниз синхронно с понижением уровня воды в бюретке (5).
5. После окончания реакции выдержать около 10 мин для охлаждения водорода до температуры в лаборатории (реакция идет с выделением тепла). После этого уровень воды в бюретке (5) и воронке (6) установить одинаковым и записать его в таблицу экспериментальных данных:
| № п/п | Название величины | Обозначение | Единица измерения | Значение |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Масса металла | m(Ме) | г | |
| 2 | Удельная теплоемкость металла | С | Дж/(г ⋅ К) | |
| 3 | Начальный уровень воды в бюретке | V1 | мл | |
| 4 | Уровень воды после реакции | V2 | мл | |
| 5 | Объем водорода | V(H2) | мл |
| 1 | 2 | 3 | 4 | 5 |
| 6 | Температура в лаборатории | t | оC | |
| 7 | Температура по абсолютной шкале | T | K | |
| 8 | Давление по барометру | P | мм рт. ст. | |
| 9 | Давление водяного пара | P(H2O) | мм рт. ст. | |
| 10 | Давление водорода | P(H2) | мм рт. ст. | |
| 11 | Давление водорода | P(H2) | Па |
6. Записать значения температуры и давления в таблицу, вычислить и записать остальные показатели опыта.
7. По примеру, приведенному в теоретической части, вычислить эквивалентную массу металла, его валентность и атомную массу.
При вычислении массы водорода иметь в виду, что в реакции выделяется влажный водород и поэтому его давление равно общему давлению по барометру за вычетом давления водяного пара:
Р(Н2) = Р – Р(Н2О)
Давление водяного пара при различных температурах T0C
| T0C | P(H2О), кПа | P(H2О), мм рт. ст. | T, 0C | P(H2О), кПа | P(H2О), мм рт. ст. |
| 10 | 1,226 | 9,2 | 18 | 2,066 | 15,5 |
| 11 | 1,306 | 9,8 | 19 | 2,199 | 16,5 |
| 12 | 1,399 | 10,5 | 20 | 2,333 | 17,5 |
| 13 | 1,493 | 11,2 | 21 | 2,479 | 18,0 |
| 14 | 1,599 | 12,0 | 22 | 2,639 | 19,8 |
| 15 | 1,706 | 12,8 | 23 | 2,813 | 21,1 |
| 16 | 1,813 | 13,6 | 24 | 2,986 | 22,4 |
| 17 | 1,933 | 14,5 | 25 | 3,013 | 23,5 |
9. По полученной в опыте атомной массе найти данный металл в периодической системе и записать его теоретическое (табличное) значение атомной массы.
10. Вычислить ошибку в определении атомной массы металла по формуле
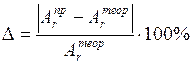 .
.
11. Оформить отчет, сформулировать вывод.
Контрольные вопросы
1. Приведите определение понятий эквивалент и эквивалентная масса химического элемента и соединения.
2. Закон эквивалентов.
3. Как рассчитать значения эквивалентов кислоты, основания, соли?
4. Как определяется эквивалентный объем веществ?
5. Чему равны эквивалентные объемы водорода и кислорода при нормальных условиях?
6. Эквивалентная масса какого элемента равна 1?
7. Вычислите молярную массу эквивалента элемента, оксид которого содержит 22,2 % кислорода.
8. Чему равна молярная масса эквивалента ортофосфорной кислоты, если 1 моль Н3РО4 провзаимодействовал с 1 моль гидроксида калия?
9. Молярная масса эквивалента металла равна 56,2 г/моль. Вычислите массовую долю металла в его оксиде.
10. Какой объем кислорода (н.у.) потребуется для реакции с 15 г элемента, имеющего молярную массу эквивалента 3 г/моль?
Дата: 2018-12-21, просмотров: 1789.