1. Измерив плотность исходного раствора кислоты ареометром, определите процентную концентрацию этого раствора по табличным данным:
Плотность водных растворов H 2 SO 4 различной концентрации при 20ºС
| С, % | ρ, г/см3 | С, % | ρ, г/см3 | С, % | ρ, г/см3 |
| 2 | 1,013 | 34 | 1,255 | 66 | 1,571 |
| 4 | 1,027 | 36 | 1,273 | 68 | 1,594 |
| 6 | 1,040 | 38 | 1,290 | 70 | 1,617 |
| 8 | 1,055 | 40 | 1,307 | 72 | 1,640 |
| 10 | 1,069 | 42 | 1,324 | 74 | 1,664 |
| 12 | 1,083 | 44 | 1,342 | 76 | 1,687 |
| 14 | 1,098 | 46 | 1,361 | 78 | 1,710 |
| 16 | 1,112 | 48 | 1,380 | 80 | 1,732 |
| 18 | 1,127 | 50 | 1,399 | 82 | 1,755 |
| 20 | 1,143 | 52 | 1,419 | 84 | 1,776 |
| 22 | 1,158 | 54 | 1,439 | 86 | 1,808 |
| 24 | 1,174 | 56 | 1,460 | 90 | 1,819 |
| 26 | 1,190 | 58 | 1,482 | 92 | 1,830 |
| 28 | 1,205 | 60 | 1,503 | 94 | 1,837 |
| 30 | 1,224 | 62 | 1,525 | 98 | 1,841 |
| 32 | 1,238 | 64 | 1,547 | 100 | 1,838 |
2. Рассчитайте объем ( 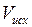 ) исходного раствора кислоты, необходимый для приготовления (V, мл) раствора кислоты с нормальностью С (V и С задаются преподавателем).
) исходного раствора кислоты, необходимый для приготовления (V, мл) раствора кислоты с нормальностью С (V и С задаются преподавателем).
3. По данным двух титрований, не отличающихся между собой больше, чем на 0,1 – 0,2 мл, возьмите среднее значение израсходованного объема раствора кислоты Vк. Рассчитайте нормальность раствора кислоты C экв кислоты по формуле

где  – нормальность раствора щелочи, моль/л,
– нормальность раствора щелочи, моль/л,
 ,
, 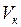 – соответственно объем раствора щелочи и кислоты, мл.
– соответственно объем раствора щелочи и кислоты, мл.
Сопоставьте ориентировочно значение, концентрации С раствора кислоты с ее точным значением Nк и подсчитайте относительную ошибку, допущенную при приготовлении раствора с концентрацией С.
Результаты экспериментов и расчетов представьте по следующей форме:
| ρисх, г/мл | Cисх, % | V, мл | C, моль/л | Vисх, мл |  ,
мл ,
мл
| C экв. щ, моль/л |  мл
мл
| C экв. к. моль/л |
Контрольные вопросы
1. Какие виды растворов вы знаете?
2. Какие способы выражения состава растворов вы знаете?
3. В 450 мл воды растворили 50 г сульфата алюминия. Рассчитайте: процентную концентрацию раствора, молярность, моляльность и титр, если плотность раствора 1,1 г/мл.
4. В 2 л воды растворили 292 л аммиака при н.у. Рассчитайте процентную концентрацию раствора.
5. Какой объем 20%-ного раствора ортофосфорной кислоты (плотность раствора 1,1 г/мл) необходим для приготовления 800 мл 0,8 н. раствора этой кислоты?
6. Какова молярность раствора трехосновной кислоты, если на титрование 50 мл этого раствора израсходовано120 мл 0,02 н. раствора щелочи?
7. На растворение 4,5 г алюминия израсходовано 250 мл раствора двухосновной кислоты. Какова молярность раствора кислоты?
8. Смешали 200 мл 20%-ного раствора H2SO4 (ρ = 1,14 г/мл) с 600 мл её 0,8 н. раствора. Какова молярность полученного раствора?
9. В чем заключается метод титрования?
10. Какие методы титрования вы знаете?
Определение рН-раствора
Цель работы:
Овладеть методикой определения водородного показателя рН раствора с применением набора индикаторов и с помощью иономера (рН-метра).
Теоретическая часть
Автопротолиз воды
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая и объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
Н2O Û Н+ + ОН–
При этом в чистой воде при 25°С [Н+] = [ОН–] = 10–7моль/л. Тогда константа диссоциации будет:
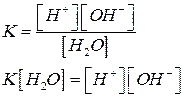
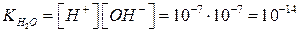
Поскольку 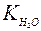 постоянная величина, то при добавлении к воде гидроксид ионов, концентрация ионов водорода снизится, и, наоборот, при добавлении кислоты концентрация ионов водорода возрастет. Поэтому, зная концентрацию ионов водорода, можно охарактеризовать кислотность среды:
постоянная величина, то при добавлении к воде гидроксид ионов, концентрация ионов водорода снизится, и, наоборот, при добавлении кислоты концентрация ионов водорода возрастет. Поэтому, зная концентрацию ионов водорода, можно охарактеризовать кислотность среды:
Нейтральный раствор, [Н+] = 10–7 моль/л
Кислыйраствор, [Н+] > 10–7 моль/л
Щелочнойраствор, [Н+] < 10–7 моль/л.
Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через рH:
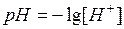 .
.
Тогда:
Нейтральный раствор, рH = 7
Кислыйраствор, рH < 7
Щелочнойраствор, рH > 7.
Таким образом, кислотность среды в растворе электролита можно определить с учетом степени диссоциации растворенного вещества, пользуясь соотношениями:
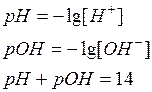 ,
,
где α – степень диссоциации электролита.
Так как величина рН является важной характеристикой любого водного раствора, включая производственные растворы.
Дата: 2018-12-21, просмотров: 905.