Кафедра физики и химии
Чичварин А.В., Крахт Л.Н.
Полева Е.А., Здарова Е.Р.
ОБЩАЯ ХИМИЯ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Одобрено научно-методическим советом
СТИ НИТУ «МИСиС»
для студентов, обучающихся по направлению:
13.03.01 – «Теплоэнергетика и теплотехника»
22.03.02– «Металлургия»
Старый Оскол
2018
 |
УДК 541.1
ББК 24.5
Рецензенты:
Игуменова Т.И., к.т.н., доцент кафедры ХХТОС и ПП Воронежского государственного университета инженерных технологий.
Кравцова О.С., к.т.н., доцент кафедры физики и химии СТИ НИТУ МИСиС.
Чичварин А.В., Крахт Л.Н., Полева Е.А., Здарова Е.Р.: Общая химия. Лабораторный практикум. Старый Оскол 2018. –84 с.
Лабораторный практикум содержит необходимую информацию для успешного усвоения учебного курса по общей химии.
В пособии подробно рассмотрены теоретические и практические основы проведения лабораторных работ, при выполнении которых студенты осваивают технику обращения с химическими реактивами и приспособлениями, приемы проведения химических операций, методы обработки опытных данных, учатся сопоставлять и анализировать результаты опытов и делать выводы.
Практикум составлен в соответствии с требованиями к обязательному минимуму содержания дисциплины «Общая химия», входящей в основную образовательную программу подготовки специалистов по специальностям государственных образовательных стандартов высшего профессионального образования.
© Чичварин А.В., Крахт Л.Н. Полева Е.А., Здарова Е.Р.
© СТИ НИТУ «МИСиС»
Содержание
Предисловие. 4
1. Основные классы неорганических веществ. 5
2. Установление формулы кристаллогидрата. 15
3. Определение молярной массы углекислого газа. 18
4. Определение эквивалентной и атомной массы металла. 23
5. Приготовление растворов и определение их концентрации. 30
6. Определение рН-раствора. 38
7. Гидролиз солей........................................................................................... 46
8. Тепловой эффект реакции нейтрализации. 51
9. Скорость химической реакции и равновесие. 58
10. Окислительно-восстановительные реакции. 63
Рекомендуемая литература. 75
Общие требования к составлению отчета по лабораторным работам.. 76
Приложения. 77
Приложение 1. Стандартные окислительно-восстановительные потенциалы.. 77
Приложение 2. Растворимость солей и оснований в воде. 81
Предисловие
Лабораторный практикум по общей химии имеет целью ознакомить студентов первого курса с основными методами проведения лабораторных работ.
Перед началом работы в лаборатории общей и неорганической химии студенты должны обязательно изучить «Инструкцию по технике безопасности» и взять на себя обязательства неукоснительно ей следовать, о чем делается запись в «Журнале по технике безопасности».
Лабораторные работы являются одной их важнейших составных частей курса химии. Для их выполнения студенты должны ознакомиться с лабораторным оборудованием, измерительными приборами, правилами техники безопасности. Лабораторные занятия при изучении химии в вузе преследуют две основные цели: 1) подтверждение экспериментом теоретических положений и законов; 2) обучение навыкам проведения лабораторных работ, при выполнении которых студенты осваивают технику обращения с химическими реактивами и приспособлениями, приемы проведения химических операций, методы обработки опытных данных, учатся сопоставлять и анализировать результаты опытов и делать выводы.
Классический лабораторный практикум по химии носит в основном иллюстративный характер: в лабораторных опытах студенты находят подтверждение тех закономерностей, которые изучают на лекциях и на практических занятиях. Для облегчения усвоения материала в каждой работе приводится достаточно подробное теоретическое описание изучаемого вопроса, в конце – перечень контрольных вопросов, которые, как правило, задает преподаватель при приеме отчета по данной лабораторной работе. Таблицы, необходимые практически для каждой лабораторной работы даются в приложении.
Все работы выполняют индивидуально, каждый оформляет отчет по своим результатам. При оформлении отчета записывают дату, номер, название работы и опыта, краткий конспект теоретического материала, краткое описание хода работы, наблюдение и результаты, полученные при его выполнении.
Цель работы:
Получение и исследование свойств наиболее распространенных простых веществ и соединений.
Теоретическая часть
Вещества подразделяются на простые и сложные. Простые вещества состоят из атомов одного химического элемента, а сложные – из атомов различных элементов. Сложные вещества называются химическими соединениями.
Простые вещества подразделяются на металлы и неметаллы. К неметаллам относятся вещества, образованные атомами двадцати двух химических элементов: водорода, благородных газов, галогенов, кислорода, серы, селена, теллура, азота, фосфора, мышьяка, углерода, кремния, бора. Все остальные химические элементы и их простые вещества – металлы.
Металлы в химических реакциях только отдают электроны, то есть являются восстановителями, поэтому в соединениях их атомы находятся только в положительных степенях окисления. Неметаллы в реакциях могут принимать и отдавать электроны, т.е. вести себя и как окислители, и как восстановители, поэтому степени окисления неметаллов в соединениях могут быть как отрицательными, так и положительными.
Сложные вещества (химические соединения) очень многочисленны и разнообразны по составу и свойствам. Изучение веществ облегчает их классификация, так как, зная особенности класса соединений, можно охарактеризовать свойства их отдельных представителей.
Основными классами неорганических соединений являются оксиды, гидроксиды и соли.
Оксидами называют соединения химических элементов с кислородом. По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие или безразличные (СО, NO, N2O). Солеобразующие оксиды, в свою очередь, подразделяются на основные (Na2O, CaO, FeO и др.), кислотные (SO2, SO3, SiO2, CO2 и т.д.) и амфотерные (ZnO, Al2O3 Сr2O3, SnO и др.). Также выделяют двойные и смешанные оксиды, пероксиды, надпероксиды, озониды.
Гидроксидами являются соединения солеобразующих оксидов с водой. По типу и продуктам электролитической диссоциации в водных растворах и по химическим свойствам гидроксиды подразделяются на основания (NaOH, КOH, Mg(OH)2, Ba(OH)2, Fe(OH)3 и др.), кислоты (H2SO3, H2SO4, HNO3, H3РO4, HСlO4 и др.) и амфотерные гидроксиды, или амфолиты (Be(OH)2, Zn(OH)2, Sn(OH)2, Sn(OH)4, Al(OH)3, Cr(OH)3, Mn(OH)4 и др.).
Cоли представляют собой продукты замещения атомов водорода в кислоте на металл или гидроксид-ионов в основаниях на кислотный остаток. Согласно теории электролитической диссоциации, солями называются вещества, при диссоциации которых образуются катионы металлов (а также NH4+ – катион аммония) и анионы кислотных остатков. Соли подразделяются на нормальные, или средние (Na2SO4, K2S, Na2SiO3 и др.), кислые, или гидросоли (NaHCO3, KHSO4, NaHS и др.), основные, или гидроксосоли (ZnOHCl, (CuOH)2CO3, AlOH(NO3)2 и т.д.), двойные (KNaCO3, KAl(SO4)2 и др.), смешанные (СаСlOCl, или СаOСl2, Sr(HS)Cl и др.) и оксосоли (SbOCl, BiONO3, TiOCl2 и др.).
Существуют соединения, которые не относятся к основным классам веществ: гидриды, карбиды, нитриды, сульфокислоты и сульфосоли, комплексные соединения и др.
Приборы и реактивы
1. Пробирки, стеклянная палочка.
2. Спиртовая горелка, щипцы, фарфоровая чашка.
3. Универсальная индикаторная бумага.
4. Цинк, магний, натрий, железо, медь.
5. Кислоты соляная и серная, 0,1М раствор и конц., азотная, 1 М раствор.
6. Гидроксид натрия, 30%-й раствор и 0,1 М р-р.
7. Хлорат калия (бертолетова соль).
8. Оксид марганца (IV).
9. Перманганат калия.
10. Хлорная вода.
11. Растворы: сульфата меди (II), сульфата кадмия, нитрата свинца (II), хлорида или сульфата никеля (II), хлорида железа (III), хлорида или сульфата цинка, хлорида бария, карбоната натрия, силиката натрия, йодида калия, хлорида калия.
12. Бихромат аммония.
13. Индикаторы: фенолфталеин, метилоранж, метиловый красный, малахитовый зеленый, метиловый фиолетовый, тимоловый синий, ализарин, тимолфталеин.
14. Хлорид натрия.
15. Оксиды цинка, меди и хрома.
16. Нитрат калия, хлорид железа (III) конц.
17. Раствор метилового красного.
18. Вода дистиллированная.
Порядок выполнения работы
Опыт 4. Получение металлов
Каждый металл вытесняет из растворов солей все другие металлы, расположенные в электрохимическом ряду активности металлов (ряд напряжений металлов) правее его. Это свойство используется для получения многих металлов.
Приготовьте три пробирки.
В первую пробирку внесите 20 капель раствора сульфата меди (II),
во вторую – столько же раствора сульфата кадмия,
в третью – нитрата свинца (II).
В каждую пробирку опустите по одной грануле цинка. Наблюдайте протекание реакций с выделением меди, кадмия и свинца на поверхности цинка.
Цель работы:
Определение количества (моль) воды в кристаллогидрате – медном купоросе.
Теоретическая часть
В начале XIX в. Пруст в споре с Бертолле высказал утверждение, что вещество, независимо от способов получения, обладает одним и тем же составом. Это утверждение стало основным законом — законом постоянства состава. На основании данных о составе вещества строилась его химическая формула с постоянным количественным соотношением элементов. Поэтому соединения постоянного состава были названы стехиометрическими соединениями. Закон постоянства состава и стехиометричность соединений долгое время считались незыблемыми. Однако в начале XX в. Н.С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т.е. характеризующихся переменным составом. Соединения постоянного состава Н.С. Курнаков назвал дальтонидами в честь Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь Бертолле бертоллидами. Соединениями постоянного состава являются вещества молекулярного строения, поскольку состав молекул однозначно определяется строением их образующих атомов. Если же кристаллическое вещество имеет атомное или ионное строение, то оно характеризуется более или менее переменным составом. Наиболее отчетливо переменный состав проявляется у соединений d-элементов — оксидов, сульфидов, нитридов, карбидов, гидридов. Среди неорганических веществ почти 95% не имеют молекулярного строения и, следовательно, являются нестехиометрическими соединениями, однако для удобства состав мы выражаем через химическую формулу, условно принимая, что все вещества строго стехиометричны.
Формула химического соединения показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы или формульной единицы. Массовые соотношения элементов в молекулах можно представить как отношение произведений соответствующих атомных масс на число атомов каждого элемента в молекуле, т.е. можно записать:
m1 : m2 : m3 = xA1 : yA2 : zA3,
где m1, m2, m3 – содержание элементов в соединении (%);
x, y, z – число атомов этих элементов в молекуле или в формульной единице;
А1, А2, А3 – атомные массы элементов.
Из этого уравнения следует:
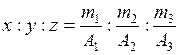 ,
,
что позволяет находить отношение между числами атомов в молекуле.
Например, необходимо определить формулу вещества, которое содержит натрий (32,43 %), серу (22,55 %) и кислород (45,02 %). Соотношение чисел атомов в формуле данного соединения:
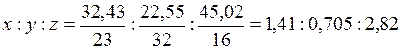
Если самое меньшее число (0,705) принять за единицу, то данное отношение становится отношением целых чисел:
x : y : z = 2 : 1 : 4,
следовательно, формула соединения Na2SO4. Эта формула будет простейшей, поскольку полученное соотношение может быть выражено также и числами, кратными найденным.
Для установления истинной, или молекулярной, формулы необходимо знать молекулярную (молярную) массу соединения; это позволяет найти истинное соотношение атомов в молекуле. Так, например, бензол содержит углерод (92,3 %) и водород (7,7 %). Найденная из этого состава простейшая формула СН. Но в действительности молекулярная масса бензола, определяемая по плотности его пара, равна не 13 (12 + 1, т.е. АС+АН), а 78. Следовательно, истинная формула бензола С6Н6.
Кристаллогидратами называются кристаллические вещества, включающие молекулы воды, например гипс CaSO4·2Н2О. Кристаллогидраты при нагревании теряют кристаллизационную воду, переходя в безводные соли. Пользуясь этим, можно определить содержание воды в кристаллогидрате, а затем, зная формулу безводной соли, рассчитать число молекул воды, присоединяющихся к одной молекуле безводной соли.
Приборы и реактивы
1. Фарфоровый тигель,
2. Песчаная баня,
3. Весы технические,
4. Эксикатор,
5. Медный купорос.
Порядок выполнения работы
1. Взвесить пустой фарфоровый тигель с точностью до 0,01 г. Во взвешенный тигель насыпать 0,5–1 г медного купороса. Тигель с кристаллогидратом снова взвесить.
2. Поместить тигель в нагретую песочную баню на 20–30 минут.
3. Перенести щипцами тигель в эксикатор и охладить.
4. Взвесить охлажденный тигель.
5. Повторить прогревание тигля, снова охладить его в эксикаторе и взвесить. Если масса изменилась не более чем на 0,01 г, прогревание прекратить.
6. По результатам последнего взвешивания заполнить таблицу результатов опыта:
| Масса пустого тигля, г | Масса тигля с кристаллогидратом, г | Масса кристаллогидрата, г | Масса тигля с веществом после прокаливания, г | Масса безводной соли, г | Масса воды, г |
7. Вычислить количество воды, приходящееся на один моль CuSO4, и записать формулу медного купороса, определенную опытным путем.
8. Определить относительную погрешность опыта:
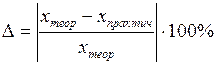 ,
,
исходя из того, что реальная формула медного купороса близка к CuSO4·5H2O.
Контрольные вопросы
1. Что показывает формула химического соединения?
2. Чем отличается простейшая формула вещества от истинной?
3. Какие вещества называются кристаллогидратами?
4. Приведите не менее 5 примеров кристаллогидратов. Где они находят применение?
5. Какие вещества называют дальтонидами?
6. Какие вещества называют бертоллидами?
7. Как определить массовые соотношения элементов в молекулах?
8. Для чего применяются в химическом эксперименте тигель, эксикатор, песчаная баня.
9. Какова формула соединения водорода с кислородом, если мольное соотношение Н:О = 1:1, а плотность его газа по водороду равна 17?
10. Определить формулу кристаллической соды, если при нагревании 286 г данной соли образовалось 106 г карбоната натрия.
Цель работы:
Определение молярной массы углекислого газа.
Теоретическая часть
Равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул (закон Авогадро). Отсюда следует, что массы равных объемов двух газов относятся друг к другу, как их молекулярные или численно им равные молярные массы:
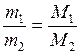
где m1 и m2 – массы газов;
M1 и M2 – молярные массы этих газов.
Отношение массы данного газа к массе того же объема другого газа, взятого при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Например, масса одного литра диоксида углерода равна 1,98 г, а масса одного литра водорода при тех же условиях составляет 0,09 г, следовательно, плотность CO2 по водороду равна:
1,98 : 0,09 = 22
Обозначим относительную плотность газа буквой D. Тогда:
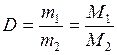 ,
,
откуда
М1 = D·М2,
то есть молярная масса газа равна его плотности по отношению ко второму газу, умноженному на молярную массу второго газа.
Чаще всего плотность газов определяют по отношению к самому лёгкому газу – водороду. Молярная масса водорода равна 2 г/моль, поэтому уравнение для расчета молярных масс газов имеет вид
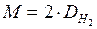
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, известна его средняя молярная масса, равная 29 г/моль. В этом случае уравнение для расчета молярных масс газов имеет вид
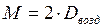
Молярную массу газа можно определить также через молярный объем, равный 22,4 л/моль. Для этого находят объем, занимаемый при нормальных условиях определенной массой газообразного вещества, а затем вычисляют массу 22,4 л этого вещества. Полученная величина является его молярной массой.
Измерения объемов газов обычно проводят при условиях, отличающихся от нормальных. Для приведения объема газа к нормальным условиям (н.у.) используется объединенный газовый закон:
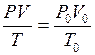
где V – объем газа при давлении P и температуре T;
V0 – объем газа при нормальном давлении P0 (101325 Па) и температуре T0 (273 К).
Молярную массу газа можно также вычислить по уравнению состояния идеального газа (уравнению Менделеева-Клапейрона)
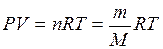
где P – давление газа (Па);
V – его объем (м3);
m – масса (г);
n – количество вещества, моль;
M – молярная масса (г/моль);
T – температура (К);
R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Приборы и реактивы
1. Аппарат Кипа.
2. Склянка Дрекселя.
3. Колба объемом 1 л.
4. Весы технические.
5. Мраморная крошка.
6. Соляная кислота, 0,1 М раствор.
7. Серная кислота, 1М раствор.
8. Вода дистиллированная.
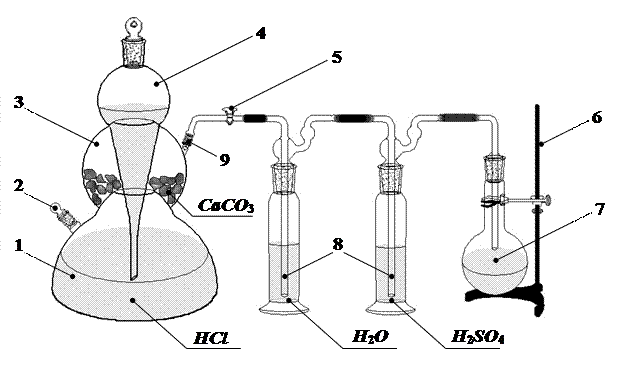
|
Рисунок 1. Схема лабораторной установки для получения углекислого газа в аппарате Киппа. 1, 3 – соединённые между собой резервуары, 2, 9 – тубусы, 4 – шарообразная воронка, 5 – кран, 6 – штатив, 7 – колба-приёмник,. 8 – склянка Дрекселя,
Порядок выполнения работы
1. Ознакомиться с установкой для получения углекислого газа в аппарате Кипа и убедиться в том, что она работает.
2. Колбу-приемник закрыть пробкой и отметить чертой уровень, до которого пробка вошла в горло колбы. Взвесить на технохимических весах колбу с пробкой с точностью до 0,01 г (m1).
3. Наполнить колбу диоксидом углерода из аппарата Киппа.
4. Через 5 мин, не закрывая кран у аппарата Киппа, медленно вынуть газоотводную трубку из колбы и тотчас закрыть колбу пробкой; после этого закрыть кран 5.
5. Взвесить колбу с диоксидом углерода на тех же весах и с той же точностью, что и колбу с воздухом (m2).
6. Измерить рабочий объем колбы V1, для чего наполнить колбу дистиллированной водой до черты на шейке колбы и замерить объем воды, вылив её в мерный цилиндр.
7. Записать значения атмосферного давления и температуры, при которых проводится опыт, а также уравнение получения углекислого газа при взаимодействии мрамора с соляной кислотой.
8. Вычислить объем газа V0 при н.у. по уравнению объединенного газового закона.
9. Вычислить массу воздуха (m3) в объеме колбы, учитывая, что при 0 °C и 101,3 кПа масса одного литра воздуха равна 1,293 г.
10. Найти массу пустой (без воздуха) колбы с пробкой: m4 = m1 – m3
11. Найти массу диоксида углерода в объеме колбы m5 = m2 – m4
12. Определить относительную плотность CО2 по воздуху:
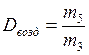
13. Вычислить молярную массу CO2 тремя способами:
а) по воздуху:
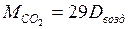 ,
,
б) по закону Авогадро:
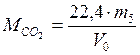 ,
,
в) по уравнению Менделеева–Клапейрона:
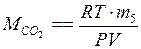 .
.
14. Вычислить среднее значение молярной массы углекислого газа с точностью до одного знака после запятой.
15. Определить погрешность опыта, сравнивая среднее опытное значение с теоретической величиной (44,0 г/моль), и оформить отчёт.
Контрольные вопросы
1. Закон Авогадро.
2. Следствия из закона Авогадро.
3. Нормальные и стандартные условия.
4. Объединенный газовый закон и уравнение Менделеева-Клайперона.
5. Во сколько раз углекислый газ тяжелее воздуха?
6. В аппарате Киппа для получения СО2 из мрамора используется соляная кислота. Почему нельзя использовать более дешевую серную кислоту?
7. При постоянном давлении и температуре масса одного литра водорода равна 0,082 г, а одного литра воды – 1 кг. Возможно ли определение плотности воды по водороду? Если невозможно, то почему?
8. Масса одного литра газа равна 2,86 г. Определите его молярную массу.
9. Плотность газа 1,96 г/л. Определите его молярную массу.
10. Установите формулу газообразного вещества, содержащего углерод (81,82 %) и водород (остальное), масса одного литра которого при нормальных условиях равна 2,6 г.
Цель работы
Установление эквивалентной и атомной массы неизвестного металла.
Теоретическая часть
Раздел химии, посвященный изучению количественных соотношений между реагирующими веществами, называется стехиометрией. Стехиометрические расчеты базируются на нескольких фундаментальных законах.
Закон сохранения массы веществ (М.В. Ломоносов, 1748 – 1756 г.г., А. Лавуазье, 1777 г.): «Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции».
Закон постоянства состава (Ж.Л. Пруст, 1801г.): «Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав».
Из закона постоянства состава следует, что элементы взаимодействуют между собой в строго определенных количественных соотношениях. Поэтому можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-всстановительных реакциях.
В общем случае эквивалент любого вещества X может быть записан как (1/Z)X, где Z – число эквивалентности, равное тому количеству ионов водорода в кислотно-основных реакциях, или электронов в окислительно-восстановительных реакциях, которое эквивалентно частице X. Для кислот, оснований, солей число эквивалентности Z равно соответственно основности, кислотности или количеству элементарных зарядов катионов или анионов, а для элемента – степени окисления, проявляемой им в данном соединении.
Масса 1 моля вещества эквивалента (1/Z)X называется молярной массой эквивалента М[(1/Z)X] и представляет собой отношение массы m вещества X к количеству вещества эквивалента n[(1/Z)X]:
М[(1/Z)X] = 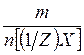 (г/моль)
(г/моль)
Молярная масса вещества X и молярная масса эквивалента (1/Z)X связаны следующим соотношением:
М[(1/Z)X] = 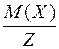
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Так для реакции:
| a А + | b В + | c С + | dD |
| m(A) | : m(B) | : m(C) | : m(D) |
М 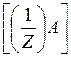
| :М 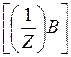
| :М 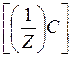
| :М 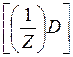
|
Иначе говоря, массы взаимодействующих без остатка веществ относятся друг к другу, как их эквивалентные массы:
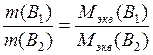
Эквивалентные массы элементов и соединений используются при выражении концентрации растворов (молярная концентрация эквивалентов), при оценке жесткости воды, в расчетах по электролизу и т. д.
Через эквивалентную массу элемента может быть определена его атомная масса, так как они связаны между собой соотношением:
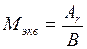 или
или 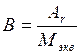 ,
,
где В – валентность элемента.
При этом эквивалентная масса определяется экспериментально, а атомная масса рассчитывается приблизительно по закону Дюлонга-Пти, который гласит: атомная теплоемкость (т.е. произведение удельной теплоемкости С и атомной массы Аr) простых веществ в твёрдом состоянии примерно одинакова и составляет в среднем около 26 Дж/(моль ⋅ К), то есть C·Аr ≈ 26.
Разделив приблизительную атомную массу на эквивалентную массу, получают валентность элемента, которую округляют до ближайшего целого числа. После этого умножением эквивалентной массы на валентность получают более точное значение атомной массы.
Пример 1. Один атом хлора соединяется с одним атомом водорода, образуя хлороводород (НСl). Следовательно, эквивалент хлора в этом соединении равен 1.
Пример 2. Кислород с водородом образует два соединения: Н2О2 (пероксид водорода) и Н2О (вода). В первом соединении эквивалентом кислорода является его атом и эквивалентная масса равна шестнадцати, а во втором – эквивалентом кислорода является 1/2 атома и эквивалентная масса равна восьми.
Пример 3. Серная кислота содержит два атома водорода. В реакции замещения одного из них эквивалентом кислоты является её молекула с эквивалентной массой 98, а в реакции замещения двух атомов водорода – половинка молекулы (условная частица) с эквивалентной массой 49.
Пример 4. При взаимодействии 59,5 мг металла с серной кислотой выделилось 21,9 мл водорода (объем измерен при температуре 17°С и давлении750 мм рт. ст.). Удельная теплоемкость металла 0,39 Дж/(г·К). Вычислить атомную массу металла и определить, какой это металл.
Решение.
1) Переводим экспериментальные данные в систему СИ:
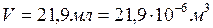 ,
,
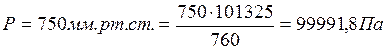 .
.
2) По уравнению Менделеева-Клапейрона вычисляем массу водорода:
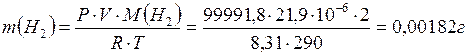 .
.
3) По закону эквивалентов определяем эквивалентную массу металла:
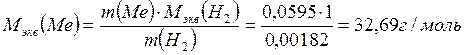 .
.
4) По закону Дюлонга-Пти находим приблизительную атомную массу металла:
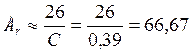 .
.
5) Определяем приблизительное значение валентности
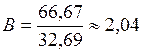
и округляем его до целого числа 2.
6) Рассчитываем точную атомную массу:
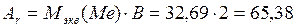
По периодической системе определяем металл – это цинк.
Приборы и реактивы
1. Эвдиометр,
2. Весы аналитические,
3. Барометр,
4. Термометр,
5. Анализируемый металл,
6. Серная кислота,
7. Вода дистиллированная.
Порядок выполнения работы
Эквивалентная масса металла определяется по водороду, который выделяется при взаимодействии металла с серной кислотой. Теплоемкость металла сообщает преподаватель. Взвешивание металла производится с точностью 0,001 г на аналитических весах.
Опыт проводится на приборе, называемом эвдиометром, изображенном на рисунке 2.
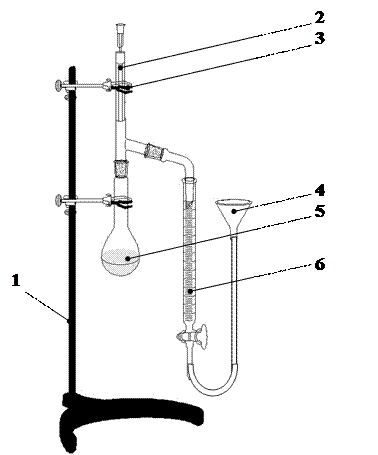
|
Рисунок 2. Схема установки для определения эквивалентной массы металла: 1 – штатив, 2 – пробирка, 3 – зажим, 4 – уравнительная воронка, 5 – колба Вюрца, 6 – мерная бюретка.
Установка собрана на химическом штативе (1). Она состоит из стеклянного реакционного сосуда (4), в котором находится кислота, мерной бюретки (5) для сбора выделяющего водорода и уравнительной воронки (6). Реакционным сосудом (4) является колба Вюрца объемом 50 мл с присоединенной пробиркой (2). Они соединены поливинилхлоридной трубкой, которую можно пережимать съемным зажимом (3).
Ход измерения.
1. Получив от преподавателя кусочек металла массой 0,02–0,03 г, взвесить его на аналитических весах и узнать у преподавателя его теплоёмкость. Массу и теплоемкость записать в таблицу 1.
2. Снять пробирку (2), поднять и закрепить уравнительную воронку (6) на штативе в таком положении, при котором уровень столбика воды в мерной бюретке (5) находится вблизи крайнего верхнего деления. При необходимости долить в воронку воду. После этого перекрыть полихлорвиниловую трубку зажимом (3), положить в пробирку (2) металл и вставить пробирку в полихлорвиниловую трубку.
3. Проверить прибор на герметичность. Для этого опустить уравнительную воронку (6) вниз примерно до 1/3–1/2 высоты штатива, наблюдая за уровнем воды в мерной бюретке (5). Если уровень воды не изменяется, то прибор герметичен, и на нем можно продолжить работу. Если уровень воды все время понижается, то прибор не герметичен. В этом случае устранить неисправность или попросить заменить установку.
4. Возвратить воронку (6) в исходное (верхнее) положение и записать уровень воды в мерной бюретке (5). Открыв зажим, сбросить металл в кислоту. Наблюдать протекание реакции и выделение водорода по понижению уровня воды в мерной бюретке (5). Передвигать уравнительную воронку (6) вниз синхронно с понижением уровня воды в бюретке (5).
5. После окончания реакции выдержать около 10 мин для охлаждения водорода до температуры в лаборатории (реакция идет с выделением тепла). После этого уровень воды в бюретке (5) и воронке (6) установить одинаковым и записать его в таблицу экспериментальных данных:
| № п/п | Название величины | Обозначение | Единица измерения | Значение |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Масса металла | m(Ме) | г | |
| 2 | Удельная теплоемкость металла | С | Дж/(г ⋅ К) | |
| 3 | Начальный уровень воды в бюретке | V1 | мл | |
| 4 | Уровень воды после реакции | V2 | мл | |
| 5 | Объем водорода | V(H2) | мл |
| 1 | 2 | 3 | 4 | 5 |
| 6 | Температура в лаборатории | t | оC | |
| 7 | Температура по абсолютной шкале | T | K | |
| 8 | Давление по барометру | P | мм рт. ст. | |
| 9 | Давление водяного пара | P(H2O) | мм рт. ст. | |
| 10 | Давление водорода | P(H2) | мм рт. ст. | |
| 11 | Давление водорода | P(H2) | Па |
6. Записать значения температуры и давления в таблицу, вычислить и записать остальные показатели опыта.
7. По примеру, приведенному в теоретической части, вычислить эквивалентную массу металла, его валентность и атомную массу.
При вычислении массы водорода иметь в виду, что в реакции выделяется влажный водород и поэтому его давление равно общему давлению по барометру за вычетом давления водяного пара:
Р(Н2) = Р – Р(Н2О)
Давление водяного пара при различных температурах T0C
| T0C | P(H2О), кПа | P(H2О), мм рт. ст. | T, 0C | P(H2О), кПа | P(H2О), мм рт. ст. |
| 10 | 1,226 | 9,2 | 18 | 2,066 | 15,5 |
| 11 | 1,306 | 9,8 | 19 | 2,199 | 16,5 |
| 12 | 1,399 | 10,5 | 20 | 2,333 | 17,5 |
| 13 | 1,493 | 11,2 | 21 | 2,479 | 18,0 |
| 14 | 1,599 | 12,0 | 22 | 2,639 | 19,8 |
| 15 | 1,706 | 12,8 | 23 | 2,813 | 21,1 |
| 16 | 1,813 | 13,6 | 24 | 2,986 | 22,4 |
| 17 | 1,933 | 14,5 | 25 | 3,013 | 23,5 |
9. По полученной в опыте атомной массе найти данный металл в периодической системе и записать его теоретическое (табличное) значение атомной массы.
10. Вычислить ошибку в определении атомной массы металла по формуле
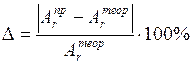 .
.
11. Оформить отчет, сформулировать вывод.
Контрольные вопросы
1. Приведите определение понятий эквивалент и эквивалентная масса химического элемента и соединения.
2. Закон эквивалентов.
3. Как рассчитать значения эквивалентов кислоты, основания, соли?
4. Как определяется эквивалентный объем веществ?
5. Чему равны эквивалентные объемы водорода и кислорода при нормальных условиях?
6. Эквивалентная масса какого элемента равна 1?
7. Вычислите молярную массу эквивалента элемента, оксид которого содержит 22,2 % кислорода.
8. Чему равна молярная масса эквивалента ортофосфорной кислоты, если 1 моль Н3РО4 провзаимодействовал с 1 моль гидроксида калия?
9. Молярная масса эквивалента металла равна 56,2 г/моль. Вычислите массовую долю металла в его оксиде.
10. Какой объем кислорода (н.у.) потребуется для реакции с 15 г элемента, имеющего молярную массу эквивалента 3 г/моль?
Цель работы:
Освоить технику приготовления растворов заданной концентрации, научиться измерять плотности жидкостей с помощью ареометра. Выработать навыки работы с мерной посудой, научиться основам объемного анализа растворов (метод титрования).
Теоретическая часть
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в определенных пределах может непрерывно изменяться. Различают газообразные, твердые и жидкие растворы.
Газообразные растворы обычно представляют собой смеси газов и реже — растворы жидкостей или твердых веществ в газах. Газы способны смешиваться во всех отношениях при любых условиях.
Твердые растворы образуются при кристаллизации жидких расплавов или при растворении газов в твердых веществах. Различают твердые растворы замещения, внедрения и вычитания.
Твердые растворы замещения, которые образуются при сохранении структуры кристаллической решетки растворителя, являются наиболее распространенными. При образовании твердых растворов замещения в узлах кристаллической решетки данного вещества атомы, молекулы и ионы замещаются частицами другого вещества. Образование таких растворов возможно, если оба вещества близки по кристаллохимическим свойствам и размерам частиц. При образовании твердых растворов замещения оба вещества часто неограниченно растворяются друг в друге, при этом в системе образуется непрерывный ряд твердых растворов. Тип решетки и число частиц в кристаллической ячейке при этом остаются неизменными, но изменяются ее объем и плотность.
Твердые растворы внедрения получаются путем внедрения частиц одного вещества в междоузлия кристаллической решетки другого вещества (растворителя). Растворы внедрения образуются в том случае, когда размеры частиц внедряемого вещества меньше размеров частиц растворителя. Такие растворы обычно возникают при растворении неметаллов (водорода, азота, углерода, кислорода, бора, кремния) в металлах. При внедрении новых частиц в промежутки между атомами металла происходит увеличение напряжений в кристаллической решетке, в связи с чем область существования твердых растворов внедрения невелика. При образовании твердых растворов этого типа растворимость внедряющегося компонента ограничена, вследствие чего в системе образуется прерывный ряд твердых растворов. Число частиц в элементарной кристаллической ячейке и ее объем увеличиваются.
Твердые растворы вычитания встречаются значительно реже. Они получаются при выпадении некоторых атомов из кристаллической ячейки, в связи с чем эти растворы иногда называют твердыми растворами с дефектной решеткой.
Взаимная растворимость веществ, образующих твердые растворы, зависит от внешних условий и особенно от температуры. С понижением температуры взаимная растворимость веществ часто уменьшается, а это приводит к разделению исходного твердого раствора на два насыщенных твердых раствора — раствора первого вещества во втором и второго в первом. Такой процесс называется разрывом сплошности твердых растворов.
Различают твердые растворы с неограниченной и ограниченной растворимостью компонентов в твердом состоянии. Наиболее распространенными являются системы, в которых образуются твердые растворы с ограниченной растворимостью компонентов. Такого типа твердые растворы встречаются среди металлических, солевых и органических систем, например, Со—Mo, Bi—Sn, KNO3—NaNO3. Системы, в которых образуются твердые растворы с неограниченной растворимостью веществ в твердом состоянии, встречаются реже. К таким системам относятся системы Ag—Аu, AgCl—NaCl, CaSiO3—MnSiO3 и др.
На практике наиболее часто приходится встречаться с жидкими растворами. В жидком растворе обычно различают растворитель и растворенное вещество, хотя с термодинамической точки зрения все компоненты раствора равноценны. Под растворителем понимают вещество, которое имеется в растворе в большем количестве. Остальные компоненты, присутствующие в растворе в меньших количествах, называются растворенными веществами. Такое деление на растворитель и растворенное вещество крайне условно, особенно если количества компонентов в растворе соизмеримы.
Важной характеристикой раствора является его состав или концентрация компонентов. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Обычно растворитель обозначают индексом (1), а растворённое вещество индексом (i).
Для выражения концентраций раствора применяются различные способы:
1. Молярная (мольная) доля (х,), или молярное (мольное) содержание (хг,%), данного компонента, выраженное в процентах:
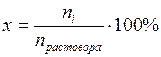
где ni – количество i-го компонента, моль.
2. Массовая доля (ω), или массовое содержание (ω,%), данного компонента, выраженное в процентах:
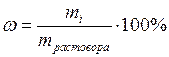
где mi – масса i-го компонента.
3. Объемная доля ( j ), или объемное содержание ( j ,%), данного компонента, выраженное в процентах:
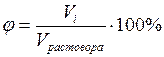
где Vi – объем i-го компонента.
4. Молярная концентрация или молярность (ci) — количество i-го компонента в молях в 1 л раствора:
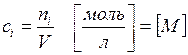
где V – объем раствора, л.
5. Концентрация эквивалента или нормальность (сЭ) – эквивалентное количество i-го компонента, растворенное в 1 дм3 раствора:
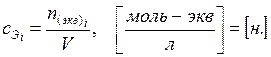 .
.
Молярность и нормальность связаны между собой соотношением:
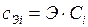 ,
,
где Э – значение эквивалента вещества.
6. Моляльностъ (m i) — количество i-го компонента в молях в 1000 г растворителя:
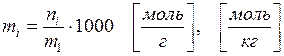
где m1 — масса растворителя, г, кг.
7. Состав раствора может быть выражен через разбавление (разведение) (r) — количество растворителя в молях, приходящееся на 1 моль растворенного вещества:
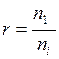
8. Титром раствора (Т) называют число граммов растворенного вещества в 1 см3 (мл) раствора.
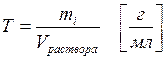
В физико-химических исследованиях концентрации компонентов раствора чаще выражают через молярные доли или через моляльность, между которыми существует соотношение
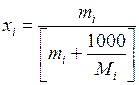 ,
,
где Мi — молекулярная масса растворителя
Определение концентрации раствора по его плотности. Между плотностью раствора ρ и концентрацией растворенного вещества существует непосредственная зависимость. Для наиболее часто применяемых кислот, растворимых оснований и солей данная зависимость установлена и приводится в справочниках в виде таблиц. Благодаря этому ориентировочное определение концентрации растворенного вещества в пределах точности ±0,5% может быть проведено путем экспериментального измерения плотности раствора и последующего нахождения концентрации вещества по табличным данным. Более точно концентрация растворенного вещества определяется методами аналитической химии.
Определение концентрации раствора титрованием. Среди многочисленных методов определения концентрации растворов самым простым и достаточно точным является метод титрования. Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. Титриметрические методы дают большой выигрыш во времени, поэтому их так широко используют в химических лабораториях. В титриметрическом анализе реакцию проводят между двумя растворами и как можно точнее определяют момент завершения реакции между обоими веществами. Зная концентрацию одного, можно установить и точную концентрацию другого. Титриметрический анализ заключается в точном измерении объемов реагирующих веществ. Например, при определении концентрации серной кислоты достаточно знать ее объем и объем и концентрацию щелочи. Реакция между кислотой и щелочью протекает мгновенно, окончание реакции фиксируется точно, поэтому измерения объемов и вычисления можно провести менее чем за 15 мин. Важным моментом в титриметрии является установление момента завершения реакции (точки эквивалентности). Точность титриметрических определений в значительной степени зависит от правильности установления точки эквивалентности, или, иначе говоря, от индикации точки эквивалентности. Все способы индикации точки эквивалентности можно разделить на три группы: 1) самоиндикация; 2) использование специальных индикаторов; 3) физико-химические способы.
К индикаторам относят большой круг органических и неорганических веществ, которые позволяют установить точку эквивалентности по изменению цвета, появлению или исчезновению мути, свечения. В большинстве случаев индикатор вводят в анализируемый раствор, тогда его называют внутренним. Если отбирают каплю раствора и смешивают ее с индикатором на белой фарфоровой пластинке или фильтровальной бумаге, то индикатор называют внешним. В настоящее время все более широкое применение находят физико-химические методы индикации, так как некоторые из них можно полностью автоматизировать. Их можно применять и тогда, когда нет полноты протекания реакции между титрантом и титруемым веществом.
В зависимости от приемов определения точки эквивалентности выделяют несколько методов титрования:
1. Прямое титрование, когда непосредственно (прямо) реагируют два раствора, концентрация одного из которых известна, а концентрация другого неизвестна. Например, раствор кислоты (НС l, H2SO4) с известной концентрацией приливают по каплям к раствору щелочи с неизвестной концентрацией. В большинстве случаев используют прямое титрование.
2. Обратное титрование (титрование по остатку). В некоторых случаях нельзя применить прием прямого титрования, например, если раствор А не реагирует с раствором В или же реагирует очень медленно, но существует третье вещество С, которое реагирует с А и В. В этом случае осуществляют реакцию между веществом А и веществом С, которое берут с заведомым избытком, и избыток вещества С заставляют прореагировать с веществом В. Если концентрации веществ В и С известны, то можно определить и концентрацию вещества А.
3. Метод замещения. Если вещества А и В не взаимодействуют между собой, можно найти вещество С, которое при взаимодействии с веществом А выделяет эквивалентное количество вещества D, которое взаимодействует с веществом В. По количеству выделенного вещества D можно определить количество вещества А.
Приборы и реактивы
1. Мерные цилиндры вместимостью 10—20, 100—200 мл.
2. Колбы мерные вместимостью 100—200 мл.
3. Колбы конические вместимостью 100—200 мл.
4. Пипетки вместимостью 15, 20, 25 мл.
5. Штатив с бюреткой вместимостью 50 мл.
6. Стеклянная воронка.
7. Набор ареометров.
8. Титрованный раствор гидроксида натрия.
9. Индикатор метиловый оранжевый или фенолфталеин.
10. Раствор серной кислоты (10—15%).
11. Фильтровальная бумага.
12. Резиновая груша.
13. Вода дистиллированная.
Порядок выполнения работы
Приготовление раствора.
Получите у преподавателя задание на приготовление раствора серной кислоты определенной концентрации. Объем раствора также указывается преподавателем. Произведите расчет количества исходного раствора серной кислоты (концентрация ее определялась вами по плотности), который будет использован для приготовления необходимого объема раствора заданной концентрации. Расчет покажите преподавателю.
В мерную колбу указанного объема налейте дистиллированной воды до половины объема колбы. Затем отмерьте цилиндром рассчитанное вами количество исходного раствора серной кислоты и влейте его в мерную колбу. Доливая воду с помощью пипетки, доведите объем раствора в мерной колбе до риски на шейке колбы, закроите колбу пробкой и тщательно перемешайте раствор. Теперь нужно определить точную концентрацию этого раствора методом титрования.
Титрование.
В три конические колбы отмерьте пипеткой, используя резиновую грушу, раствор щелочи известной концентрации. Промойте бюретку приготовленным раствором кислоты и заполните ее этим раствором, снимите воронку и установите уровень раствора на нулевое деление по нижнему краю мениска. Кончик бюретки должен быть заполнен раствором.
В одну из колб со щелочью добавьте 2 – 3 капли индикатора метилового оранжевого (фенолфталеина) и прибавляйте из бюретки небольшими порциями (по 0,5 мл) кислоту до изменения окраски индикатора. Раствор в колбе во время опыта следует все время перемешивать легким круговым движением колбы. Как только метиловый оранжевый изменит свою окраску, добавление кислоты прекратите и произведите отсчет объема израсходованной кислоты с точностью до десятых долей миллилитра.
Повторите титрование более точно не менее двух раз. Последние порции кислоты (0,5 – 0,7 мл) прибавляйте по каплям. Резкое изменение окраски индикатора от одной капли кислоты является показателем конца реакции. Определите объем израсходованной кислоты. Перед каждым титрованием уровень кислоты в бюретке доводите до ближайшего нулевого деления.
Определение рН-раствора
Цель работы:
Овладеть методикой определения водородного показателя рН раствора с применением набора индикаторов и с помощью иономера (рН-метра).
Теоретическая часть
Автопротолиз воды
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая и объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
Н2O Û Н+ + ОН–
При этом в чистой воде при 25°С [Н+] = [ОН–] = 10–7моль/л. Тогда константа диссоциации будет:
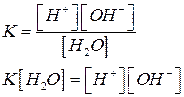
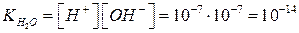
Поскольку 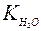 постоянная величина, то при добавлении к воде гидроксид ионов, концентрация ионов водорода снизится, и, наоборот, при добавлении кислоты концентрация ионов водорода возрастет. Поэтому, зная концентрацию ионов водорода, можно охарактеризовать кислотность среды:
постоянная величина, то при добавлении к воде гидроксид ионов, концентрация ионов водорода снизится, и, наоборот, при добавлении кислоты концентрация ионов водорода возрастет. Поэтому, зная концентрацию ионов водорода, можно охарактеризовать кислотность среды:
Нейтральный раствор, [Н+] = 10–7 моль/л
Кислыйраствор, [Н+] > 10–7 моль/л
Щелочнойраствор, [Н+] < 10–7 моль/л.
Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через рH:
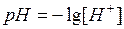 .
.
Тогда:
Нейтральный раствор, рH = 7
Кислыйраствор, рH < 7
Щелочнойраствор, рH > 7.
Таким образом, кислотность среды в растворе электролита можно определить с учетом степени диссоциации растворенного вещества, пользуясь соотношениями:
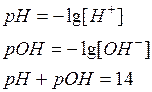 ,
,
где α – степень диссоциации электролита.
Так как величина рН является важной характеристикой любого водного раствора, включая производственные растворы.
Приборы и реактивы
1. Капельницы с растворами индикаторов.
2. Универсальная индикаторная бумага.
3. Иономер (рН-метр рН-410).
4. Стаканы стеклянные вместимостью 25 – 50 мл.
5. Дистиллированная вода.
6. Фильтровальная бумага.
Порядок выполнения работы
Пример1
Искомое значение рН= (3,1 – 2,8) /2 ≈ 3,0
Пример 2
Искомое значение рН= (12,1 – 10,1)/2 = 11,1
Для итогового определения рН проведите его повторное измерение, используя по возможности другие индикаторы, например, вместо лакмуса очень близкий к нему по интервалу метиловый красный.
Гидролиз солей
Цель работы:
Проведение гидролиза некоторых солей, изучение влияния состава солей и внешних условий на полноту их гидролиза.
Теоретическая часть
Гидролиз соли – процесс взаимодействия соли с водой, приводя щий к образованию слабодиссоциирующих частиц (молекул или ионов). Гидролиз солей качественно можно рассматривать как результат поляризационного взаимодействия ионов соли с их гидратной оболочкой и упрощенно представить следующими схемами:
К n+ + НОН Û КОН(n–1)+ + Н+,
А n– + НОН Û НА(n–1)– + ОН– .
Гидролиз обусловлен образованием малодиссоциирующих частиц КОН(n–1)+ и НА(n–1)–
Чем больше заряд и меньше радиус ионов соли, тем сильнее их поляризационное взаимодействие с водой, слабее диссоциация образующихся частиц КОН(n–1)+ и НА(n–1)–, и в большей степени происходит гидролиз.
Поляризующее влияние на молекулы воды невелико у катионов щелочных и щелочноземельных металлов (сильные основания), однозарядных анионов, и некоторых двухзарядных (сильные кислоты). Поэтому соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются.
Возможны следующие случаи гидролиза солей:
1. по аниону,
2. по катиону,
3. по катиону и аниону одновременно.
Гидролиз по аниону. Ему подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты (К2СО3, Na2S, Na2SO3, K3PO4 и др.). При гидролизе создается щелочная среда (рН > 7). Например:
CH3COONa → СН3СОО– + Na+,
Na+ + НОН → реакция не идет,
СН3СОО– + НОН ↔ СН3СООН + ОН– .
Молекулярное уравнение гидролиза:
CH3COONa + НОН ↔ СН3СООН + NaOH.
Данный процесс обратимый, равновесие гидролиза сильно смещено влево, поскольку К(Н2О) < К(СН3СООН).
Гидролиз многозарядного аниона протекает ступенчато и при обычных условиях главным образом идет только по первой ступени. Например:
Na2SO3 → 2Na+ + SO32–,
Na+ + НОН → реакция не идет,
SO32– + НОН ↔ H S О3– + ОН– (1 ступень),
HSO3– + НОН ↔ H2SO3 + ОН– (2 ступень).
Молекулярные уравнения соответственно имеют вид:
Na2SO3 + HOH ↔ NaHSO3 + NaOH,
NaHSO3 + НОН ↔ H2SO3 + NaOH.
Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.). Среда при гидролизе кислая (рН < 7). Например:
С u С12 → С u2+ + С l–,
С l– + НОН → реакция не идет,
С u2+ + НОН ↔ С u ОН+ + Н+ (1 ступень).
Молекулярное уравнение первой ступени гидролиза
С u С l2 + НОН ↔ CuOHCl + HCl.
Гидролизом по второй ступени при обычных условиях можно пренебречь.
Гидролиз по катиону и аниону. По катиону и аниону гидролизуются соли, образованные катионом слабого основания и анионом слабой кислоты. Например:
CH3COONH4 → СН3СОО– + NH4+,
СН3СОО– + НОН ↔ СН3СООН + ОН– ,
NH4+ + НОН ↔ NH4OH + Н+,
СН3СОО– + NH4+ + НОН ↔ СН3СООН + NH4OH.
Молекулярное уравнение
CH3COONH4 + НОН ↔ СН3СООН + NH4OH.
Гидролиз в данном случае протекает довольно интенсивно. Образующиеся при гидролизе ионы Н+ и ОН– связываются в молекулы Н2О, что усиливает гидролиз и по катиону, и по аниону. Реакция среды зависит от соотношения констант диссоциации образующихся кислоты и основания.
Если кислота и основание, образующиеся в процессе гидролиза, уходят из зоны протекания реакции (в виде осадка или газа), то гидролиз может протекать практически необратимо. Так, например, А12S3 при контакте с водой полностью превращается в малорастворимый гидроксид алюминия и в газообразный сероводород:
Al2S3 + 6HOH → 2Al(OH)3↓ + 3H2S↑.
По этой же причине, смешивая водные растворы А l С l3 и Na2S, нельзя получить А l2S3:
2А l С l3 + 3Na2S + 6HOH → 2Al(OH)3↑ + 3H2S↓ + 6NaCl,
2Al3+ + 3S2– + 6H2O → 2Al(OH)3 + 3H2S.
Из-за взаимного усиления гидролиза по катиону и по аниону (совместного гидролиза) в водном растворе также невозможно синтезировать карбонаты алюминия, хрома(III), железа (III), сульфид хрома (III), некоторые другие соли. Приведем еще один пример совместного гидролиза:
2А l С l3 + 3Na2CO3 + 3НОН → 2А l(ОН)3↓ + 3CO2↑ + 6NaCl,
2А l3+ + 3СО32– + 3НОН → 2А l(ОН)3↓ + 3СО2↑.
Приборы и реактивы
1. Универсальная индикаторная бумага.
2. Пробирки.
3. Пипетки.
4. Спиртовая горелка.
5. Растворы солей: хлорид калия, сульфат алюминия, нитрат свинца (II), карбонат натрия, сульфат железа (II), хлорид железа (III), сульфит натрия, хлорид сурьмы (III), сульфид натрия.
6. Вода дистиллированная.
Порядок выполнения работы
Опыт 6. Образование оксосоли при гидролизе
В пробирку внести 2–3 капли раствора хлорида сурьмы (III). Проверить с помощью индикаторной бумаги среду раствора (рН).
Содержимое пробирки разбавить водой. Что наблюдается? Написать уравнения гидролиза соли по первой и второй ступеням и уравнение образования оксосоли, которая выпадает в осадок.
Контрольные вопросы
1. Какой процесс называется гидролизом?
2. Какие виды гидролиза вы знаете?
3. Приведите примеры растворимых в воде солей, среда растворов которых нейтральная, кислая, щелочная. Напишите уравнения их гидролиза в молекулярном и ионно-молекулярном виде.
4. Приведите примеры солей, гидролиз которых идет только по катиону, только по аниону, и по катиону и по аниону одновременно. Напишите уравнения их гидролиза в молекулярном и ионно-молекулярном виде.
5. Приведите примеры солей, гидролиз которых возможен по одной, двум и трем ступеням. Напишите уравнения их гидролиза в молекулярном и ионно-молекулярном виде.
6. Напишите в молекулярном и ионном виде уравнения совместного гидролиза: а) сульфата хрома (III) и карбоната натрия и б) нитрата алюминия и сульфида калия.
7. Как влияет добавление растворов КОН, ZnCl2, Na2S, соляной кислоты и твердого NaCl на гидролиз карбоната калия (гидролиз усиливает, ослабляется, влияния не наблюдается).
8. Как влияет добавление растворов NaОН, Na2CO3, Al2(SO4)3, серной кислоты и твердого K2SO4 на гидролиз хлорида цинка (гидролиз усиливает, ослабляется, влияния не наблюдается).
9. Напишите в молекулярном и ионном виде уравнения трех степеней гидролиза хлорида железа (III). Объясните, почему при комнатной температуре гидролиз идет только по первой ступени, а при кипячении раствора – по всем трем.
10. В одномолярном растворе нитрата цинка водородный показатель (рН) равен 2. Чему равна степень гидролиза соли (%)?
Цель работы:
Научится определять тепловой эффект реакции по экспериментальным данным.
Теоретическая часть
Суть первого закона термодинамики заключается в том, что тела могут обмениваться между собой энергией в виде тепла и работы, при этом энергия не исчезает и не возникает ниоткуда. Отсюда видно, что этот закон представляет собой одну из форм закона сохранения энергии.
Рассмотрим другой вариант: система совершает незамкнутый процесс, переходя из состояния I в состояние II. При этом она поглощает теплоту Q и совершает работу А. В общем случае состояния I и II могут отличаться значениями своих параметров, т. е. в самой системе могли произойти какие-то изменения, и в общем случае сумма количества теплоты, поглощенного системой, и работы, которую система при этом совершила, не равна нулю и приводит к изменению внутренней энергии:
Q = D U +A (1)
Основываясь на этой формуле можно дать следующую формулировку первого начала термодинамики:
Количество энергии, которое выделяется или поглощается в форме теплоты и работы, равно изменению внутренней энергии.
Различные химические реакции могут протекать как при постоянном объеме, так и при постоянном давлении. Определим, изменению каких функций состояния соответствуют при этом их тепловые эффекты.
Пусть система совершает работу только против сил внешнего давления, тогда изменение внутренней энергии будет равно:
D U=Q – p D V, (2)
где р — внешнее давление,
D V — изменение объема.
Произведение p D V=A – работа.
Если реакция протекает при постоянном объеме, то изменение объема равно нулю, следовательно, произведение p D V=Q. Таким образом, тепловой эффект химической реакции, протекающей при постоянном объеме, равен изменению внутренней энергии системы:
QV= D U. (3)
Рассмотрим, чему будет равен тепловой эффект реакции при постоянном давлении. В этом случае уравнение [3] примет вид:
U2 – U1, = Qp – p(V2 – V1).
Отсюда
Qp = (U2 – pV2} – (U1 – pV1).
Выше отмечалось, что параметры системы подпадают под определение функции состояния, так как их изменение зависит только от значений в начальном и конечном состояниях системы. Поэтому произведение давления на объем будет функцией состояния системы, а сумма этого произведения с внутренней энергией также будет представлять функцию состояния, которая называется энтальпией (H):
H=U+pV. (4)
Тепловой эффект реакции при постоянном давлении можно представить в виде изменения свойства системы, т. е.
Qp=H2-H1= D H, (5)
где H1 — энтальпия исходных веществ,
H2 — энтальпия продуктов реакции.
Иными словами, Qp, так же как и Qv, не зависит от пути протекания реакции.
Из уравнений [4] и [5], учитывая уравнение Менделеева-Клапейрона:
pV= n RT,
получим соотношение между тепловыми эффектами реакций между идеальными газами, протекающих при постоянных давлении и объеме:
Qp = Q V + n RT. (1)
Теплоемкость — количество теплоты, поглощаемое телом при нагревании на 1 градус (1°С или 1 К).
Теплоемкость единицы массы вещества называют удельной теплоемкостью [Дж/кг∙К]
Теплоемкость 1 моля вещества — молярная (мольная) теплоемкость [Дж/моль∙К].
Количество теплоты, поглощенное телом при изменении его состояния, зависит не только от начального и конечного состояний, но и от условий перехода между ними. Различают теплоемкость при постоянном объеме (СV) и теплоемкость при постоянном давлении (СP,). При постоянном давлении нагревание приводит к тому, что часть теплоты идет на совершение работы расширения тела, а часть — на увеличение его внутренней энергии, тогда как при нагревании при постоянном объеме вся теплота расходуется на увеличение внутренней энергии.
Для идеальных газов:
Cp = CV+R.
По знаку теплового эффекта реакции делятся на: эндотермические – реакции, протекающие с поглощением тепла, и экзотермические – реакции, в результате которых тепло выделяется.
Запись термохимических уравнений отличается от записи уравнений химических реакций. При написании термохимических уравнений реакций необходимо указать дополнительную информацию:
а) для всех участников процесса – и для реагентов (веществ, вступивших в реакцию), и для продуктов (веществ, образовавшихся в результате реакции), используя нижние индексы, указывают их агрегатные состояния:
«к» – кристаллическое;
«ж» – жидкое;
«г» – газообразное;
«р» – раствор.
б) в правой части уравнения указывают тепловой эффект реакции. Например:
2NaK + Н2ОЖ = 2NaOHp + Н2г + 368 кДж
В термохимических таблицах обычно приводятся тепловые эффекты реакций при постоянном давлении, которые обозначаются D r HT0, где нижний индекс Т соответствует температуре, к которой относится данное значение теплового эффекта (обычно для Т= 298 К). Верхний индекс «°» означает, что все участники реакции находятся в стандартных состояниях. Этот тепловой эффект реакции называют изменением энтальпии реакции или чаще просто энтальпией реакции.
Различают следующие виды энтальпии:
1. Стандартная теплота (энтальпия) образования соединения. Эта величина является одной из ключевых величин в термодинамике. Стандартной энтальпией образования химического соединения называют стандартное изменение энтальпии в результате реакции образования 1 моля этого вещества из простых веществ, взятых в том агрегатном состоянии, в котором они находятся при стандартных условиях. Стандартные энтальпии образования простых веществ принимаются равными нулю. Энтальпия образования измеряется в кДж/моль.
2. Стандартная энтальпия сгорания. Эта величина чаще всего определяется при термохимических измерениях в калориметрах (специальных приборах). Стандартной энтальпией сгорания называется энтальпия реакции сгорания вещества в кислороде с образованием оксидов элементов, имеющих высшую степень окисления, или простых веществ, если они более устойчивы в данных условиях, чем оксиды.
3. Стандартная энергия (энтальпия) химической связи. Это изменение энтальпии в реакции образования одного моля двухатомных молекул (или других двухатомных частиц) из атомов веществ, находящихся в газообразном состоянии. Образование химической связи — процесс экзотермический, и поэтому энтальпия его всегда имеет отрицательное значение.
4. Стандартная энтальпия сублимации, испарения и плавления. Она равна стандартному изменению энтальпии при переходе одного моля твердого (жидкого) вещества в газообразное состояние. Так как большинство металлов переходит в газ в атомарном состоянии, для металлов эту величину еще называют энтальпией атомизации.
В основе всех термохимических расчетов лежит закон Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний системы и не зависит от пути перехода (от промежуточных состояний).
Этот закон справедлив для реакций, протекающих либо: при постоянном объеме — в этом случае тепловой эффект реакции равен изменению внутренней энергии системы, либо при постоянном давлении — тогда тепловой эффект реакции равен изменению энтальпии, т. е. разности между алгебраическими суммами энтальпий образования продуктов и исходных веществ:
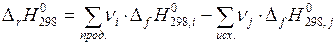
С помощью закона Гесса можно определить энтальпии образования веществ, которые невозможно измерить непосредственно.
На практике тепловые эффекты реакций определяются при различных температурах. При этом для любой химической реакции имеет место равенство:
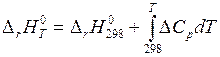
являющееся математическим выражением закона Кирхгофа.
Приборы и реактивы
1. Химические стаканы, 250 и 500 мл.
2. Воронка.
3. Штатив.
4. Магнитная мешалка.
5. Бюретка.
6. Термометр.
7. 1 М раствор NaOH и 0,5 М раствор H2SO4.
8. Вода дистиллированная.
Порядок выполнения работы
Приготовление растворов.
Приготовить в мерных колбах на 250 мл 1 М раствор NaOH и 0,5 М раствор H2SO4. Точные концентрации полученных растворов определить методом титрования их контрольными растворами (см. л.р. №5 «Приготовление растворов и определение их концентрации методом титрования»). Перед титрованием разбавить исходные растворы в 10 раз.
Лабораторная установка.
Работа выполняется в простейшем калориметре:

|
Рисунок 3. Калориметр: 1 – штатив, 2 – воронка, 3 – термометр, 4 – внешний стакан , 5 – внутренний стакан , 6 – якорь мешалки, 7 – магнитная мешалка.
Реакция нейтрализации является экзотермической реакцией. За счет выделяющейся теплоты нагреваются реакционная смесь и стенки стакана. Если скачок температуры измерить достаточно быстро, то можно пренебречь нагреванием стенок стакана. Для измерения температуры реагентов и реакционной смеси использовать термометр с ценой деления 0,1°С или внешний контактный термометр (сенсор).
Цель работы:
Убедиться в справедливости закона действующих масс и принципа Ле-Шателье. Приобрести навыки измерения объемов растворов и расчета их концентраций, познакомиться с элементами нефелометрического анализа, используемыми в работе.
Теоретическая часть
Скорость химической реакции измеряется изменением концентрации одного из реагирующих веществ в единицу времени. Концентрацию С выражают числом молей в 1 л, время – в секундах. Средняя скорость реакции 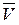 определяется как:
определяется как:
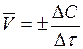 .
.
В самом общем виде при бесконечно малом временном интервале 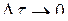 мгновенная истинная скорость V оказывается равной
мгновенная истинная скорость V оказывается равной
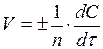 ,
,
где n – стехиометрический коэффициент в уравнении, описывающем данную реакцию.
Таким образом, скорость химической реакции есть первая производная от концентрации по времени.
Скорость реакции зависит от природы реагирующих веществ и от условий протекания реакции – концентрации реагентов, температуры, присутствия катализаторов и некоторых других причин, характерных для гетерогенных процессов (интенсивности перемешивания, степени измельчения и т.п.).
Зависимость скорости реакции от концентрации выражается законом действующих масс, являющимся основным законом химической кинетики: скорость химической реакции в гомогенных системах прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам. Так, при взаимодействии вещества А и В в соответствии с уравнением:
mA + nB = dD,
математическое выражение для скорости реакции имеет вид:
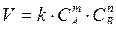 .
.
Убедиться в справедливости этого можно, проделав опыт 1 настоящей работы.
Многие химические реакции обратимы, т.е. протекают в противоположных направлениях, и не идут до конца. В таких реакциях устанавливается подвижное химическое равновесие, когда скорости прямого и обратного процессов становятся равными. Концентрации реагирующих веществ, которые устанавливаются в момент химического равновесия, называются равновесными. Обычно их обозначают при помощи квадратных скобок, т. е. [А] и [В] в отличие от неравновесных концентраций CA и С B в вышеприведенной формуле.
Используя закон действующих масс для химического равновесия, можно рассчитать константу равновесия, равную отношению произведения равновесных концентраций продуктов реакции к произведению, равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам. Так, для системы:
mA + nB ↔ dD
значение константы равновесия будет равным
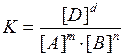
При заданной температуре К – величина постоянная, не зависящая от присутствия катализатора.
Меняя условия протекания реакции (температуру, концентрацию реагентов, давление), можно сместить химическое равновесие. Направление смещения равновесия в общем виде определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать извне какое-либо воздействие, то в системе возникает сдвиг равновесия в сторону процесса, ослабляющего оказанное воздействие. Убедиться в справедливости этого принципа позволяет опыт 2 данной лабораторной работы.
Приборы и реактивы
1. Три конические колбы на 100 мл.
2. Три мерных цилиндра на 10 и 50 мл.
3. Секундомер.
4. Рисунок в виде сетки.
5. Хлорид калия или аммония.
6. Растворы: тиосульфата натрия (0,25 М), серной кислоты (2 н.), хлорида железа (0,0025 н. и насыщенный), роданида калия или аммония (0,0025 н. и насыщенный).
Порядок выполнения работы
Опыт 1
Рассчитайте молярную концентрацию тиосерной кислоты, образующейся при сливании растворов тиосульфата натрия с серной кислотой в колбах 1, 2, 3.
Рассчитайте относительную среднюю скорость реакции в колбах 1, 2, 3.
Постройте график 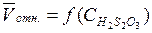 , используя экспериментальные данные. При построении графика следует помнить:
, используя экспериментальные данные. При построении графика следует помнить:
а) график отражает линейную зависимость: 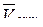 от
от 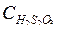 ;
;
б) его нельзя строить по двум экспериментальным точкам;
в) прямая должна проходить через начало координат.
Опыт 2
При взаимодействии растворов хлорида железа (III) и роданида калия происходит реакция, которую можно описать следующим сокращенным ионным уравнением:
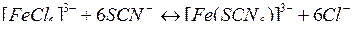
Характерная красная окраска принадлежит в растворе ионам 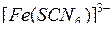 или продуктам их частичного распада. С учетом сказанного сделайте следующее:
или продуктам их частичного распада. С учетом сказанного сделайте следующее:
1. Отметьте, как изменяется интенсивность окраски растворов по сравнению с окраской раствора в контрольной пробирке.
2. Укажите, в каком направлении смещается равновесие при добавлении: а) хлорида железа (III); б) роданида калия, (или аммония); в) хлорида калия (или аммония).
3. Напишите выражение константы равновесия, основываясь на сокращенном ионном уравнении протекающей реакции.
Контрольные вопросы
1. Что подразумевается под понятием «скорость химической реакции»?
2. Закон действующих масс для гомогенных и гетерогенных систем.
3. Принцип Ле-Шателье.
4. Напишите выражения для константы равновесия гетерогенной и гомогенной реакции на любых примерах.
5. Перечислите факторы, влияющие на величину константы скорости реакции.
6. Как изменится скорость прямой и обратной реакции системе С(графит) + СО2(г) ↔ 2СО(г) при повышении давления в 2 раза?
7. Напишите математическое выражение правила Вант-Гоффа, отражающего зависимость скорости реакции от температуры.
8. Что такое катализатор, и какие виды катализа вы знаете?
9. Вычислите, как изменилась скорость реакции между уксусной кислотой и этиловым спиртом при постоянной температуре, если их исходные концентрации составляли 0,7 моль/л, а через некоторое время стали равными0,05 моль/л.
10. Укажите, как нужно изменить температуру, давление и концентрацию реагентов, чтобы увеличить выход хлора в системе: 4HCl(г) + O2(г) ↔2H2O(г) + Cl2(г),  .
.
Цель работы
Выработать навыки работы с типичными окислителями и восстановителями. Изучить условия проведения окислительно-восстановительных реакций и научиться составлять уравнения окислительно-восстановительных реакций электронно-ионным методом с использованием полуреакций.
Теоретическая часть
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислением называется процесс отдачи атомом, молекулой или ионом электронов, степень окисления при этом повышается:
Al – 3e- = Al 3+
Fe2+ – e- = Fe3+
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается:
S + 2e- = S2-
Cl2 + 2e- = 2Cl-
Fe3+ + e- = Fe2+
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
Важнейшие восстановители:
1. простые вещества – все металлы и некоторые неметаллы, например, Н2, С, Si, Р4 и др.;
2. водородные соединения щелочных и щелочноземельных металлов, а также водородные соединения некоторых неметаллов, например: HI, HBr, H2O2, H2S, H2Se, H2Te, NH3, PH3, AsH3, SbH3, SiH4, SnH4;
3. оксиды элементов, атомы которых находятся в промежуточной степени окисления. Это оксиды ряда неметаллов – СО, SO2, NO, P2O3, а также низшие оксиды некоторых р- и d-элементов – SnO, FeO, CrO, VO и соответствующие им соли, например, SnCl2, FeSO4 и др.;
4. некоторые кислородсодержащие кислоты и их соли, в состав которых входят атомы элементов в промежуточных степенях окисления, например, H2SO3, H3PO2, Н3РО3 и их соли, а также тиосульфаты (Na2S2O3), дисульфиты (Na2S2O5), дитиониты (Na2S2O4), нитриты;
5. некоторые органические вещества, например, спирты, альдегиды, некоторые карбоновые кислоты (Н-СООН, НООС-СООН), углеводы (С6Н12О6).
Важнейшие окислители:
1. простые вещества – галогены, озон, кислород, сера;
2. оксиды некоторых р- и d-элементов в высоких степенях окисления, например, С l2О7, ClO2, I2O5, SO3, SeO3, SeO2, N2O5, NO2, PbO2, Mn2O7, MnO2, CrO3, V2O5;
3. Кислородсодержащие кислоты некоторых р- и d-элементов в высоких степенях окисления, например, НС lO3, Н5IO6, Н IO3, НВ rO4, НВ rO3, H2SO4, H2SeO4, H2SeO3, HNO3, H2CrO4, H2Cr2O7, HMnO4 и соли этих кислот. К окислителям относятся также кислородсодержащие кислоты галогенов, в которых они проявляют и более низкие степени окисления, например, НС l+1О, НС l+3О2, а также их соли;
4. пероксид водорода Н2О2, пероксиды щелочных и щелочноземельных металлов (Na2O2, BaO2).
Классификация окислительно-восстановительных реакций.
1. Классификация по содержанию восстановителя и окислителя в одном или в нескольких исходных веществах:
а) если восстановитель и окислитель содержатся в одном исходном веществе, то ОВР относится к реакциям внутримолекулярного окисления-восстановления, например:
(N–3Н4)2С r2+6О7 → N2 + С r+32О3 + NH3 + Н2О.
В данной реакции окислитель (С r+6) и восстановитель (N-3) содержатся в одном веществе;
б) если восстановитель и окислитель содержатся в разных исходных веществах, то ОВР относится к реакциям межмолекулярного окисления-восстановления, например:
N-3Н3 + КС l+5О3 → N2° + КС l– + Н2О.
В этой реакции окислитель (С l+ ) и восстановитель (N–3 ) находятся в разных веществах.
2. Классификация по характеру изменения степени окисления атомов одного элемента:
а) если в исходном веществе атомы элемента находятся в одной степени окисления, а в продуктах реакции в двух других (более высокой и более низкой по отношению к исходной степени окисления), то соответствующие ОВР относятся к реакциям диспропорционирования или дисмутации, например:
N+4O2 + Н2О → HN+5O3 + HN+3O2;
б) если в исходных веществах один и тот же элемент находится в двух разных степенях окисления, а в продукте реакции только в одной (промежуточной по отношению к исходным степеням окисления), то соответствующие ОВР относятся к реакциям конпропорционирования или конмутации, например:
H2S–2 + H2S+6О4 (конц.) → S+4О2 + Н2О
Правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Также и сумма зарядов исходных веществ должна быть равна сумме зарядов продуктов реакции. Для правильного составления уравнений реакций необходимо знать степени окисления. Степень окисления элемента в соединении определяется как число электронов, смещённых от атома данного элемента к другим атомам (при положительной окисленности) или от других атомов к атому данного элемента (при отрицательной окисленности).
Для вычисления степени окисления элемента следует исходить из следующих положений:
1. степень окисления элемента в простых веществах равна 0;
2. алгебраическая сумма степеней окисления атомов, входящих в состав молекулы, равна 0, в состав иона – его заряду;
3. постоянную степень окисления (+1) в соединениях проявляют металлы I А подгруппы (щелочные металлы);
4. постоянную степень окисления (+2) в соединениях проявляют металлы II А подгруппы (щелочноземельные металлы и бериллий);
5. постоянную степень окисления (+3) в соединениях проявляет алюминий
6. водород проявляет степень окисления +1, кроме гидридов металлов ( NaH , CaH 2 и т.п.), в которых водород имеет степень окисления -1;
7. степень окисления кислорода в соединениях -2, за исключением пероксидов (-1) и фторида кислорода OF 2 (+2).
8. степень окисления фтора в соединениях и галогенов в галогенидах ( NaCl , CaBr 2 , HI и т.п.)) ( -1 )/
Применяют два метода составления уравнения реакций: электронного баланса и полуреакций.
Метод электронного баланса.
Этот метод основан на сравнении степени окисления атомов в исходных и конечных веществах. Основное требование состоит в том, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Надо также знать, какие вещества образуются в результате реакции.
Пример 1. Методом электронного баланса расставить коэффициенты в уравнении реакции, протекающей по схеме:
Н2О–12 + K2Cr+62O7 + H2SO4 → O°2 + Cr+32(SO4)3 + K2SO4 + Н2О
Решение:
1 Данная ОВР относится к реакциям межмолекулярного окисления-восстановления, поэтому расстановку коэффициентов проводим слева направо.
2. Определяем элементы, атомы которых в ходе реакции изменили степень окисления. В данном случае это кислород в пероксиде и хром в хромате. Кислород изменил степень окисления от –1 до 0, а хром от +6 до +3.
3. Записываем электронные уравнения процессов окисления и восстановления. В этих уравнениях число атомов каждого элемента равно их числу в формулах соответствующих исходных веществ. Находим наименьшее общее кратное числа отданных и числа принятых электронов и составляем схему электронного баланса:
2O–1 – 2e– → O20 6 3 O–1 – восстановитель, окисляется
2Cr+6 + 6e– → 2Cr+3 2 1 Cr+3 – окислитель, восстанавливается
4. Находим число атомов кислорода и хрома, умножив каждое из уравнений на соответствующий множитель (первое уравнение на 3, второе на 1). Получаем число атомов кислорода, изменивших степень окисления, которое равно 2∙3 = 6, а число атомов хрома равно 2∙1=2.
5. Расстановку коэффициентов проводим в следующем порядке:
а) уравниваем числа атомов хрома, поставив перед формулами К2С r О7 и Cr2(SO4)3 коэффициент «1»;
б) уравниваем числа атомов кислорода, изменивших степень окисления, поставив перед формулами О2 и Н2О2 коэффициенты «3»;
в) уравниваем числа атомов калия, поставив перед формулой K2SO4 коэффициент «1»;
г) уравниваем числа кислотных остатков SO4–2, поставив перед формулой серной кислоты коэффициент «4»;
д) уравниваем числа атомов водорода, поставив перед формулой воды коэффициент «7»;
е) проверяем, одинаковы ли числа атомов кислорода в левой и правой частях уравнения:
3Н2О2 + К2С r2О7 + 4H2SO4 = 3О2 + Cr2(SO4)3 + K2SO4 + 7Н2О
Пример 2. Методом электронного баланса расставить коэффициенты в уравнении реакции:
F е+3(N+5О3–2)3 → Fe2+3O3 + N+4O2 + О°2
Решение:
2. Данная ОВР относится к реакциям внутримолекулярного окисления-восстановления, поэтому расстановку коэффициентов проводим справа налево.
3. Определяем элементы, атомы которых изменили степень окисления. В данном случае это азот и кислород. Азот изменил степень окисления от +5 до +4, кислород от –2 до 0.
4. Записываем электронные уравнения процессов окисления и восстановления. В этих уравнениях число атомов каждого элемента равно их числу в формулах продуктов реакции. Находим наименьшее общее кратное числа отданных и принятых электронов и составляем схему электронного баланса:
2O–2 – 4e– → O20 6 3 O–2 – восстановитель, окисляется
N+5 + 1e– → 2N+4 2 1 N+5 – окислитель, восстанавливается
5. Находим число атомов азота и кислорода, умножив каждое из электронных уравнений на соответствующий множитель: первое уравнение умножаем на 1, второе на 4. Получаем, что число атомов кислорода, изменивших степень окисления, равно 2∙1 = 2, а соответствующее число атомов азота равно 1∙4 = 4. Но поскольку в формульной единице Fе(NО3)3 содержится 3 атома азота, перед данной формулой придется поставить дробный коэффициент 4/3, что не совсем удобно. Поэтому для избавления от дробного коэффициента найденные числа атомов азота и кислорода умножим на 3. Получается, что степень окисления изменилась у 6 атомов кислорода и у 12 атомов азота.
6. Расстановку коэффициентов проводим в следующей последовательности:
а) уравниваем числа атомов азота, поставив перед формулой F е(N О3)3 коэффициент «4», а перед формулой NO2 – коэффициент «12»;
б) уравниваем числа атомов железа, поставив перед формулой Fe2O3 коэффициент «2»;
в) уравниваем число атомов кислорода, поставив перед формулой О3 коэффициент «3».
6. Проверяем, одинаково ли общее число атомов кислорода в левой и правой частях уравнения:
4F е+3(N+5О3–2)3 → 2Fe2+3O3 + 12N+4O2 + 3О°2
Метод полуреакций.
При составлении уравнений методом полуреакций следует учитывать следующие факторы:
1. записывать в ионном виде восстановитель, окислитель и продукты их взаимодействия, а затем уже приступать к составлению уравнений полуреакций. Сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы – в виде молекул;
2. если исходное вещество содержит больше кислорода, чем продукт реакции, то освобождающийся кислород связывается в кислых растворах с ионом Н+ в воду, а в нейтральных растворах в гидроксид-ионы;
3. если вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул Н2О:
Н2О = О–2 + 2Н+
а в щелочных за счёт гидроксид-ионов:
2ОН– = О–2 + Н2О
г) должны быть равны суммарное число и знак электрических зарядов слева и справа от знака равенства.
Реакции окисления-восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Схематически эти изменения можно представить так:


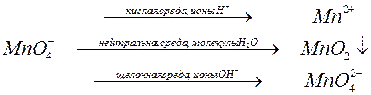
Пример 1. Используя метод полуреакций, расставьте коэффициенты в уравнениях:
1) KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
2) KMnO4 + Na2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
3) KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH
Решение.
1. При использовании метода полуреакций поступаем следующим образом:
а) Составляем схему реакции в ионном виде (при этом слабые электролиты и труднорастворимые вещества записываем в виде молекул):
MnO4- + SO32- + OH- → MnO42- + SO42- + H2O.
б) Составляем схему процесса окисления (отдача электронов):
SO32- → SO42-
и далее рассуждаем следующим образом: уравнение – это равенство обеих частей во всех отношениях – и в отношении качества и количества элементов, и в отношении электрических зарядов. Вначале уравниваем обе части по элементам. Для того, чтобы уравнять кислород, необходимо учесть среду реакции: среда щелочная и водная, следовательно, для уравнивания кислорода в нашем распоряжении имеются две кислородсодержащие частицы ОН- и H2O. Поскольку в левой части будущего уравнения пока что меньше атомов кислорода, то в левую часть надо внести более богатую кислородом частицу, т.е. ион OH-, а в правую – менее богатую кислородом молекулу H2O. Нетрудно понять, что коэффициенты при этих частицах будут равны соответственно 2 и 1:
SO32- + 2OH- → SO42- + H2O .
Элементы уравнены. Приступаем к уравниванию электрических зарядов с помощью электронов. Заряд правой части равен -2, а левой -4, следовательно, от левой части необходимо отнять 2 электрона (т.к. заряд электрона равен -1):
SO32- + 2OH- - 2е- → SO42- + H2O .
в) Составляем схему процесса восстановления (присоединения электронов):
MnO4– → MnO42-
рассуждая аналогично предыдущему, находим, что к левой части необходимо прибавить 1 электрон:
MnO4– + е- → MnO42-.
г) Подводим баланс числу отданных и присоединённых электронов:
SO32- + 2OH- - 2е- = SO42- + H2O 1
MnO4- + е- = MnO42- 2
2MnO4- + SO32- + 2OH- = 2MnO42- + SO42- + H2O.
д) составляем молекулярное уравнение реакции (добавляя соответствующие противоионы):
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2) Вторая реакция осуществляется в кислой среде, следовательно, при составлении уравнений полуреакций можно использовать в левой части как ион Н+, так и молекулы Н2О.
а) Схема процесса окисления такова:
SO32- → SO42-.
Поскольку в левой части не хватает одного моля кислорода, прибавляем к ней 1 моль Н2О, тогда в правой части появятся 2 моля Н+:
SO32- + H2O → SO42- + 2Н+
Заряд правой части равен 0. Для того, чтобы заряд левой части стал также равен 0 (пока он равен -2), необходимо от левой части отнять 2 электрона:
SO32- + H2O – 2е- → SO42- + 2Н+.
б) Схема процесса восстановления такова:
MnO4- → Mn2+
поскольку в левой части в избытке 4 моль кислорода, прибавим к ней 8 моль Н+, которые свяжут кислород в молекулы воды, и тогда в правой части 4 моль H2O:
MnO4- + 8Н+ → Mn2+ + 4H2O
Заряд правой части равен +2, левой +7, поэтому к левой части нужно прибавить 5 электронов, после чего заряд левой части также станет равным +2:
MnO4- + 8Н+ + 5е- → Mn2+ + 4H2O .
в) Подводим баланс числу отданных и принятых электронов и составляем уравнение реакции в ионном виде:
SO32- + H2O – 2е- → SO42- + 2Н+ 5
MnO4- + 8Н+ + 5е- → Mn2+ + 4H2O 2
2MnO4- + 5SO32- + 6Н+ = 2Mn2+ + 5SO42- + 3H2O.
г) Добавляя соответствующие противоионы, составляем молекулярное уравнение реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
3) Третья реакция осуществляется в нейтральной среде, следовательно, при составлении уравнений полуреакций к левой части можно добавлять только молекулы воды (а в правой части за счёт этого могут образовываться как Н+, так и OH- — ионы).
а) Схема процесса окисления такова:
SO32- → SO42-
добавляем к левой части 1 моль H2O, тогда в правой части появляются 2 моль Н+:
SO32- + Н2О → SO42- + 2Н+.
Для того, чтобы сделать заряд правой части равным заряду левой, отнимаем от левой части 2 электрона:
SO32- + Н2О – 2е- → SO42- + 2Н+.
б) Схема процесса восстановления такова:
MnO4- → MnO2,
для того, чтобы уравнять кислород, добавляем к левой части 2 моль H2O, тогда в правой части появляются 4 моль OH-:
MnO4- + 2H2O → MnO2 + 4OH-.
Заряд правой части равен -4, а левой -1, поэтому к левой части прибавляем 3 электрона:
MnO4- + 2H2O + 3е- → MnO2 + 4OH-.
в) Составляем уравнение в ионном виде:
SO32- + Н2О – 2е- → SO42- + 2Н+ 3
MnO4- + 2H2O + 3е- → MnO2 + 4OH- 2
2MnO4- + 3SO32- + 7H2O = 2MnO2 + 3SO42- + 6Н+ + 8OH-
2MnO4- + 3SO32- + H2O = 2MnO2 + 3SO42- + 2OH-.
г) Составляем молекулярное уравнение реакции:
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH.
Необходимо отметить, что при составлении окислительно-восстановительных реакций, протекающих в растворах, следует отдавать предпочтение методу полуреакций, который оперирует реально существующими ионами, находящимися в данном растворе, и обязательно учитывает среду реакции. Кроме того, метод полуреакций оказывается совершенно необходимым при нахождении табличных значений стандартных электродных потенциалов φº (см. приложение) для расчёта ЭДС гальванических элементов и определения направления окислительно-восстановительных реакций.
Приборы и реактивы
1. Пробирки.
2. Стеклянная палочка.
3. Тигель.
4. Фарфоровая чашечка.
5. Спиртовка.
6. Цинк (порошок).
7. Сера (порошок).
8. Дихромат аммония.
9. Сульфит натрия.
10. Нитрит калия.
11. Растворы: аммиака (25%-ный), соляной кислоты (2 н.), иодида калия (0,5 н.), дихромата калия (0,5 н.), серной кислоты (2 н.), сульфата меди (0,5 н.), гидроксида калия или натрия (2 н.), перманганата калия (0,5 н.), сульфида натрия (0,5 н.), пероксида водорода (3%-ный).
12. Хлорная и бромная вода.
13. Дистиллированная вода.
Порядок выполнения работы
Экспериментальная часть
Цель работы (определяется общая задача, стоящая перед экспериментатором).
1. Наименование первого опыта
1.1. Краткое описание хода опыта (условия его проведения, основные вещества, уравнение реакции и т.д.). Данные опыта (результаты наблюдений, измерений, оформление таблиц).
1.2. Расчет и анализ полученных результатов с использованием теоретических положений, законов по данному вопросу (построение графиков).
1.3. Вывод (краткое обобщение полученных результатов в соответствии с наименованием опыта).
Все последующие опыты описываются по указанной схеме, например, второй опыт — 2, 2.1., 2.2. и т.д.
Приложения
Приложение 1. Стандартные окислительно-восстановительные потенциалы
E ° – Стандартный окислительно-восстановительный потенциалы, В
«к» – кислотная среда; «н» – нейтральная среда; «щ» – щелочная среда;
«Ох» – окисленная форма; «Red» – восстановленная форма
| Ox/Red | E° , среда |
| Ag+ / Ag | +0,80 к |
| [Ag(CN)2]- / Ag, CN- | -0,43 щ |
| Al3+/ Al | -1,70 к |
| Al(OH)3 / Al | -1,49 н (pH=6) |
| [Al(OH)4]- / Al | -2,34 щ |
| At2 / At- | +0,20 к, щ |
| Au3+ / Au | +1,50 к |
| [Au(CN)2]- / Au, CN- | -0,76 щ |
| Be2+ / Be | -1,85 к |
| [Be(OH)4]2- / Be | -2,52 щ |
| Bi3+ / Bi | +0,32 к |
| Bi(OH)3 / Bi | -0,38 щ |
| Br2 / Br- | +1,09 к, щ |
| BrO- / Br2 | +0,43 щ |
| BrO3 -/ Br2 | +1,51 к |
| BrO3- / Br2 | +0,52 щ |
| CH3CHO/ C2H5OH | +0,19 к |
| CO2 / H2C2O4 | - 0,47 к |
| Ca2+/ Ca | - 2,86 к |
| Cd2+/ Cd | - 0,40 к |
| Cl2 / Cl- | +1,40 к, щ |
| ClO- / Cl2 | +0,48 щ |
| ClO- / Cl2 | +2,14 к |
| ClO3- / ClO- | +0,48 щ |
| ClO3- / Cl2 | +0,48 щ |
| ClO3- / Cl2 | +1,47 к |
| ClO4- / ClO3- | +1,19 к |
| Co3+ / Co2+ | +1,38 к |
| CoO(OH) / Co(OH)2 | +0,19 щ |
| Cr3+ / Cr2+ | -0,41 к |
| Cr(OH)3 / Cr(OH)2 | -1,18 щ |
| CrO42- / [Cr(OH)6]3- | -0,17 щ |
| Ox/Red | E° , среда |
| Cr2O72- / Cr3+ | +1,33 к |
| Cu2+/ Cu | +0,34 к |
| Cu2+ / Cu2O | +0,21 к |
| Cu2+, Br- / CuBr | +0,66 к |
| Cu2+, CN- / [Cu(CN)2]- | +1,11 щ |
| Cu2+, Cl- / CuCl | +0,55 к |
| Cu2+, Cl- / [CuCl2]- | +0,49 к |
| Cu2+, I- / CuI | +0,86 к |
| Cu2+, I- / [CuI2]- | +0,69 к |
| [Cu(NH3)2]+ / Cu, NH3 | -0,12 щ |
| [Cu(NH3)4]2+ / Cu, NH3 | -0,07 щ |
| Cu2O / Cu | +0,47 к |
| Cu2O / Cu | -0,37 щ |
| Fe2+ / Fe | -0,44 к |
| Fe3+ / Fe2+ | +0,77 к |
| FeO(OH) / Fe(OH)2 | -0,67 щ |
| F2 / F- | +2,87 щ |
| F2 / HF | +3,09 к |
| H+ / H2 | ± 0,00 к |
| H+ / H2 | -0,42 н (pH=7) |
| H2O / H2 | -0,83 щ |
| H2, Ca2+ / CaH2 | -2,16 к |
| HBrO / Br2 | +1,57 к |
| HClO / Cl2 | +1,63 к |
| HO2- / OH- | +0,88 щ |
| H2O2 / H2O | +1,76 к |
| H2O2 / OH- | +0,94 щ |
| H3PO4 / H(PH2O2) | -0,39 к |
| H3PO4 / H2(PHO3) | -0,28 к |
| H3PO4 / P | -0,38 к |
| HSO3- / S | +0,48 к |
| Hg2+/ Hg | +0,85 к |
| HgCl2 / Hg2Cl2, Cl- | +0,66 к |
| Hg2Cl2 / Hg, Cl- | +0,27 к |
| [HgI4]2- /Hg, I- | -0,04 к |
| [I(I)2]- / I- | +0,54 к, щ |
| I2 / I- | +0,54 к, щ |
| IO3- / I- | +1,08 к |
| IO3- / I- | +0,25 щ |
| Ox/Red | E° , среда |
| IO3- / I2 | +1,19 к |
| IO3- / I2 | +0,20 щ |
| Mg2+/ Mg | -2,37 к |
| Mg(OH)2 / Mg | -2,69 щ |
| MnO(OH)/Mn(OH)2 | +0,17 щ |
| MnO2 / Mn2+ | +1,24 к |
| MnO4- / MnO2 | +0,62 н (pH=8) |
| MnO4- / MnO2 | +1,73 н (pH=6) |
| MnO4- / MnO42- | +0,56 щ |
| MnO4- / Mn2+ | +1,53 к |
| N2 / NH4+ | +0,27 к |
| N2 / N2H5+ | -0,23 к |
| N2 / NH3 . H2O | -0,74 щ |
| N2 / N2H4 . H2O | -1,12 щ |
| N2 / NH3OH+ | -1,87 к |
| N2 / NH2OH . H2O | -3,04 щ |
| NO2- / NO | +1,20 к |
| NO2- / NO | -0,45 щ |
| NO2- / N2O | +0,16 щ |
| NO3- / HNO2 | +0,93 к |
| NO3- / NO2- | +0,01 щ |
| NO3- / NH3 . H2O | -0,12 щ |
| NO3- / NH4+ | +0,88 к |
| NO3- / NO | +0,96 к |
| NO3- / NO2 | +0,77 к |
| Na+/ Na | -2,71 к, щ |
| Na2O2 / H2O, Na+ | +2,86 к |
| Na2O2 / OH- , Na+ | +1,20 щ |
| NaBiO3 /Bi(OH)3, Na+ | +0,37 щ |
| NaBiO3 / Bi3+, Na+ | +1,81 к |
| Ni2+ / Ni | -0,23 к |
| NiO(OH) / Ni2+ | +2,25 к |
| NiO(OH) / Ni(OH)2 | +0,78 щ |
| O2 / HO2- | -0,08 щ |
| O2 / H2O | +1,23 к |
| O2 / H2O2 | +0,69 к |
| O2 / H2O2 | -0,13 щ |
| Pb2+ / Pb | -0,13 к |
| PbO2 / Pb2+ | +1,46 к |
| Ox/Red | E° , среда |
| PbO2 / [Pb(OH)3]- | +0,19 щ |
| (Pb2IIPbIV)O4 / Pb2+ | +2,16 к |
| S / H2S | +0,14 к |
| S / S2- | -0,44 щ |
| SO2 / S | +0,45 к |
| SO2 / SO3S2- | +0,39 к |
| SO32- / S | -0,66 щ |
| SO32- / S | +0,58 к |
| SO32- / SO3S2- | -0,59 щ |
| SO42- / H2S | +0,31 к |
| SO42- / S | +0,35 к |
| SO42- / S | -0,75 щ |
| SO42- / S2- | +0,15 к |
| SO42- / S2- | -0,67 щ |
| SO42- / SO2 | +0,16 к |
| SO42- / SO2 | -1,50 щ |
| SO42- / SO32- | -0,93 щ |
| SO42- / SO32- | -0,10 к |
| SO42- / SO3S2- | +0,28 к |
| SO42- , Cu2+ / CuS | +0,42 к |
| SO42- , Fe3+ / FeS | +0,33 к |
| S4O62- / SO3S2- | +0,02 н |
| S2O6(O2)2- / SO42- | +1,96 к |
| SO3S2- / S | +0,51 к |
| Sn2+/ Sn | -0,14 к |
| [SnCl3]- / Sn, Cl- | -0,20 к |
| [SnCl6]2- / [SnCl3]- | +0,14 к |
| SnO2/ Sn | -0,12 к |
| [Sn(OH)3]- / Sn | -0,90 щ |
| [Sn(OH)6]2- / [Sn(OH)3]- | -0,96щ |
| Tl3+ / Tl+ | +1,28 к |
| Zn2+ / Zn | -0,76 к |
| [Zn(NH3)4]2+ / Zn, NH3 | -1,03щ |
| [Zn(OH)4]2- / Zn | -1,26 щ |
Приложение 2. Растворимость солей и оснований в воде
| Ионы | Br- | СH3СОО- | CN- | СО32- | Cl- | F- | I- | NO3- | ОН- | РО43- | S2- | SO42- |
| Ag+ | H | M | H | H | H | P | H | Р | — | H | H | M |
| А13+ | P | + | ? | — | P | M | P | P | H | H | + | P |
| Bi3+ | + | + | — | — | + | H | H | + | H | H | H | + |
| Cd2+ | P | P | M | H* | P | P | P | P | H | H | H | P |
| Co2+ | P | P | H | H* | P | P | P | P | H | H | H | P |
| Cr3+ | P | + | H | — | P | M | H | P | H | H | H* | P |
| Cu2+ | P | P | H | H* | P | P | — | P | H | H | H | P |
| Fe2+ | P | P | H | H | P | M | P | P | H | H | И | P |
| Fe3+ | P | — | H | — | P | H | — | P | H | H | + | P |
| Hg2+ | M | P | P | — | P | + | H | + | — | H | Н | + |
| Hg22+ | H | M | — | H | H | M | H | + | — | H | — | H |
| Mg2+ | P | P | P | M | P | M | P | P | H | H | H | Р |
| Mn2+ | P | P | H | H* | P | P | P | P | H | H | H | P |
| NH4+ | P | P | P | P | P | P | P | P | P | P | — | Р |
| Ni2+ | P | P | H | H* | P | P | P | P | H | H | H | Р |
| Pb2+ | M | P | H | H* | M | M | M | P | H | H | H | H |
| Sn2+ | + | + | — | — | + | P | M | + | H | H | H | + |
| Zn2+ | P | P | H | H* | P | M | P | P | Н | H | H | Р |
р – хорошо растворимый;
м – малорастворимый;
н – практически нерастворимый;
+ –полностью реагирует с водой;
— – не существует;
? – отсутствуют данные по растворимости;
* – осадок из водного раствора не образуется вследствие полного гидролиза.
Группы элементов
I
II
III
IV
V
I
H 1
водород
II
Li 3
6,9412
литий
Be 4
9,01218
бериллий
B 5
10,812
бор
С 6
12,0108
углерод
N 7
14,0067
азот
III
Na 11
22,98977
натрий
Mg 12
24,305
магний
Al 13
26,98154
алюминий
Si 14
28,086
кремний
P 15
30,97376
фосфор
IV
K 19
39,0983
калий
Ca 20
40,08
кальций
Sc 21
44,9559
скандий
Ti 22
47,90
титан
V 23
50,9415
ванадий
Cu 29
63,546
медь
Zn 30
65,38
цинк
Ga 31
69,72
галлий
Ge 32
72,59
германий
As 33
74,9216
мышьяк
V
Rb 37
85,4678
рубидий
Sr 38
87,62
стронций
Y 39
88,9059
иттрий
Zr 40
91,22
цирконий
Nb 41
92,9064
ниобий
Ag 47
107,868
серебро
Cd 48
112,41
кадмий
In 49
114,82
индий
Sn 50
118,69
олово
Sb 51
121,75
сурьма
VI
Cs 55
132,9054
цезий
Ba 56
137,33
барий
La* 57
138,9
лантан ×
Hf 72
178,49
гафний
Ta 73
180,9479
тантал
Au 79
196,9665
золото
Hg 80
200,59
ртуть
Tl 81
204,37
таллий
Pb 82
207,2
свинец
Bi 83
208,9
висмут
VII
Fr 87
223
франций
Ra 88
226,0
радий
Ac** 89
227
актиний ××
Rf 104
261
резерфордий
Db 105
262
дубний
Rg 111
рентгений
112
285
114
289
Лантаноиды* и Актиноиды**
Ce 58
140,1
церий
Pr 59
140,9
празеодим
Pm 61
145
прометий
Sm 62
150,4
самарий
Eu 63
151,9
европий
Gd 64
157,3
гадолиний
Th 90
232,0
торий
Pa 91
231,0
протактиний
Np 93
237
нептуний
Pu 94
244
плутоний
Am 95
243
америций
Cm 96
247
кюрий
| VI | VII | VIII | |||||||||
|
| 2 He 4,002602 | ||||||||||
| O 8 кислород | F 9 фтор | 10 Ne | |||||||||
| S 16 32,06 сера | Cl 17 35,453 хлор | 18 Ar | |||||||||
| Cr 24 51,996 хром | Mn 25 54,9380 марганец | Fe 26 55,847 железо | Co 27 58,9332 кобальт | Ni 28 58,70 никель | |||||||
| Se 34 78,96 селен | Br 35 79,904 бром | 36 Kr | |||||||||
| Mo 42 95,94 молибден | Tc 43 98,9062 технеций | Ru 44 101,07 рутений | Rh 45 102,9055 родий | Pd 46 106,4 палладий | |||||||
| Te 52 127,60 теллур | I 53 126,9045 иод | 54 Xe | |||||||||
| W 74 183,85 вольфрам | Re 75 186,207 рений | Os 76 190,2 осмий | Ir 77 192,22 иридий | Pt 78 195,09 платина | |||||||
| Po 84 209 полоний | At 85 210 астат | 86 Rn | |||||||||
| Sg 106 266 сиборгий | Bh 107 269 борий | Hs 108 269 хассий | Mt 109 268 мейтнерий | Ds 110 271 дармштадтий | |||||||
|
|
|
| |||||||||
|
| |||||||||||
| 65 Tb 158,9 тербий | 66 Dy | 67 Ho гольмий | 68 Er 167,3 эрбий | 69 Tm тулий | 70 Yb иттербий | 71 Lu 174,9 лютеций | |||||
| 97 Bk 247 берклий | 98 Cf | 99 Es | 100 Fm 257 фермий | 101 Md | 102 No нобелий | 103 Lr 262 лоу-ренсий | |||||
Учебное издание
Крахт Людмила Николаевна
Здарова Евгения Романовна
Полева Елена Александровна
Общая химия. Лабораторный практикум.
Технический редактор: Иванова Н.И.
Компьютерный набор: Чичварин А.В.
Корректор: Иванова Н.И.
Бумага для множительной техники
Подписано к печати
Формат Усл. печ. л.
Тираж экз. Заказ №
Отпечатано с авторского оригинала в редакционно-издательском отделе
СТИ НИТУ «МИСиС»
Старый Оскол, микрорайон Макаренко 42
Кафедра физики и химии
Чичварин А.В., Крахт Л.Н.
Полева Е.А., Здарова Е.Р.
ОБЩАЯ ХИМИЯ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Одобрено научно-методическим советом
СТИ НИТУ «МИСиС»
для студентов, обучающихся по направлению:
13.03.01 – «Теплоэнергетика и теплотехника»
22.03.02– «Металлургия»
Старый Оскол
2018
 |
УДК 541.1
ББК 24.5
Рецензенты:
Игуменова Т.И., к.т.н., доцент кафедры ХХТОС и ПП Воронежского государственного университета инженерных технологий.
Кравцова О.С., к.т.н., доцент кафедры физики и химии СТИ НИТУ МИСиС.
Чичварин А.В., Крахт Л.Н., Полева Е.А., Здарова Е.Р.: Общая химия. Лабораторный практикум. Старый Оскол 2018. –84 с.
Лабораторный практикум содержит необходимую информацию для успешного усвоения учебного курса по общей химии.
В пособии подробно рассмотрены теоретические и практические основы проведения лабораторных работ, при выполнении которых студенты осваивают технику обращения с химическими реактивами и приспособлениями, приемы проведения химических операций, методы обработки опытных данных, учатся сопоставлять и анализировать результаты опытов и делать выводы.
Практикум составлен в соответствии с требованиями к обязательному минимуму содержания дисциплины «Общая химия», входящей в основную образовательную программу подготовки специалистов по специальностям государственных образовательных стандартов высшего профессионального образования.
© Чичварин А.В., Крахт Л.Н. Полева Е.А., Здарова Е.Р.
© СТИ НИТУ «МИСиС»
Содержание
Предисловие. 4
1. Основные классы неорганических веществ. 5
2. Установление формулы кристаллогидрата. 15
3. Определение молярной массы углекислого газа. 18
4. Определение эквивалентной и атомной массы металла. 23
5. Приготовление растворов и определение их концентрации. 30
6. Определение рН-раствора. 38
7. Гидролиз солей........................................................................................... 46
8. Тепловой эффект реакции нейтрализации. 51
9. Скорость химической реакции и равновесие. 58
10. Окислительно-восстановительные реакции. 63
Рекомендуемая литература. 75
Общие требования к составлению отчета по лабораторным работам.. 76
Приложения. 77
Приложение 1. Стандартные окислительно-восстановительные потенциалы.. 77
Приложение 2. Растворимость солей и оснований в воде. 81
Предисловие
Лабораторный практикум по общей химии имеет целью ознакомить студентов первого курса с основными методами проведения лабораторных работ.
Перед началом работы в лаборатории общей и неорганической химии студенты должны обязательно изучить «Инструкцию по технике безопасности» и взять на себя обязательства неукоснительно ей следовать, о чем делается запись в «Журнале по технике безопасности».
Лабораторные работы являются одной их важнейших составных частей курса химии. Для их выполнения студенты должны ознакомиться с лабораторным оборудованием, измерительными приборами, правилами техники безопасности. Лабораторные занятия при изучении химии в вузе преследуют две основные цели: 1) подтверждение экспериментом теоретических положений и законов; 2) обучение навыкам проведения лабораторных работ, при выполнении которых студенты осваивают технику обращения с химическими реактивами и приспособлениями, приемы проведения химических операций, методы обработки опытных данных, учатся сопоставлять и анализировать результаты опытов и делать выводы.
Классический лабораторный практикум по химии носит в основном иллюстративный характер: в лабораторных опытах студенты находят подтверждение тех закономерностей, которые изучают на лекциях и на практических занятиях. Для облегчения усвоения материала в каждой работе приводится достаточно подробное теоретическое описание изучаемого вопроса, в конце – перечень контрольных вопросов, которые, как правило, задает преподаватель при приеме отчета по данной лабораторной работе. Таблицы, необходимые практически для каждой лабораторной работы даются в приложении.
Все работы выполняют индивидуально, каждый оформляет отчет по своим результатам. При оформлении отчета записывают дату, номер, название работы и опыта, краткий конспект теоретического материала, краткое описание хода работы, наблюдение и результаты, полученные при его выполнении.
Основные классы неорганических веществ
Цель работы:
Получение и исследование свойств наиболее распространенных простых веществ и соединений.
Теоретическая часть
Вещества подразделяются на простые и сложные. Простые вещества состоят из атомов одного химического элемента, а сложные – из атомов различных элементов. Сложные вещества называются химическими соединениями.
Простые вещества подразделяются на металлы и неметаллы. К неметаллам относятся вещества, образованные атомами двадцати двух химических элементов: водорода, благородных газов, галогенов, кислорода, серы, селена, теллура, азота, фосфора, мышьяка, углерода, кремния, бора. Все остальные химические элементы и их простые вещества – металлы.
Металлы в химических реакциях только отдают электроны, то есть являются восстановителями, поэтому в соединениях их атомы находятся только в положительных степенях окисления. Неметаллы в реакциях могут принимать и отдавать электроны, т.е. вести себя и как окислители, и как восстановители, поэтому степени окисления неметаллов в соединениях могут быть как отрицательными, так и положительными.
Сложные вещества (химические соединения) очень многочисленны и разнообразны по составу и свойствам. Изучение веществ облегчает их классификация, так как, зная особенности класса соединений, можно охарактеризовать свойства их отдельных представителей.
Основными классами неорганических соединений являются оксиды, гидроксиды и соли.
Оксидами называют соединения химических элементов с кислородом. По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие или безразличные (СО, NO, N2O). Солеобразующие оксиды, в свою очередь, подразделяются на основные (Na2O, CaO, FeO и др.), кислотные (SO2, SO3, SiO2, CO2 и т.д.) и амфотерные (ZnO, Al2O3 Сr2O3, SnO и др.). Также выделяют двойные и смешанные оксиды, пероксиды, надпероксиды, озониды.
Гидроксидами являются соединения солеобразующих оксидов с водой. По типу и продуктам электролитической диссоциации в водных растворах и по химическим свойствам гидроксиды подразделяются на основания (NaOH, КOH, Mg(OH)2, Ba(OH)2, Fe(OH)3 и др.), кислоты (H2SO3, H2SO4, HNO3, H3РO4, HСlO4 и др.) и амфотерные гидроксиды, или амфолиты (Be(OH)2, Zn(OH)2, Sn(OH)2, Sn(OH)4, Al(OH)3, Cr(OH)3, Mn(OH)4 и др.).
Cоли представляют собой продукты замещения атомов водорода в кислоте на металл или гидроксид-ионов в основаниях на кислотный остаток. Согласно теории электролитической диссоциации, солями называются вещества, при диссоциации которых образуются катионы металлов (а также NH4+ – катион аммония) и анионы кислотных остатков. Соли подразделяются на нормальные, или средние (Na2SO4, K2S, Na2SiO3 и др.), кислые, или гидросоли (NaHCO3, KHSO4, NaHS и др.), основные, или гидроксосоли (ZnOHCl, (CuOH)2CO3, AlOH(NO3)2 и т.д.), двойные (KNaCO3, KAl(SO4)2 и др.), смешанные (СаСlOCl, или СаOСl2, Sr(HS)Cl и др.) и оксосоли (SbOCl, BiONO3, TiOCl2 и др.).
Существуют соединения, которые не относятся к основным классам веществ: гидриды, карбиды, нитриды, сульфокислоты и сульфосоли, комплексные соединения и др.
Приборы и реактивы
1. Пробирки, стеклянная палочка.
2. Спиртовая горелка, щипцы, фарфоровая чашка.
3. Универсальная индикаторная бумага.
4. Цинк, магний, натрий, железо, медь.
5. Кислоты соляная и серная, 0,1М раствор и конц., азотная, 1 М раствор.
6. Гидроксид натрия, 30%-й раствор и 0,1 М р-р.
7. Хлорат калия (бертолетова соль).
8. Оксид марганца (IV).
9. Перманганат калия.
10. Хлорная вода.
11. Растворы: сульфата меди (II), сульфата кадмия, нитрата свинца (II), хлорида или сульфата никеля (II), хлорида железа (III), хлорида или сульфата цинка, хлорида бария, карбоната натрия, силиката натрия, йодида калия, хлорида калия.
12. Бихромат аммония.
13. Индикаторы: фенолфталеин, метилоранж, метиловый красный, малахитовый зеленый, метиловый фиолетовый, тимоловый синий, ализарин, тимолфталеин.
14. Хлорид натрия.
15. Оксиды цинка, меди и хрома.
16. Нитрат калия, хлорид железа (III) конц.
17. Раствор метилового красного.
18. Вода дистиллированная.
Порядок выполнения работы
Дата: 2018-12-21, просмотров: 763.