1. Получение солей свинца и серебра. К пяти каплям раствора Pb(NO3)2 прибавьте 5 капель раствора любого хлорида. Наблюдайте выпадение осадка PbCl2. Самостоятельно подберите реактивы и получите сульфат свинца PbSO4 и йодид свинца PbI2. Опишите опыты, запишите уравнения реакций в молекулярном и ионном виде.
Подберите необходимые реактивы и получите галогениды серебра. Обратите внимание на различную окраску полученных солей. Напишите уравнения реакций в молекулярном и ионном виде. В отчете напишите уравнения реакций с пояснениями и наблюдениями.
2. Взаимодействие солей со щелочами. В трех пробирках проведите реакции растворов солей никеля (NiSO4), железа (FeCl3) и меди (CuSO4) с гидроксидом натрия (NaOH). Опишите опыт, запишите уравнения реакций. В отчете напишите уравнения реакций с пояснениями и наблюдениями.
3. Взаимодействие солей с солями. В трех пробирках смешайте растворы солей: в первой BaCl2 и Na2CO3, во второй Pb(NO3)2 и CuSO4, в третьей KNO3 и NaCl. Напишите уравнения реакций в первой и второй пробирках. Объясните, почему в третьей пробирке реакция не идет. В отчете напишите уравнения реакций с пояснениями и наблюдениями.
4. Взаимодействие солей с кислотами. Соли взаимодействуют с кислотами в том случае, если образующаяся новая соль или кислота выпадает в осадок. Реакции солей с кислотами с образованием новых нерастворимых солей были проведены в опыте 9.4. В этом опыте следует получить одну из немногих малорастворимых кислот. Для этого налейте в пробирку 4–6 капель раствора силиката натрия и добавьте по каплям разбавленную соляную кислоту. Наблюдайте образование гелеобразного осадка метакремниевой кислоты. В отчете опишите внешние признаки геля кремниевой кислоты, напишите уравнение реакции. В отчете напишите уравнения реакций с пояснениями и наблюдениями:
5. Окислительные свойства солей. Нитраты щелочных металлов при нагревании выделяют кислород, поэтому используются как окислители в составе спичек, зажигательных смесей, пороха, ракетного горючего.
Концентрированным раствором KNO3 сделайте рисунок на фильтровальной бумаге в виде спирали (линия должна быть непрерывной, без пересечений). Конец линии отметьте карандашом. Подождите высыхания и исчезновения рисунка, после чего прикоснитесь тлеющей спичкой к метке. Огонь продвигается по рисунку, «проявляя» его. Опишите и объясните опыт.
Контрольные вопросы
1. Какие вещества называются простыми, по каким свойствам они подразделяются на металлы и неметаллы?
2. Какие виды гидроксидов вы знаете?
3. Какие виды оксидов вы знаете?
4. Какие виды солей вы знаете?
5. Среди оксидов (CaO, SnO, NO, SO3) найти амфотерный и показать его амфотерность уравнениями реакций.
6. Распределите предложенные соединения (Na2SO3, Ва(ОН)2, НАlО2, SbOCl, KAl(SO4)2, AlOH(NO3)2, KHSO4, K2S) по классам: кислоты, основания, соли. Приведите названия всех веществ.
7. Из каких кислот (HCl, H2SO4(разб.), H2SO4(конц.), HNO3(разб.), HNO3(конц.), Н3РО4) можно получить водород при их взаимодействии с цинком?
8. Напишите продукты возможных реакций:
Ag + CuSO4 = Mg + ZnSO4= Cu + MgSO4 =
Zn + CuSO4 = Ag + ZnSO4= Ag + MgSO4 =
9. Определите массовую долю примесей в 100 г известняка (СаСО3), если при его термическом разложении выделилось 20 л СО2.
10. Чем отличается протекание реакций между гидроксидами алюминия и натрия в растворе и расплаве? Напишите уравнения реакций.
Установление формулы кристаллогидрата
Цель работы:
Определение количества (моль) воды в кристаллогидрате – медном купоросе.
Теоретическая часть
В начале XIX в. Пруст в споре с Бертолле высказал утверждение, что вещество, независимо от способов получения, обладает одним и тем же составом. Это утверждение стало основным законом — законом постоянства состава. На основании данных о составе вещества строилась его химическая формула с постоянным количественным соотношением элементов. Поэтому соединения постоянного состава были названы стехиометрическими соединениями. Закон постоянства состава и стехиометричность соединений долгое время считались незыблемыми. Однако в начале XX в. Н.С. Курнаков на основании своих исследований пришел к выводу о существовании нестехиометрических соединений, т.е. характеризующихся переменным составом. Соединения постоянного состава Н.С. Курнаков назвал дальтонидами в честь Дальтона, широко применявшего атомно-молекулярную теорию к химическим явлениям. Нестехиометрические соединения были названы в честь Бертолле бертоллидами. Соединениями постоянного состава являются вещества молекулярного строения, поскольку состав молекул однозначно определяется строением их образующих атомов. Если же кристаллическое вещество имеет атомное или ионное строение, то оно характеризуется более или менее переменным составом. Наиболее отчетливо переменный состав проявляется у соединений d-элементов — оксидов, сульфидов, нитридов, карбидов, гидридов. Среди неорганических веществ почти 95% не имеют молекулярного строения и, следовательно, являются нестехиометрическими соединениями, однако для удобства состав мы выражаем через химическую формулу, условно принимая, что все вещества строго стехиометричны.
Формула химического соединения показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы или формульной единицы. Массовые соотношения элементов в молекулах можно представить как отношение произведений соответствующих атомных масс на число атомов каждого элемента в молекуле, т.е. можно записать:
m1 : m2 : m3 = xA1 : yA2 : zA3,
где m1, m2, m3 – содержание элементов в соединении (%);
x, y, z – число атомов этих элементов в молекуле или в формульной единице;
А1, А2, А3 – атомные массы элементов.
Из этого уравнения следует:
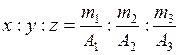 ,
,
что позволяет находить отношение между числами атомов в молекуле.
Например, необходимо определить формулу вещества, которое содержит натрий (32,43 %), серу (22,55 %) и кислород (45,02 %). Соотношение чисел атомов в формуле данного соединения:
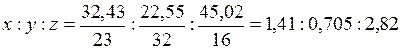
Если самое меньшее число (0,705) принять за единицу, то данное отношение становится отношением целых чисел:
x : y : z = 2 : 1 : 4,
следовательно, формула соединения Na2SO4. Эта формула будет простейшей, поскольку полученное соотношение может быть выражено также и числами, кратными найденным.
Для установления истинной, или молекулярной, формулы необходимо знать молекулярную (молярную) массу соединения; это позволяет найти истинное соотношение атомов в молекуле. Так, например, бензол содержит углерод (92,3 %) и водород (7,7 %). Найденная из этого состава простейшая формула СН. Но в действительности молекулярная масса бензола, определяемая по плотности его пара, равна не 13 (12 + 1, т.е. АС+АН), а 78. Следовательно, истинная формула бензола С6Н6.
Кристаллогидратами называются кристаллические вещества, включающие молекулы воды, например гипс CaSO4·2Н2О. Кристаллогидраты при нагревании теряют кристаллизационную воду, переходя в безводные соли. Пользуясь этим, можно определить содержание воды в кристаллогидрате, а затем, зная формулу безводной соли, рассчитать число молекул воды, присоединяющихся к одной молекуле безводной соли.
Приборы и реактивы
1. Фарфоровый тигель,
2. Песчаная баня,
3. Весы технические,
4. Эксикатор,
5. Медный купорос.
Порядок выполнения работы
1. Взвесить пустой фарфоровый тигель с точностью до 0,01 г. Во взвешенный тигель насыпать 0,5–1 г медного купороса. Тигель с кристаллогидратом снова взвесить.
2. Поместить тигель в нагретую песочную баню на 20–30 минут.
3. Перенести щипцами тигель в эксикатор и охладить.
4. Взвесить охлажденный тигель.
5. Повторить прогревание тигля, снова охладить его в эксикаторе и взвесить. Если масса изменилась не более чем на 0,01 г, прогревание прекратить.
6. По результатам последнего взвешивания заполнить таблицу результатов опыта:
| Масса пустого тигля, г | Масса тигля с кристаллогидратом, г | Масса кристаллогидрата, г | Масса тигля с веществом после прокаливания, г | Масса безводной соли, г | Масса воды, г |
7. Вычислить количество воды, приходящееся на один моль CuSO4, и записать формулу медного купороса, определенную опытным путем.
8. Определить относительную погрешность опыта:
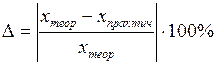 ,
,
исходя из того, что реальная формула медного купороса близка к CuSO4·5H2O.
Контрольные вопросы
1. Что показывает формула химического соединения?
2. Чем отличается простейшая формула вещества от истинной?
3. Какие вещества называются кристаллогидратами?
4. Приведите не менее 5 примеров кристаллогидратов. Где они находят применение?
5. Какие вещества называют дальтонидами?
6. Какие вещества называют бертоллидами?
7. Как определить массовые соотношения элементов в молекулах?
8. Для чего применяются в химическом эксперименте тигель, эксикатор, песчаная баня.
9. Какова формула соединения водорода с кислородом, если мольное соотношение Н:О = 1:1, а плотность его газа по водороду равна 17?
10. Определить формулу кристаллической соды, если при нагревании 286 г данной соли образовалось 106 г карбоната натрия.
Дата: 2018-12-21, просмотров: 879.