аскорбиновой кислоты в растительных продуктах
Основным источником аскорбиновой кислоты (витамин С) для человека являются растительные продукты.
Количественный анализ аскорбиновой кислоты представляет собой определенную трудность, и даже сегодня нет универсального метода, который бы не имел недостатков. Любой метод анализа должен давать возможность одновременно определять как саму аскорбиновую кислоту, так и продукты ее окисления и находить четкие различия между этими соединениями.
Наиболее распространенными методами, основанными на ис-пользовании восстановительных свойств аскорбиновой кислоты, являются титриметрические и колориметрические методы анализа.
В основе наиболее популярного титриметрического метода анализа аскорбиновой кислоты лежит реакция ее взаимодействия с 2,6-дихлорфенолин-
дофенолом. Это соединение при нейтральных значениях рН дает синюю окраску, при кислых – розовую, а при взаимодействии с аскорбиновой кислотой образует бесцветный продукт. К сожалению, данный метод чувствителен к присутствию других восстановителей – ионы металлов, редуцирующие сахара, танины и др. Кроме того, при титровании растительных вытяжек имеются некоторые трудности с определением его завершения.
Ниже представлена методика, основанная на фотометрическом определении избытка 2,6-дихлорфенолиндофенола после восстановления определенной его части аскорбиновой кислотой. Оптическая плотность окрашенного раствора определяется строго через 35 секунд после добавления в растительную вытяжку красителя, что дает возможность полностью исключить ошибки, возможные при титриметрическом анализе аскорбата.
Цель настоящей работы – определить количество аскорбиновой кислоты в различных растительных продуктах (овощи, фрукты, ягоды).
Реактивы и материалы : дистиллированная вода, 2 % метафосфорная или 1 % щавелевая кислота, аскорбиновая кислота, 2,6-дихлорфенолиндофе-
нол, NaOH или KOH, фарфоровая ступка и пестик, воронка, бумажные фильтры, мерная колба объемом 100 мл, мерный цилиндр, пробирки, секундомер, спектрофотометр.
Ход работы
Для количественного определения восстановленной аскорбиновой кислоты взять навеску свежего растительного материала массой 5 г, измельчить и перенести в фарфоровую ступку. Залить сырье 10 мл 2 % метафосфорной или 1 % щавелевой кислоты и быстро растереть. Гомогенат количественно перенести в мерную колбу на 100 мл, объем довести до метки той же кислотой. Содержимое колбы тщательно перемешать, после чего профильтровать или отцентрифугировать 10 мин при 1000 об/мин.
Из фильтрата взять три пробы по 10 мл и перенести в чистые пробирки. К каждой пробе добавить 1 мл свежеприготовленного 0,025 % раствора 2,6-дихлорфенолиндофенола. Для приготовления этого раствора необходимо взять 0,0625 г 2,6-дихлорфенолиндофенола и растворить в 250 мл теплой (45 °С) дистиллированной воды, добавить 6 капель 0,01 н. щелочи.
Если при добавлении 1 мл 2,6-дихлорфенолиндофенола растительная вытяжка полностью обесцвечивается (это наблюдается при значительном количестве аскорбиновой кислоты в исследуемом объекте), то ее нужно разбавить в 2 раза метафосфорной кислотой.
После добавления 2,6-дихлорфенолиндофенола к растительному экстракту включить секундомер, содержимое пробирки тщательно перемешать и быстро залить раствор в кювету толщиной 10 мм.
Через 35 секунд определить оптическую плотность раствора на спектрофотометре при длине волны λ = 530 нм. В качестве раствора сравнения использовать смесь метафосфорной кислоты и 2,6-дихлор-фенолиндофенола (10:1).
Изменение в интенсивности окрашивания опытного образца про-порционально количеству аскорбиновой кислоты, находящейся в рас-тительной вытяжке. Количественный расчет произвести по калибровочной кривой.
Для построения калибровочной кривой необходимо: приготовить стандартный раствор аскорбиновой кислоты концентрацией 1 мг/мл, для этого взвесить 100 мг аскорбиновой кислоты и растворить в 100 мл 2 % метафосфорной кислоты;
– из стандартного раствора приготовить разведения, содержащие от 1 до 100 мкг/мл аскорбиновой кислоты, согласно таблице;
– отобрать 10 мл каждого из растворов аскорбиновой кислоты, перенести в чистые предварительно пронумерованные пробирки, добавить 1 мл 2,6-ди
хлорфенолиндофенола и определить оптическую плотность этих растворов.
| № | Содержание аскорбиновой кислоты, мкг/мл | Количество стандартного раствора, мл | Количество воды, мл | Оптическая плотность раствора, D530 |
| 1 | 1 | 1 | 999 | |
| 2 | 5 | 1 | 199 | |
| 3 | 10 | 1 | 99 | |
| 4 | 20 | 2 | 98 | |
| 5 | 50 | 5 | 95 | |
| 6 | 100 | 10 | 90 |
Пользуясь калибровочной кривой, найти концентрацию аскорбиновой кислоты в вытяжке. Количество аскорбиновой кислоты в исследуемом материале (мгк/г сырой массы) вычислить по формуле:
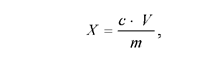
где с – содержание аскорбиновой кислоты в 1 мл вытяжки, найденное по калибровочной кривой; V – объем экстракта в мл; m – масса исследуемого материала в граммах.
Результаты представить в виде таблицы.
| Объект исследования | Масса навески, г | Оптическая плотность раствора, D530 | Количество аскорбиновой кислоты в вытяжке, мкг/мл | Количество аскорбиновой кислоты в объекте, мкг/г |
Сделать анализ полученных результатов.
Определение витаминов В1 и В2 в растениях
В растениях содержание витаминов невелико. Вместе с тем отдельные органы и ткани растений способны в большей степени накапливать их в своем составе. Так, овощные и плодовые культуры характеризуются высоким содержанием каротиноидов, витамина Р, аскорбиновой и фолиевой кислотой. В семенах злаковых и зернобобовых культур много рибофлавина, тиамина, ниацина. В зеленых листьях растений накапливаются филлохиноны.
Тиамин, или витамин В1, в виде тиаминпирофосфата входит в состав окислительных декарбоксилаз кетокислот. Методы определения тиамина основаны на его спектральных свойствах. Максимум поглощения тиамина составляет λ = 250 нм. Продукт окисления тиамина красной кровяной солью в щелочной среде – тиохром флюоресцирует при ультрафиолетовом освещении.
Рибофлавин, или витамин B2, идентифицирован в природных объектах в виде четырех форм, одна из которых свободный рибофлавин, остальные связаны с нуклеотидами (флавинмононуклеотид, флавинадениндинуклеотид) и с белком. Рибофлавин входит в состав простетической группы флавиновых ферментов, осуществляющих реакции дегидрирования. Окисленная форма рибофлавина так же, как и тиамина, способна флюоресцировать в ультрафиолетовом свете. Максимум поглощения рибофлавина лежит в области λ = 225 нм.
Цель работы – качественное и количественное определение витаминов B1 и B2 в вытяжках из вегетативных частей растений, корнеплодов и плодов.
Реактивы и материалы: 0,1 н. раствор H2SO4, 10 % трихлоруксусная кислота (ТХУ), 15 % раствор NaOH, 1 % раствор красной кровяной соли K3[Fe(CN)6], бромид тиамина (хлорид тиамина), рибофлавин, Na2S2O4 • H2O либо NaBH4, 0,01 н. раствор NaOH, металлический цинк, пепсин либо трипсин, изоамиловый спирт, изобутиловый спирт, этиловый спирт, диэтиловый эфир, дистиллированная вода, фарфоровые ступки с пестиками, конические колбы объемом 100 мл, водяная баня, мерные цилиндры, пробирки, делительные воронки объемом 50 мл, бумажные фильтры, термостат, центрифуга, флюоресцентный спектрофотометр.
Ход работы
1. Извлечение витаминов
1. К навеске измельченного растительного материала массой 10–20 г прилить небольшое количество (2–5 мл) 0,1 н. раствора Н2SO4, после чего все тщательно растереть в ступке.
2. Растертую массу поместить в коническую колбу на 100 мл, сюда же прибавить 30 мл 0,1 н. раствора Н2SO4. Содержимое колбы следует выдержать в течение 20 минут на кипящей водяной бане для экстрагирования витаминов.
3. После завершения процедуры экстрагирования смесь охладить и добавить в колбу 30 мг пепсина либо трипсина для перевода витамина в свободное состояние.
4. Объем гомогената довести до 50 мл раствором серной кислоты. Провести ферментацию в течение 20 ч. в термостате при 38 ºС.
5. По истечении указанного времени вытяжку центрифугировать при 5000 об/мин и отфильтровать под вакуумом. К получившейся надосадочной жидкости прилить равный объем 10 % ТХУ и выпарить до 10 мл. Продолжить выпаривание вытяжки, удаляя избыток ТХУ 2-3-кратным промыванием смесью этилового спирта и диэтилового эфира (1:1), до объема 5 мл.
Далее полученную вытяжку разделить на две части: одна идет на определение тиамина, а вторая – рибофлавина.
2. Получение тиохрома
1. В делительные воронки объемом 50 мл налить 2,5 мл полученной вытяжки. В одну из воронок (контрольную) прилить 1,5 мл 15 % раствора NaOH, перемешать и добавить 6 мл изобутилового спирта.
2. В опытные воронки прибавить по 1,5 мл 0,04 % раствора красной кровяной соли в 15 % растворе NaOH, все содержимое перемешать и прилить 6 мл изобутилового спирта.
3. Делительные воронки закрыть пробками и сильно встряхивать в течение 1 мин. Дать смеси отстояться, затем нижний слой следует слить. Для просветления спиртового слоя прилить 1 мл этилового спирта, встряхнуть, дать отстояться и полученный прозрачный раствор слить в пробирку для последующего спектрофотометрического анализа.
3. Флюоресцентная спектроскопия растворов тиохрома и рибофлавина
1. Полученные опытные растворы тиохрома перелить в кюветы и провести измерение интенсивности флюоресценции (длина волны возбуждения λ = 250 нм). Максимум флюоресценции для тиохрома составляет λ = 495-500 нм.
Аналогично провести процедуру измерения интенсивности флюоресценции для растворов рибофлавина (длина волны возбуждения равна λ = 225 нм). Регистрировать максимум флюоресценции рибофлавина в области λ = 525-530 нм.
Учитывая, что спектральные свойства окисленных и восстановленных форм тиамина и рибофлавина изменяются, провести их сравнительный флюоресцентный анализ. Рибофлавин окисляется 4 % раствором перманганата калия, который добавляется к вытяжке по каплям до исчезновения красноватой окраски, либо концентрированной HCl в присутствии металлического цинка. Восстановление окисленных форм тиамина и рибофлавина осуществить либо гидросульфитом натрия (Na2S2O4 • H2O) либо боргидридом натрия (NaBH4), добавляя эти восстановители в количестве 0,1–0,2 г на 1–2 мл раствора витаминов.
Результаты оформить в виде таблицы и сделать выводы.
| Витамин | Возбуждение флюоресценции, нм | Интенсивность флюоресценции, отн. ед. | ||
| окисленная форма | восстановленная форма | окисленная форма | восстановленная форма | |
| В1 | ||||
| В2 | ||||
4. Количественное определение витаминов В1 и В2
Для количественной оценки содержания витаминов в растительных образцах следует получить калибровочные графики зависимости интенсивности флюоресценции от концентрации. С этой целью необходимо:
1. Приготовить стандартные растворы витаминов тиамина и рибофлавина (10 мг тиамина бромида (тиамина хлорида) растворить в 100 мл 0,01 н. раствора HCl, 10 мг рибофлавина растворить в 100 мл 0,01 н. раствора NaOH).
2. Провести окисление стандартного раствора тиамина. Для этого в делительную воронку налить 1 мл рабочего раствора и прибавить 4 мл воды.
(Рабочий раствор приготовить непосредственно перед окислением. Для этого взять 1 мл стандартного раствора и довести его до 100 мл дистиллированной водой 1 мл этого рабочего раствора будет содержать 1 мкг тиамина бромида).
3. В воронку прилить щелочной раствор красной кровяной соли и провести процедуру разделения и просветления растворов, как это описано выше. Окисленный и просветленный раствор перелить в пробирки для флюориметрии.
4. Приготовить рабочий раствор рибофлавина. Для этого следует взять 1 мл стандартного раствора рибофлавина и довести его до 100 мл дистиллированной водой (1 мл этого раствора будет содержать 1 мкг рибофлавина).
5. Построить калибровочные кривые для растворов тиохрома и рибофла-вина, взяв следующие концентрации для тиамина – 0,05; 0,1; 0,15; 0,2 мкг, а для рибофлавина – 0,005; 0,010; 0,020; 0,05 мкг.
По калибровочным кривым рассчитать содержание тиамина и рибофлавина (мкг/мл) в растительных образцах. Количество витаминов в исследуемом материале (мгк/г сырой массы) вычислить по формуле:
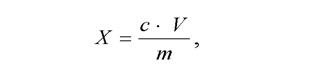
где с – содержание витамина в 1 мл вытяжки, найденное по калибро-вочной кривой; V – объем экстракта в мл; m – масса исследуемого материала в граммах.
Сделать выводы.
Контрольные вопросы
1. Содержание жиро- и водорастворимых витаминов в растительных продуктах.
2. Строение, свойства и функции витаминов в растениях.
Дата: 2018-12-21, просмотров: 720.