Тема 1. Введение в биохимию
Лабораторная работа №1. Правила работы и техника безопасности
в химической лаборатории
Учебные вопросы:
1.Рабочий стол химическая посуда и лабораторное оборудование.
2.Обращенте со стеклом реактивами правила первой помощи.
3.Средняя и аналитическая пробы растительного материала.
Правила работы в биохимической лаборатории
Приступая к выполнению лабораторного практикума, студент должен быть подготовленным к лабораторному занятию. Подготовка проводится до занятий по учебникам, лекционным записям и методическим пособиям. В специальную тетрадь заносится краткое описание опыта, уравнения реакций. Наблюдения и выводы записываются при непосредственном выполнении опытов.
Во время проведения опытов на рабочем месте не должно быть ничего лишнего, необходимо поддерживать на нем чистоту и порядок. По окончании работы студент должен убрать рабочее место, вымыть лабораторную посуду.
Нельзя уносить приборы, реактивы, цилиндры, пипетки и другие предметы общего пользования на свое рабочее место.
После выполнения цикла лабораторных работ студенты сдают теоретический коллоквиум.
Староста группы на время занятий назначает дежурного по группе. Дежурный отвечает в течение всего занятия за порядок и чистоту рабочих мест, за оборудование общего пользования. По окончании работы дежурный сдает лабораторию учебному лаборанту. Рабочее место, не приведенное в порядок, убирает сам дежурный.
Правила техники безопасности при работе в биохимической лаборатории
Каждый работающий должен знать, где находятся в лаборатории средства противопожарной защиты и аптечка, содержащая все необходимое для оказания первой помощи.
Никакие вещества в лаборатории нельзя пробовать на вкус. Нюхать вещества можно лишь осторожно направляя на себя пары или газы легким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
Приступать к выполнению каждой работы следует только с разрешения преподавателя и после полного уяснения всех ее операций.
Нельзя производить какие-либо опыты в загрязненной посуде. Посуду следует мыть сейчас же после окончания опыта.
Не разрешается работать в лаборатории без халата.
Нельзя оставлять действующий прибор без присмотра.
Концентрированные кислоты и щелочи нужно наливать в сосуд осторожно, под тягой, чтобы не облить рук, не получить брызг на лицо и платье. При наливании концентрированных растворов кислот и щелочей обязательно пользоваться воронкой. Надо твердо помнить правило смешивания концентрированной серной кислоты с водой: не воду лить в кислоту, а наоборот - кислоту в воду небольшими порциями.
В случае воспламенения легкоиспаряющихся жидкостей нужно, прежде всего, потушить горелки, выключить электроприборы, унести все находящиеся поблизости горючие вещества, а затем гасить пламя, засыпая его песком, закрывая мокрым полотенцем или одеялом. Большое пламя гасят с помощью углекислотных огнетушителей. Не следует заливать пламя водой, во многих случаях это приводит к большему распространению пламени и расширению очага пожара.
В случае воспламенения одежды не следует бежать, надо набросить на пострадавшего халат, брезент, шерстяное или войлочное одеяло. Можно тушить одежду на себе обливанием водой или быстрым перекатыванием на полу.
При легких термических ожогах кожу следует обработать спиртом, а затем смазать глицерином или вазелином. При более сильных ожогах, после обработки спиртом или концентрированным раствором перманганата калия, обожженное место необходимо смазать мазью от ожога.
При ожогах крепкими кислотами необходимо сразу же промыть пораженное место большим количеством воды, а затем 3%-ным раствором гидрокарбоната натрия и опять водой.
При ожогах едкими щелочами обильно промыть пораженное место проточной водой, затем разбавленным раствором уксусной кислоты, а после опять большим количеством воды.
При попадании кислоты или щелочи в глаза следует сразу же их промыть. Для этого направляют небольшую струю воды то в один, то в другой
глаз в течение 3-5 минут. Затем глаза необходимо промыть 3%-ным раствором борной кислоты. После этого нужно немедленно обратиться к врачу.
При порезах стеклом необходимо удалить осколки стекла из раны, залить пораженное место спиртовым раствором йода и наложить стерильную повязку. При сильных кровотечениях следует наложить выше раны жгут и вызвать врача или отправить пострадавшего в медпункт.
Контрольные вопросы
1. Предмет и задачи биохимии растений.
2. Значение биохимии растений для практики.
3. Мир растений как источник промышленного сырья.
4. Краткая история развития биохимии растений.
5. Правила работы в биохимической лаборатории.
6. Правила техники безопасности при работе в биохимической лаборатории.
Тема 2. Состав, строение и биологические функции углеводов и липидов
Лабораторная работа №2. Особенности сахаров и методов их
определения. Определение редуцирующих сахаров и сахарозы
Учебные вопросы:
1.Состав, строение, классификация углеводов
2.Физиологическая роль углеводов
3.Принцип метода обнаружения в растениях простых и сложных сахаров
Растворимые углеводы (сахара) являются неотъемлемым компонентом любой ткани растения. Количественный и качественный состав сахаров у разных растений может варьировать в широких пределах. В корнеплодах сахарной свеклы накапливается 19–21 % сахаров, представленных главным образом сахарозой. Ягоды винограда содержат 20–30 % сахаров, состоящих почти исключительно из глюкозы и фруктозы. Много сахаров содержат персики, абрикосы, яблоки, груши, сливы, цитрусовые и ягодные культуры. У всех растений, особенно у ягодных культур (земляника, смородина, малина, вишня, хурма), относительное содержание моносахаридов и сахарозы подвержено значительным колебаниям. На сахаристость и соотношение различных сахаров в плодах оказывают влияние самые разнообразные факторы – увлажнение почвы, температура, количество вносимых минеральных удобрений, длина светового периода и др. Поэтому при оценке сахаристости различных плодов и сортов одного и того же растения необходимо учитывать эти факторы, чтобы сопоставлять только сравниваемые между собой объекты.
Большая часть сахаров находится в клеточном соке, и одним из приемов оценки образцов является анализ сока растения. Сахара легко растворяются в воде и на этом свойстве основано их выделение из растений и перевод в водную вытяжку.
Количественное определение сахаров проводят с помощью самых разнообразных методов, основанных на их физических и химических свойствах. Наиболее общий классический химический метод количественного определения сахаров, обладающих свободной альдегидной или кетонной группой, основан на способности этих функциональных групп восстанавливать в щелочной среде окисную медь в закись меди.
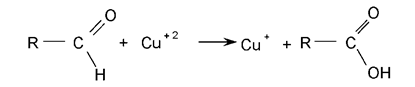
Сахара, обладающие таким свойством, называются восстанавливающими, или редуцирующими. К ним относятся все моносахариды и некоторые олигосахариды, имеющие одну свободную карбонильную группу (мальтоза, лактоза). Сахароза и другие олигосахара, у которых связаны обе карбонильные группы, требуют предварительного гидролиза кислотой или ферментом.
В водной вытяжке некоторых объектов кроме сахаров присутствуют также другие редуцирующие вещества (белки, крахмал, инулин), которые могут искажать результаты анализа. В таких случаях требуется использовать осадители, чтобы очистить вытяжку.
В случае анализа окрашенных объектов (виноград, листовые овощи, сахарная свекла) обязательно производят осветление вытяжек осаждением примесей. В качестве осадителей можно использовать:
1) смесь 30 % раствора сернокислого свинца и 15 % раствора желтой кровяной соли, взятых в равных объемах;
2) 4 % раствор фосфорновольфрамовой кислоты;
3) 10 % раствор уксуснокислого свинца.
Некоторые объекты (томаты, яблоки, лимоны) содержат значительные количества кислот, которые могут во время извлечения сахаров при нагревании частично или полностью гидролизовать сахарозу. Поэтому если определяют не только общий сахар, но и отдельно сахарозу, необходимо перед нагреванием к водной вытяжке добавить мел для нейтрализации кислот.
Цель настоящей работы - определить количество сахаров (моно-и олигосахаридов) в различных растительных объектах.
Реактивы и материалы: дистиллированная вода, уксуснокислый свинец, фосфорнокислый натрий, CuSO4 · 5H2O, NaOH, глицерин, соляная кислота, глюкоза, фарфоровая ступка и пестик, воронка Шотта, колба Бунзена, конические колбы объемом 100 мл, мерный цилиндр, пробирки, водяная баня
Ход работы
1. Извлечение сахаров водой
Взвесить 5 г исследуемого материала (яблоки, капуста, морковь, лук), размельчить и растереть до гомогенной массы в фарфоровой ступке с небольшим количеством воды, нагретой до 70оС. Растертую массу количественно перенести в коническую колбу на 100 мл, объем вытяжки довести до 50 мл горячей дистиллированной водой и оставить на 10 мин для экстракции. По истечении указанного времени экстракт охладить, отфильтровать через воронку Шотта и количественно перенести вытяжку в мерную колбу. При необходимости довести объем водой до 50 мл.
Обязательно провести осветление вытяжки в случае окрашенных (мутных) экстрактов. Для этого в теплую, не доведенную до окончательного объема вытяжку добавить по каплям 10 % раствор уксуснокислого свинца до прекращения образования осадка. Обычно на вытяжку, полученную из навески 10 г, необходимо добавить 0,5-2 мл раствора уксуснокислого свинца. Избытка соли свинца следует избегать, так как он проходит через фильтр и мешает ходу анализа. Осветленную вытяжку отфильтровать и довести объем водой до 50 мл.
2. Определение восстанавливающих сахаров
Для определения содержания восстанавливающих сахаров предварительно следует приготовить раствор глицерата меди. Для этого необходимо сделать смесь (2:1) растворов № 1 (0,8 % CuSO4 · 5H2O) и № 2 (15 % NaOH с добавлением 1 мл глицерина).
Отобрать 1 мл осветленной отфильтрованной вытяжки в пробирку, добавить 15 мл глицерата меди, перемешать и нагревать на водяной бане при
70оС 6 мин. Затем пробирку охладить в холодной воде и отобрать прозрачную жидкость в кювету для определения оптической плотности раствора (проба 1).
3. Определение суммы восстанавливающих и невосстанавливающих сахаров (сахарозы)
Для определения содержания невосстанавливающих сахаров отобрать 0,5 мл осветленной отфильтрованной вытяжки, добавить 0,5 мл 1 % НСl, перемешать и поставить на кипящую водяную баню на 15 мин. По истечении указанного времени добавить 15 мл глицерата меди и нагревать на водяной бане ровно 6 мин. Охладить пробирку в холодной воде, дать вытяжке отстояться и отобрать прозрачную жидкость для оптического анализа (проба 2). В этой пробе определяется сумма восстанавливающих сахаров и сахарозы.
4. Спектрофотометрия
Оптическую плотность исследуемых растворов необходимо регистрировать на спектрофотометре при длине волны λ = 582 нм.
Содержание сахаров в пробах можно определить по калибровочной кривой, построенной по глюкозе. Для этого необходимо приготовить 50 мл раствора, содержащего 10 мг/мл глюкозы, и затем методом разбавления получить остальные растворы согласно таблице:
| № | Содержание глюкозы, мг/мл | Количество ис- ходного раствора глюкозы, мл | Количество воды, мл | Оптическая плотность, D582 |
| 1 2 3 4 5 6 | 0,5 1,0 2,5 5,0 7,5 10,0 | 0,5 1,0 2,5 5,0 7,5 10,0 | 9,5 9,0 7,5 5,0 2,5 0 |
Для определения оптической плотности ( D582) этих растворов предварительно провести реакции с глицератом меди, аналогично опытным образцам.
Количество восстанавливающих сахаров в исследуемом объекте (А, %) вычислить по формуле:
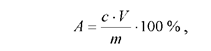
где с - содержание сахаров в пробе 1, найденное по калибровочной кривой; V - объем вытяжки, полученной из навески; m - масса навески в граммах.
По этой же формуле рассчитать сумму восстанавливающих сахаров и сахарозы, подставляя вместо с содержание сахаров в пробе 2, найденное по калибровочной кривой. Разность между вторым и первым определениями, умноженная на коэффициент 0,95, дает содержание сахарозы в исследуемом объекте.
Результаты оформить в таблицу.
| Объект | D582 проба 1 | D582 проба 2 | Количество вос- станавливающих сахаров, мг/г | Сумма моно- и олигосахаридов, мг/г | Количество сахарозы, мг/г |
Сделать выводы.
Контрольные вопросы
1. Классификация углеводов.
2. Основные моносахариды растений, их свойства и функции.
3. Основные дисахариды растений – сахароза, мальтоза, целлобиоза. Функции сахарозы в растениях.
4. Редуцирующие веществами – особенности строения и обнаружения их в растительном материале. Приведите примеры.
5. Нередуцирующие веществами – особенности строения и обнаружения их в растительном материале. Приведите примеры.
6. Использование растительных углеводов в пищевой промышленности.
Тема 2. Состав, строение и биологические функции углеводов и липидов
Лабораторная работа № 3. Определение кислотного и йодного числа
растительных жиров
Учебные вопросы:
1.Строение и химические свойства липидов
2.Физиологическая роль липидов для растений
3.Обмен липидов в растениях
Запасные жиры растений представляют собой сложные эфиры многоатомных спиртов (в первую очередь, глицерина) и жирных кислот – триглицериды. Этерификация глицерина может осуществляться как одним типом жирных кислот, так и разными, причем последний вариант наиболее распространен. В том случае, когда все три кислоты насыщенные, образуются твердые жиры, если кислоты ненасыщенные – жидкие. Растительные жиры чаще всего жидкие, поэтому их именуют маслами.
Для жиров (как жидких, так и твердых) характерна высокая степень гидрофобности. Они не растворимы в воде, но хорошо растворимы в углеводородах, галагеналканах, спиртах, эфирах.
В числе компонентов, входящих в состав растительных масел, всегда присутствует небольшое количество свободных жирных кислот. Этот показатель именуется кислотным числом и дает представление о количестве свободных жирных кислот в масле. В частности, кислотное число показывает, сколько мг КОН необходимо для нейтрализации свободных жирных кислот в 1 г масла.
Поскольку при длительном хранении масла происходят процессы окисления, то содержание свободных жирных кислот со временем увеличивается. Следовательно, кислотное число является важным показателем качества жира.
Другим физико-химическим показателем, характеризующим свойства жира, является число омыления, которое показывает количество мг КОН, необходимое для омыления связанных и нейтрализации свободных жирных кислот в 1 г масла.
О содержании ненасыщенных жирных кислот в жире судят по йодному числу – количеству граммов йода, присоединившемуся к 100 граммам жира. Определение физико-химических показателей растительного масла имеет важное значение, так как позволяет контролировать качество получаемого масличного сырья и его изменение при переработке и хранении.
Цель настоящей работы – определить и сравнить физико-химические свойства различных растительных масел.
Реактивы и материалы: подсолнечное, рапсовое, оливковое масло, этиловый спирт, КОН, H2SO4, фенолфталеин, хлороформ, 2,5 % спиртовой раствор иода, гипосульфит натрия, крахмал, дистиллированная вода, конические колбы, весы, микробюретка для титрования, водяная баня, обратный холодильник.
Ход работы
1. Определение кислотного числа
Взвесить пустую колбу, затем осторожно туда добавить небольшое количество растительного масла (оливковое, подсолнечное, рапсовое). Массу навески определить по разности массы колбы с маслом и пустой колбы.
Приготовить 100 мл 0,2 н спиртового раствора КОН. Для этого взвесить 1,12 г щелочи и растворить в минимальном количестве воды (1-1,5 мл). После того как навеска щелочи растворена, довести объем 96 % этанолом до 100 мл.
В колбу с маслом прилить 15 мл этанола, добавить 2-3 капли фенолфталеина и тщательно перемешать. Затем оттитровать полученный раствор 0,2 н спиртовым раствором щелочи до появления окрашивания. Титрование более слабыми растворами КОН не дает видимых изменений окраски и затрудняет определение конца титрования. В качестве контроля оттитровать 15 мл этанола с 2-3 каплями фенолфталеина тем же раствором щелочи.
Кислотное число (КЧ) вычислить по формуле:
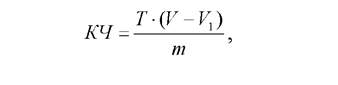
где T - титр щелочи (количество КОН в 1 мл раствора), мг; V - объем раствора щелочи, пошедшей на титрование контрольной пробы, мл; VI - объем раствора щелочи, пошедшей на титрование опытной
пробы, мл; m - масса навески в граммах.
2. Определение числа омыления
В конической колбе взвесить навеску масла 0,2-0,5 г (как указано выше), прилить 15 мл 0,2 н спиртового раствора щелочи и нагревать на водяной бане 30 мин с обратным холодильником. Одновременно прокипятить контрольную пробу с таким же количеством щелочи, но не содержащую масла. По истечении указанного времени охладить колбы с раствором. При полном омылении на опытной колбе не должно быть блестящих капелек масла, в противном случае омыление надо продолжить. После омыления и охлаждения в колбы добавить 2-3 капли фенолфталеина и избыток щелочи оттитровать 0,5 . раствором H2SO4, пользуясь микробюреткой.
Вычислить число омыления (ЧО) по формуле:
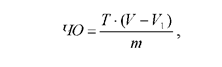
где T - титр щелочи, мг; V - объем кислоты, пошедшей на титрование контрольной пробы, мл; V1 - объем кислоты, пошедшей на титрование опытной пробы, мл; m - масса навески в граммах.
3. Определение йодного числа
В коническую колбу взвесить 0,1 грамм жира и внести 5 мл хлороформа. Для контроля взять колбу, содержащую только 5 мл хлороформа. В обе колбы прилить по 10 мл 2,5 % спиртового раствора иода, закрыть пробкой, тщательно перемешать и оставить в темной месте на 1 ч при комнатной температуре. По истечении указанного времени избыток иода оттитровать 0,1 н раствором гипосульфита натрия до желтой окраски. Затем добавить 1 мл 1 % раствора крахмала и продолжить титрование до обесцвечивания раствора. Иодное число (ИЧ) вычислить по формуле:
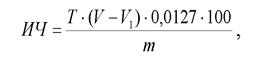
где T - титр 0,1 н раствора гипосульфита натрия, мг; V - объем раствора гипосульфита, пошедшего на титрование контрольной пробы, мл; V 1 - объем раствора гипосульфита натрия, пошедшей на титрование опытной пробы, мл; m - масса навески в граммах; 0,0127 - количество йода (г), эквивалентное 1 мл 0,1 н раствора гипосульфита натрия.
Результаты оформить в виде таблицы.
| Вид растительного масла | Кислотное число | Число омыления | Йодное число |
Сделать сравнительный анализ полученных результатов.
4.Определение перекисного числа
В присутствии кислорода воздуха кислоты, входящие в состав жиров, могут частично окисляться и образовывать перекиси. Это явление наблюдается при порче жиров, а также при их высыхании. Таким образом, перекис-ное число служит показателем окислительных изменений жиров.
Обычно перекисное число, как и йодное число, выражается в граммах йода, которое может прореагировать с активным водородом перекисей, содержащихся в 100 г жира.
Принцип метода. Определение перекисного числа основано на том, что перекиси жира в кислой среде способны реагировать с йодистым калием, выделяя из него йод.
Выделяющийся йод оттитровывают раствором гипосульфита:
2Na2S2О3 + J2 → 2NaJ + Na2S4О6
и по количеству гипосульфита, затраченному на связывание выделившегося йода, вычисляют перекисное число.
Ход работы
1. На аналитических весах отвешивают 2 –3 г жира, который помещают в коническую колбу емкостью 150–200 мл. В другую колбу (контроль) наливают 2–3 мл воды.
2. В обе колбы наливают по 10 мл хлороформа и растворяют жир.
3. В колбы добавляют по 20 мл ледяной уксусной кислоты и по 1 мл свежеприготовленного насыщенного раствора йодистого калия.
4. Смесь тщательно перемешивают и оставляют на 3 минуты.
5. Проводят титрование выделившегося йода 0,01 н. раствором гипосульфита. Титруют до появления желтой окраски.
6. Затем в колбы прибавляют по 1 мл 1%-ного раствора крахмала и титруют до исчезновения голубой окраски.
Вычисление результатов можно проводить по следующей формуле:
х = _(а - б) · Т · 0,001269 ·100
Н
где х – перекисное число;
а – количество миллилитров 0,01 н. гипосульфита, израсходованное на титрование йода, выделившегося в результате реакции жира с йодистым калием;
б – количество миллилитров 0,01 н. гипосульфита, израсходованное в контрольном определении;
Т – поправка к титру раствора гипосульфита;
Н – навеска жира.
Контрольные вопросы
1. Строение, свойства и функции липидов в живой клетке.
2. Жирные кислоты в составе липидов, их влияние на качество пищевых
продуктов.
3. Особенности обмена липидов растений.
4. Глиоксилатный цикл.
5. Содержание жиров в семенах и плодах культурных растений.
6. Свойства основных растительных масел.
7. Сравнительный анализ растительных и животных жиров.
8. Использование липидов в пищевой промышленности?
Дата: 2018-12-21, просмотров: 755.