Основное уравнение для расчета кровотока через орган следующее:
органный кровоток - АР/7?,
(2-1)
где АР — среднее артериальное давление минус венозное давление в данном органе, К — общее сосудистое сопротивление в данном органе. Сопротивление определяется по вязкости крови, длине и радиусу кровеносных сосудов органа, по радиусу артериол, которые вносят основной вклад в образование кровотока. Радиус определяется степенью сокращения гладкой мускулатуры артериол.
Наличие двух типов артериол и двух типов капилляров — клубочковые и перитубулярные — делает сосудистое русло почек отличным от других органов. В норме сопротивление афферентных и эфферентных артериол примерно равно и совпадает в большинстве случаев с общим почечным сосудистым сопротивлением. Поскольку два капиллярных русла разделяются афферентными и эфферентными артериолами, гидростатическое давление во втором русле — перитубу-лярных капиллярах — гораздо ниже, чем в первом — клубочках (20 мм рт. ст. против 60 мм рт. ст. у здорового взрослого субъекта не в состоянии стресса). Как мы увидим, высокое гломерулярное давление является решающим фактором для клубочковой фильтрации (см. данную главу), в то время как низкое перитубуляр-ное капиллярное давление в равной степени является решающим фактором для канальцевой реабсорбции жидкости (глава 6).
Следует повторить, что почечный кровоток определяется в основном средним артериальным давлением и степенью сокращения гладкой мускулатуры почечных артериол. Теперь о простом, но очень важном моменте: возникающее изменение артериолярного сопротивления оказывает одинаковый эффект на почечный кровоток независимо от того, возникает оно в афферентных или эфферентных арте-риолах.
Когда обе величины сопротивления изменяются в одном направлении, что чаще всего и происходит, их влияние на почечный кровоток будет аддитивным (поскольку в данном случае есть две величины сопротивления). Когда они изменяются в различных направлениях — величина одного сопротивления увеличивается, а другого — уменьшается, то они оказывают взаимно противоположный эффект на почечный кровоток. В следующем разделе мы увидим, что эта ситуа ция складывается совершенно иным образом в отношении скорости клубочковой фильтрации.
Будет также подчеркнуто, что корковое вещество в почках получает преимущественную долю из почечного объема кровотока (в норме более 90 %). Столь скромная величина кровотока в мозговом веществе (его приспособительная роль для концентрирования мочи будет обсуждена в главе 7) возникает в результате высокого сопротивления, обусловленного уазагесйа. Кровоток в корковом и моз-
42
говом веществе почек подчиняется независимой регуляции, и в данной главе будет описано сосудистое русло только коркового вещества (см. СЬоп и соавт. и Ра1-1опе и соавт. в рекомендуемой литературе для описания кровообращения в мозговом веществе и его регуляции).

Как указано в главе 1, гломерулярный фильтрат преимущественно не содержит белка, но в то же время содержит большинство неорганических ионов и растворенных низкомолекулярных органических веществ практически в той же концентрации, что и в плазме *. (Соображение для использования терминов «преимущественно» и «большинство» в последнем предложении будет коротко обосновано.)
Путь, по которому фильтруемые вещества преодолевают мембраны почечного тельца, следующий: отверстия (тюры) в слое клеток эндотелия клубочка и капилляра, базальная мембрана, щелевидные диафрагмы и щелевидные отверстия между пальцевидными отростками подоцитов. А какие из перечисленных структур создают главные барьеры на пути фильтрации макромолекул — это очень трудный вопрос для ответа2, но очевидно, что они оказывают это действие в связи с величиной молекулы и её электрическим зарядом. Сперва рассмотрим значение величины молекулы.
Мембраны почечного тельца не создают никакой помехи передвижению молекул с молекулярной массой менее 7000 и являются почти абсолютным препятствием по отношению к альбумину плазмы (молекулярная масса около 70 000). (Для упрощения мы используем величины молекулярной массы для характеристики величины молекулы; на самом деле такой определяющей величиной является радиус молекулы.) Препятствие для альбумина плазмы в мембране почечного тельца возникает не 100 %, тем не менее гломерулярный фильтрат действительно содержит предельно малые количества альбумина, около 10 мг/л или меньше. Это только около 0,02 % от концентрации альбумина в плазме, что является основанием для использования фразы «преимущественно не содержит белка» в первом параграфе данного раздела.
Для молекул с массой 7000—70 000 фильтрация прогрессивно уменьшается по мере увеличения размера молекулы. Таким образом, многие пептиды и небольшие по размерам белки, в норме находящиеся в плазме, в значительной степени фильтруются. Более того, если определенные небольшие по размеру белки в норме отсутствуют в плазме, но при заболевании вдруг появляются в ней (например, гемоглобин, освобождающийся при разрушении эритроцитов, и миоглобин, освобождающийся при разрушении мышечной ткани), то может происходить их фильтрация,в существенных количествах.
Электрический заряд является вторым по значимости фактором, определяющим фильтруемость макромолекул. Для любой исходной величины заряда, отрицательно заряженные макромолекулы фильтруются в меньшей степени, а положительно заряженные макромолекулы — в большей степени, чем электронейтральные молекулы. Дело в том, что поверхность всех компонентов фильтрационного барьера (клеточная эндотелиальная выстилка, базальная мембрана и
43
поверхностный слой на подоците) содержат фиксированные полианионы, которые отталкивают отрицательно заряженные макромолекулы во время процесса фильтрации.
Поскольку подавляющее число белков плазмы несет почти только отрицательные электрические заряды, это препятствие в виде электрического заряда играет очень важную ограничительную роль, увеличивая значимость барьера, который реагирует только на величину молекулы. (Например, когда электронейтральный декстран с величиной молекулы, близкой к величине молекулы альбумина, назначается экспериментальным животным, то оказывается, что они (молекулы декстрана) фильтруются на 5—10 %, т. е. значительно больше, чем соответствующие 0,02 % молекул альбумина). При определенной форме патологии почки, когда почечное тельце становится «проницаемым» по отношению к белкам, это происходит, поскольку на мембранах исчезает отрицательный заряд.
Следует указать, что отрицательный заряд на фильтрирующих мембранах служит препятствием только по отношению к макромолекулам, но не по отношению к неорганическим ионам или низкомолекулярным органическим растворенным веществам.
В конечном итоге следует заметить, что определенные низкомолекулярные растворенные вещества, которые в другой ситуации могут быть профильтрованы полностью, в реальности частично связаны с крупными белками плазмы; та часть молекул, которая будет связана с альбумином, не будет фильтроваться через стенку клубочка.
Концентрация такого вещества в боуменовой капсуле будет равняться не абсолютной концентрации в плазме, но концентрации в плазме вещества, не связанного с белком. Например, 40 % кальция э плазме связано с белком и, таким образом, концентрация кальция в гломерулярном фильтрате составляет 60 % от его концентрации в плазме. (Такие примеры являются основанием для использования слов «большая часть» в первом предложении раздела.)

Скорость движения жидкости при фильтрации в любом участке капиллярного русла в организме определяется гидравлической проницаемостью стенки капилляров, площадью их поверхности и результирующим фильтрационным давлением (РФД), действующим через стенку капилляров:
скорость фильтрации - гидравлическая проницаемость х площадь поверхности х
х РФД.
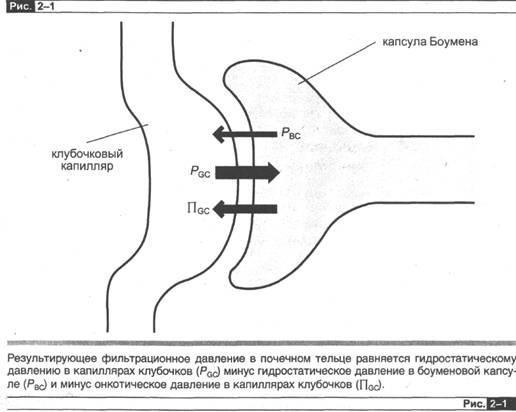
Поскольку трудно вычислить площадь поверхности капиллярного русла, то параметр, называемый фильтрационный коэффициент (К^), используется для определения результата взаимодействия гидравлической проницаемости и площади поверхности3. Показатель РФД является алгебраической суммой гидростатического давления и осмотического давления, обусловленного белком — онкотичё-ское давление (или коллоидно-осмотическое) — по обе стороны стенки капилляра, Применяя эти расчеты к гломерулярным капиллярам, получим:
44
РФД= (Рgс+Пвс) (Рвс + П g с)
силы, способствую- силы, препятствую
щие фильтрации щие фильтрации
где Р g сс — клубочково-капиллярное гидростатическое давление; Пвс ~~ онкотическое давление жидкости в боуменовой капсуле; РВС — гидростатическое давление в боуменовой капсуле; Пgс ~ онкотическое давление в плазме клубочковых капилляров.
Поскольку белка в боуменовой капсуле практически нет, то величину Пвс можно принять равной нулю и не учитывать в наших расчетах (рис. 2-1). Учитывая сказанное, уравнение для расчета скорости клубочковой фильтрации можно представить таким образом:
СКФ=
Kf
(гидравлическая про-
ницаемость х площадь
поверхности тела)
РФД
(Pgc-Pвс~ Пgс)
Величина гидростатического давления в гломерулярных капиллярах и боумено- вой капсуле у человека не поддается прямым методам измерения. В то же время некоторые результаты непрямых исследований дают возможность предположить,
|
|
45
46
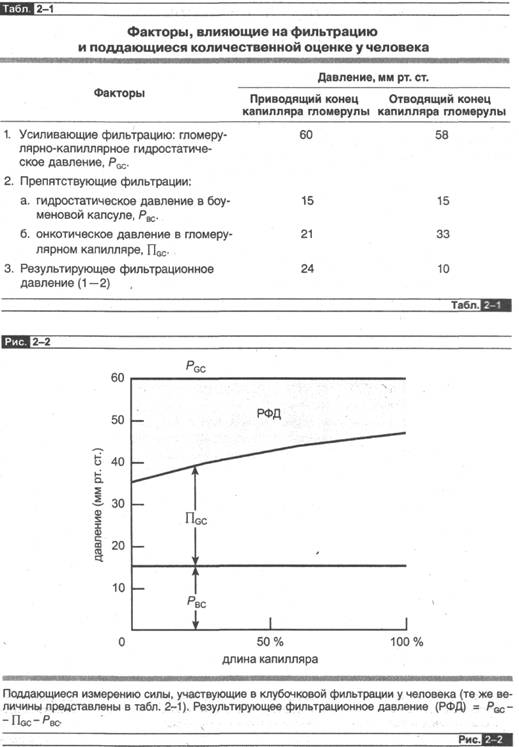
что соответствующие показатели у человека, вероятно, сходны с теми, что получены у собаки. Эти величины представлены в табл. 2-1 и на рис. 2-2 вместе с величинами гломерулярно-капиллярногЪ онкотического давления.
Известно, что гидростатическое давление меняется очень незначительно в различных отделах клубочка; это происходит потому, что самая большая величина поперечной площади сечения гломерулы создает только весьма незначительное сопротивление движению жидкости.
Очень важно обратить внимание, что онкотическое давление в капиллярах гломерулы меняется совсем немного по длине гломерулы; поскольку фильтрат практически лишен белка, то в ходе фильтрационного процесса осуществляется перенос воды, но не белка из плазмы, тем самым увеличивается концентрация белка и отсюда онкотическое давление в непрофильтровавшейся плазме, оставшейся в гломерулярных капиллярах4. В значительной степени из-за этого существенного увеличения онкотического давления чистое фильтрационное давление снижается существенно по направлению от начала к кошту гломерулярных. капилляров, и средняя величина его примерно равна 17 мм рт. ст.5 То, что такой величины давления достаточно, чтобы обеспечить фильтрацию 180 л жидкости в сутки, связано в основном с тем фактом, что гидравлическая проницаемость и, следовательно, К/ в гломерулярных капиллярах на несколько порядков выше, чем во внепочечных капиллярах.
Величина скорости клубочковой фильтрации не является постоянной и может существенно колебаться при различных физиологических состояниях и при патологии. Если все остальные факторы остаются неизменными, любая динамика величин показателей Щ, Рсо Рвс и Пес будет также вести к изменению величины , скорости клубочковой фильтрации. В то же время «все другие факторы» также не остаются постоянно неизменными, и поэтому другие одновременно протекающие события могут противодействовать влиянию специфического фактора, который учитывался в анализе. Фраза «стремится к...» в последующей дискуссии отражает этот факт.
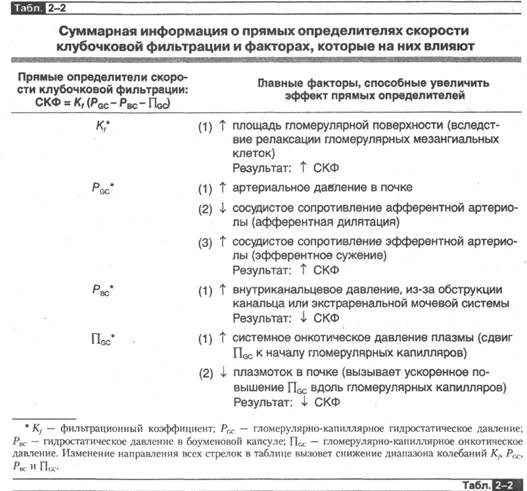
В табл. 2-2 представлена суммарная информация о материале^ описанном в оставшейся части данного раздела. По сути данный материал дает повод для анализа в попытке понять, как патология или вазоактивные химические мессендже-ры и лекарства изменяют скорость клубочковой фильтрации.
В этом контексте следует отметить, что главная причина уменьшения скорости клубочковой фильтрации при патологии почек не изменение указанных параметров в пределах отдельного нефрона, а гораздо более простая — уменьшение числа функционирующих нефронов.
К f . Изменение К f может быть вызвано патологией клубочков или лекарствами, но этот показатель также контролируется в ходе обычных физиологических процессов целой серией химических мессенджеров. Механизм неизвестен, но одна вероятная гипотеза заключается в том, что эти мессенджеры вызывают сокращение гломерулярных мезангиальных клеток, что в результате уменьшает площадь гломерулярной поверхности и К f . Это уменьшение величины Kf влечет за собой снижение СКФ 6.
| 47 |
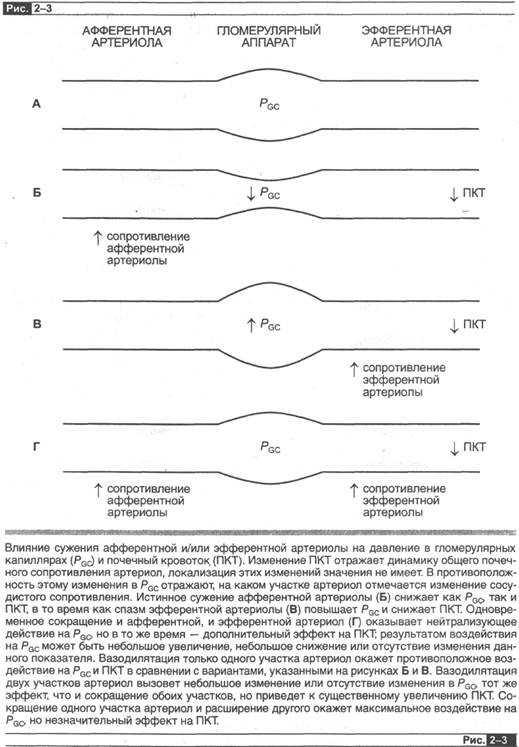
р g с» Клубочково-капиллярное давление отражает взаимодействие почечного артериального давления, сосудистого сопротивления афферентной- артериолы (КА) и сопротивления эфферентной артериолы (КЕ) (рис. 2-3). Первое (не показано на рис. 2-3) изменение почечного артериального давления будет вызывать уменьшение клубочково-капиллярного давления в одноименном направлении (но по соображениям, описанным позднее в этой главе, данная динамика будет минимальной). Второе (рис. 2-ЗБ) при каждом данном значении почечного артериального давления увеличение показателя КА (благодаря спазму афферентной артериолы) будет сопровождаться снижением клубочково-капиллярного давле-ния, просто вызывая большее падение давления между почечными артериями и гломерулярными капиллярами. Напротив, снижение КА (в результате расширения афферентной артериолы) будет весТи к росту клубочково-капиллярного давления. Третье (рис. 2-ЗВ) и более сложное для зрительного восприятия — это на- блюдение, что изменение в КЕ также вызывает динамику клубочково-капилляр-
48
Почечный кровоток и клубочковая фильтрация
|
|
1ломерулярная фильтрация
49
ного давления, но эти изменения противоположны тем, что вызваны изменением КА. Таким образом, увеличение КЕ (благодаря сокращению эфферентной артерио-лы) вызывает повышение клубочково-капиллярного давления. Так происходит, поскольку эфферентная артериола располагается после гломерулы, так что сужение эфферентной артериолы вызывает задержку крови в гломерулярных капиллярах, увеличивая клубочково-капиллярное давление. Аналогично снижение КЕ (в результате расширения эфферентной артериолы) снижает клубочково-капиллярное давление. Также будет ясно, что когда КА и К.Е будут изменяться одновременно и однонаправленно (т. е. оба увеличиваться или уменьшаться), то это вызывет про тивоположное воздействие на клубочково-капиллярное давление (рис. 2-ЗГ). Когда они изменяются в противоположных направлениях, они оказывают аддитивное воздействие на клубочково-капиллярное давление.
Теперь давайте вспомним факторы, регулирующие почечный кровоток, и посмотрим, насколько противоположным образом ситуация меняется для данного параметра; для ПК изменение КА и КЕ в одном направлении вызывает аддитивное воздействие на почечный кровоток, в то время как изменение в противоположных направлениях ведет к обратному эффекту.
рво Изменение величины давления в боуменовой капсуле обычно имеет очень небольшое физиологическое значение. Главный причиной в патологии повышения гидростатического давления в боуменовой капсуле является обструкция в любом участке канальца или во внешней части мочевой системы (например, в мочеточнике). Непроходимость вызывает увеличение внутриканальцевого давления на всем протяжении проксимальнее зоны препятствия, на всем пути обратно к капсуле Боумена. В результате величина скорости клубочковой фильтрации снижается.
Пес* Онкотическое давление плазмы в начале гломерулярных капилляров является, безусловно, просто онкотическим давлением в плазме артериального русла. Соответственно снижение концентрации белка в плазме артериальной крови, как это бывает, например, при патологии печени, будет понижать онкотическое давление в артериальной крови и увеличивать скорость клубочковой фильтрации, в то время как увеличение артериального онкотического давления будет снижать скорость клубочковой фильтрации.
Теперь вспомним (табл. 2-1 и рис. 2-2), что клубочково-капиллярное онкотическое давление идентично артериальному онкотическому давлению только в самом начале гломерулярных капилляров; затем этот показатель прогрессивно увеличивается по мере продвижения по гломерулярным капиллярам, в то время как безбелковая жидкость фильтруется из капиллярного русла, оставляя в последнем сконцентрированный белок. Это означает, что чистое фильтрационное давление и отсюда фильтрация прогрессивно уменьшаются по мере продвижения вдоль капилляров. Сортветственно все, что вызывает крутой подъем показателя клубочково-капиллярного онкотического давления будет снижать среднее результирующее фильтрационное давление и тем самым-скорость клубочковой фильтрации.
Такая ситуация возникает, когда почечный плазмоток (ППТ) -невелик. Нетрудно убедиться, что фильтрация заданного объема жидкости из небольшого об-
50
Дата: 2018-09-13, просмотров: 823.