| Ox/Red система | К+/К | Cu2+/ Cu | 2H2О/Н2,2ОН‾ | 2Н+/Н2 | Cl2 /2Cl‾ | О2,4Н+/2Н2О |
| φ0Ox/Red, В | -2,91 | +0,34 | -0,83 | 0,00 | +1,36 | +1,50 |
Процессы окисления кислорода ( 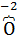 ) из кислородсодержащих анионов таких как: (NO3)‾ , (SO4)2-, (SO3)2-, (РO4)3- и т.д. протекают при потенциалах анода более 3-х вольт (φ>3,В). При электролизе водных растворов такие анионы не окисляются и не видоизменяются, а только накапливаются ванодном пространстве.
) из кислородсодержащих анионов таких как: (NO3)‾ , (SO4)2-, (SO3)2-, (РO4)3- и т.д. протекают при потенциалах анода более 3-х вольт (φ>3,В). При электролизе водных растворов такие анионы не окисляются и не видоизменяются, а только накапливаются ванодном пространстве.
Процессы на катоде
Согласно правилу катодного восстановления при электролизе данной системы на катоде могут протекать в порядке очереди три процесса.
Процесс 1: Cu2+ 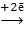 Cu.
Cu.
При уменьшении концентрации ионов Cu2+ в прикатодном пространстве потенциал катода смещается в отрицательную область, и при достижении значения потенциала катода φкатод = 0, В, в системе начинается восстановление ионов Н+.
Процесс 2: 2 Н+ 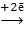 Н2 ↑.
Н2 ↑.
Восстановление ионов Н+ сопровождается увеличением значения рН раствора у катода. Потенциал восстановления водорода можно рассчитать с помощью значение рН по уравнению Нернста: φ(2H2О/Н2,2ОН‾) = −0,059 рН. Т.к. для чистой воды рН = 7, то потенциал восстановления водорода из воды равен −0,41, В. Восстановления водорода из воды является последним возможным процессом в данной системе.
Процесс 3: 2H2O 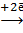 Н2 ↑ + 2ОН‾ .
Н2 ↑ + 2ОН‾ .
Химически активные металлы, у которых стандартный потенциал восстановления менее −1,5 вольта, из водных растворов не восстанавливаются, например, К+.
В результате электролиза продуктами катодных процессов будут являться:
1. Металлическая медь (Cu), которая откладывается на поверхности катода;
2. Водород (Н2 ↑) газообразный;
3. В катодном пространстве, в течении электролиза накапливается щелочь калия (КОН).
Процессы на аноде
Согласно правилу анодного окисления при электролизе данной системы на аноде могут протекать в порядке очереди два процесса.
Процесс 1: 2 Cl‾ 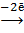 Cl2 ↑ (процесс окисления с минимальным потенциалом).
Cl2 ↑ (процесс окисления с минимальным потенциалом).
По мере уменьшения количества хлорид ионов в пространстве у анода, потенциал анода смещается в положительную область и при достижении потенциала анода ≈ +1,5 вольт начинается процесс электрохимического разложения воды с окислением кислорода из неё.
Процесс 2: 2 H2О 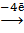 О2↑ + 4 Н+ .
О2↑ + 4 Н+ .
Ионы (NO3)‾ и (SO4)2- не окисляются, а только накапливаются в анодном пространстве. В результате электролиза продуктами анодных процессов будут являться:
1) газообразный хлор, Cl2;
2) газообразный кислород, О2;
3) в анодном пространстве, в течении электролиза накапливаются серная и азотная кислоты (H2SO4, НNO3).
Количественно процесс электролиза описывается законами Фарадея.
I Закон Фарадея
Масса вещества, претерпевшая превращение на электроде, прямо пропорциональна количеству прошедшего через систему электричества:
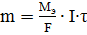 , (81)
, (81)
где: М(Э) – молярная масса эквивалента электрохимически преобразующегося вещества (г/моль); I – сила тока (A); F – число Фарадея, равное 96500 Кл/моль; τ – время в секундах (c).
II Закон Фарадея
При прохождении одинакового количества электричества через растворы или расплавы различных электролитов массы веществ, претерпевших превращение на электродах, пропорциональны молярным массам их эквивалентов.
Например, для системы электродов, находящихся в одном электролизёре отношение масс веществ, превращенных на катоде и на аноде равно отношению молярных масс их эквивалентов:
m(вещества на катоде)/ m(вещества на аноде)= М(Э)( вещества на катоде)/ М(Э)( вещества на аноде).
Электролиз в промышленности
Важнейшее применение электролиз находит в металлургической, химической промышленности и в гальванотехнике.
В металлургической промышленности электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы (Al, Mg, Na, Li, Be, Ca) и некоторые их сплавы.
Электролитическое выделение металла из раствора называется электроэкстракцией.
Руда или обогащенная руда (концентрат) подвергается обработке определенными реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор направляют на электролиз. Металл, выделяющийся на катоде, в большинстве случаев характеризуется высокой чистотой. Этом методом получают Zn, Cu, Cd.
Электрохимическому рафинированию металлы подвергают для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для обработки продукты.
Из металла, подлежащего очистке, отливают пластины и помещают их в качества анодов в электролизер. При прохождении электрического тока металл анода подвергается растворению, а затем восстанавливается на катоде, образуя компактный осадок чистого металла.
К гальванотехнике относятся гальваностегия и гальванопластика.
Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, а также в декоративных целях.
Важнейшими из гальванотехнических процессов являются хромирование, цинкование и никелирование.
Сущность гальванического нанесения покрытий состоит в том, что хорошо очищенную и обезжиренную деталь, подлежащую защите, погружают в раствор, содержащий соль того металла, которым её необходимо покрыть, и присоединяют в качестве катода к цепи постоянного тока. При пропускании тока на детали осаждается слой защищающего металла.
Гальванопластикой называются процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путём гальванопластики изготавливают матрицы для прессования различных изделий, матрицы для теснения кожи и бумаги, печатные радиотехнические схемы, типографские клише и др.
6.3.3. Химические источники электрического тока (ХИЭТ)
Все источники электрической энергии, работа которых основана на использовании электрохимических процессов, делятся на два типа.
1. Элементы (гальванические элементы) – однократного действия. Конструктивное оформление и размеры таких элементов самые различные (например, стаканчиковые, галетные, пуговичные и т.д.). Они удобны в использовании, но срок действия их ограничен. Самым известным первичным элементом, который в данное время широко используется а различных переносных устройствах является элемент Лекланше или марганцево-цинковый элемент.
Анодной системой в этом элементе является цинк в контакте с пастой хлористого аммония; катодная система - это пакет из диоксида марганца (активное вещество − деполяризатор) и запрессованого в нем угольного (графитового) стержня, как инертного электронопроводящего вещества. Процессы, протекающие при работе данного элемента:
| 1 |
 2Zn2+
2Zn2+
| 1 |
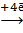 4MnO(OH)
4MnO(OH)
Внутренняя цепь: электролит – паста NH4Cl взаимодействует с возникающими ионами цинка 2Zn2+ + 4NH4Cl→[Zn(NH3)4]Cl2 ↓+ ZnCl2+4H+, ионы водорода по внутренней цепи поступают в катодное пространство и участвуют в процессе восстановления марганца.
Токообразующая реакция: Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)4]Cl2 + 2MnO(OH).
Электрохимическая схема элемент:
(−)А Zn│[Zn(NH3)4]Cl2, NH4Cl│MnO(OH), MnO2(СГРАФИТ) К (+).
2. ХИЭТ многократного действия – аккумуляторы.
Аккумуляторы - это гальванические элементы, которые можно полностью регенерировать, пропуская через них ток от внешнего источника. По типу используемого во внутренней цепи электролита аккумуляторы делятся на кислотные и щелочные.
а) Кислотные аккумуляторы.
В различных областях техники широко применяются кислотные свинцовые аккумуляторы. Конструктивно они представляют собой устройства из набора свинцовых пластин ячеистой структуры. В ячейки запрессовывается смесь оксида свинца с глицерином. Пластины собираются в батареи и погружаются в раствор H2SO4 , плотность которого (ρ) равна 1,27 г/мл (электропроводность раствора при данном значении плотности максимальна). При помещении пластин в раствор кислоты в ячейках пластин вместо оксида образуется сульфат свинца РƅSO4.
При зарядке аккумулятора на часть пластин батареи подается ток от внешнего источника катодного направления, а на другую часть пластин – анодного направления.
Процессы, идущие при зарядке аккумулятора:
(−) Катод: 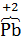 SO4
SO4 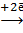
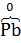 (активное вещество – губчатый свинец) +
(активное вещество – губчатый свинец) + 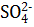
(+) Анод: 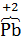 SO4 + 2Н2О
SO4 + 2Н2О 
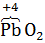 (активное вещество) +
(активное вещество) + 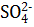 +4Н+.
+4Н+.
2PbSO4 + 2 Н2О→ 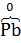 (активное вещество) +
(активное вещество) + 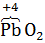 (активное вещество) + 2 H2SO4
(активное вещество) + 2 H2SO4
Электрохимическая схема заряженного аккумулятора:
(−) Анод Рƅ, 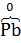 (губчатый свинец)│ H2SO4, Н2О │
(губчатый свинец)│ H2SO4, Н2О │ 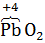 (активное вещество), Рƅ (+) Катод.
(активное вещество), Рƅ (+) Катод.
Процессы, идущие при работе (разрядке) аккумулятора:
(−) Анод 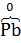 (губчатый свинец) +
(губчатый свинец) + 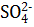
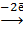
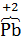 SO4
SO4
(+) Катод 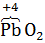 (активное вещество) +
(активное вещество) + 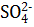 +4Н+
+4Н+ 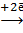
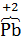 SO4 + 2Н2О
SO4 + 2Н2О
Рƅ (губчатый свинец) + РƅО2(активное вещество) + 2 H2SO4 → 2 РƅSO4 + 2 Н2О.
Суммарная токообразующая реакция
Преимущества свинцового аккумулятора – большая электрическая ёмкость, устойчивость в работе, большое количество циклов разрядка – зарядка (≈ 500 циклов). Недостатки – большая масса.
б) Щелочные аккумуляторы.
В качестве электролита в таких аккумуляторах используют раствор едкого калия (20 %), в который добавлен LiOH, увеличивающий срок эксплуатации щелочного аккумулятора. Наиболее часто используемые щелочные аккумуляторы это кадмиево-никелевые или железо-никелевые аккумуляторы. Активным веществом положительных электродов в таких аккумуляторах является гидроксид никеля (III) NiOOH, с добавками графита и оксида бария. Каждая из добавок улучшает качество работы аккумулятора. Графит увеличивает электропроводность электрода, а оксид бария увеличивает срок работы аккумулятора. Если батарея никель-кадмиевая, то отрицательный электрод состоит из смеси порошков железа и кадмия. В железо-никелевом аккумуляторе активным веществом отрицательных электродов является порошок, приготовленный из специального электрохимически активного железа.
Электрохимическая схема заряженного кадмиево-никелевого аккумулятора:
(−) Анод (Fe), Cd │KOH, LiOH, H2O │NiOOH, (Fe) (+) Катод
При работе никель-кадмиевого аккумулятора на электродах идут процессы:
(−) Анод 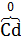 + 2OH−
+ 2OH− 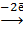
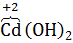
(+) Катод 2 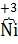 OOH + 2H2O
OOH + 2H2O 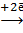 2
2 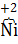 (OH)2 + 2OH−
(OH)2 + 2OH−
Cd +2NiOOH + 2 H2O = Cd(OH)2 + 2Ni(OH)2.
Суммарная токообразующая реакция
При зарядке аккумулятора электрохимические процессы на его электродах идут в обратном направлении.
3. Топливные элементы.
Топливный элемент (ТЭ) – это химический источник тока (ХИТ), в котором электрическая энергия образуется в результате химической реакции между восстановителем (например: Н2, N2Н2 и др. ) и окислителем (например: О2, Cl2 и др.) непрерывно и раздельно поступающими в газовые камеры элемента. Конструктивной особенностью ТЭ является использование уникальных электродов. Химические реакции в топливном элементе идут на специальных высоко пористых электронопроводящих электродах (как правило, платиновых с добавками палладия и кальция), разделенных электролитом, который содержится в пористой стабилизированной матрице, например, раствором щелочи KOH (≈40%) с добавкой LiOH.
| КОН LiOH H2O |
| nē |
| nē |
| H2 |
| H2 (ОСТАТОК) |
| О2 |
| О2 ОСТАТОК |
| (−)А |
| (+)К |
| Рис. 18. Схема топливного элемента |
Процессы, идущие при работе топливного элемента:
(−) Анод: 2H2 + 4OH− 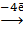 4H2O
4H2O
(+) Катод: O2 + 2H2O 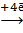 4OH−
4OH−
2H2 + O2 = 2H2O
Суммарная токообразующая реакция.
Продукты реакции непрерывно выводятся из топливного элемента.
Электрохимическая схема топливного элемента:
А(–) (Pt) H2 │ KOH, LiOH, H2O │ O2 (Pt) (+)К.
Таким образом, в результате протекания пространственно разделенных полуреакций окисления топлива и восстановление окислителя во внешней цепи возникает постоянный электрический ток, то есть происходит прямое преобразование химической энергии в электроэнергию. Топливные элементы высокоэффективны и не производят большого количества парниковых газов, работают бесшумно и без вибрации. Единственным продуктом выброса при работе топливных элементов являются вода в виде пара. Топливные элементы собираются в сборки, а затем в отдельные функциональные модули. ТЭ являются основой при создании стационарных электростанций на топливных элементах (как для централизованного, так и для децентрализованного энергоснабжения), энергетических установок транспортных средств, а также источников питания различных мобильных устройств. Один из основных недостатков топливных элементов на сегодняшний день — их относительно высокая стоимость.
6.3.4. Коррозия металлов
Коррозией называют процесс самопроизвольного окисления металла в результате его физико-химического взаимодействия с окружающей средой (ΔG < 0).
Типы коррозионных процессов.
I. Химическая коррозия в средах, не проводящих электрический ток (газовая коррозия в среде сухих агрессивных газов, коррозия в неэлектролитах, например, в нефти и нефтепродуктах). Химической коррозии подвержены детали и узлы механизмов, работающих при высоких температурах, двигатели внутреннего сгорания и ракетные двигатели, химическое оборудование, механизмы нефтедобывающих и нефтеперерабатывающих производств.
II. Более распространен второй тип коррозии, которая называется электрохимической. К такому типу коррозии относятся все случаи коррозии во влажной среде, имеющей ионную проводимость, в атмосфере влажного воздуха, в почве.
Окисление металла при коррозии предполагает наличие в окружающей среде окислителей (при электрохимической коррозии их называют деполяризаторы). Таблица 13
Виды деполяризаторов
| № пп | Процесс восстановления окислителя | Потенциал восстановления окислителя, φOx/Red, В | рН среды |
| 1 | О2 +2H2O 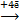 4ОН‾ 4ОН‾
| +0,816 | рН ≥ 7 |
| 2 | О2 +4H+ 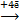 2H2O 2H2O
| +1,229 | рН < 7 |
| 3 | 2Н+ 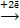 Н2 Н2
| φ = − 0,059 рН | рН << 7 |
Электрохимическая коррозия это электрохимический процесс, идущий на поверхности раздела фаз металл – ионопроводящая среда, имеющий два механизма протекания: гетерогенный и гомогенный. Для гетерогенного механизма необходимым условием, определяющим скорость протекания коррозии, является наличие на поверхности раздела металл – ионопроводящая среда гетерогенных участков с величиной потенциала отличной от потенциала основного металла. Из-за электронной проводимости металла и ионной проводимости среды эти электрохимические гетерогенные участки замкнуты накоротко на внешнюю (через металл) и внутреннюю (через ионопроводящую среду) цепь. При этом на поверхности металла возникает множество микрогальванических элементов, результатом работы которых и является коррозия. Как пример можно рассмотреть процессы контактной электрохимической коррозии стальных (основной металл – железо) трубопроводов, подсоединённых к медным теплообменникам (рис. 19). Т.к. кристаллические решетки металлов замкнуты накоротко, то металл более химически активный (с меньшим значением потенциала) поляризуется анодно, а металл с большим значением потенциала – катодно. В процессе коррозии с анодных участков на катодные происходит перемещение электронов, т.е. течет электрический ток. На анодных участках идет растворение (окисление) металла, а на катодных − ассимиляция избыточных электронов какими-либо деполяризаторами, в данном случае это кислородный деполяризатор. Как правило, продуктами электрохимической коррозии с кислородной деполяризацией являются оксидные или гидроксидные соединения, причем, такие продукты прочно удерживаются на металлической поверхности адсорбционными силами. Электрохимическая микрогетерогенность металлической поверхности вызывается загрязнениями основного металла более положительными (по потенциалу) включениями металлическими и неметаллическим, но обладающими электронной проводимостью.
| Микроанод Fe |
| n( −2ē) |
| n Fe |
| φо (Fe2+/ Fe) = −0,44 B |
| n Fe2+ |
| n Fe2+ + 2 n ОН‾→ n Fe(ОН)2 4n Fe(ОН)2+ n О2 +2 n H2O →4n Fe(ОН)3 Продукт коррозии – ржавчина |
n О2 +2 n H2O 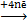 4 n ОН‾ 4 n ОН‾
|
| Рис.19 Схема работы микрогальванического элемента на поверхности металла |
| микрокатод Cu |
| φо (Cu 2+/ Cu) = +0,34 B |

Например, продукты окисления металлов в процессе коррозии могут играть роль катодных участков, при этом микрогетерогенность металлической поверхности возрастает и скорость коррозии увеличивается.
В случае гомогенного механизма коррозии металлов катодные и анодные процессы могут протекать на одном и том же участке поверхности раздела, чередуясь во времени. По такому механизму подвергаются коррозии наиболее чистые металлы. В этом случае неоднородность поверхности металла возникает при наличии разнородных атомов в кристаллической решетке металла, различия активностей отдельных атомов на поверхности вследствие неодинаковой топографии в кристаллической решетке.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
Наиболее часто встречающиеся виды коррозии металлов:
1) местная (локальная или неравномерная) коррозия охватывает отдельные участки поверхности металла, данный вид коррозия может наблюдаться в виде отдельных пятен, не сильно углубленных в толщу металла; язв - разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл;
2) сплошной или равномерной, называется коррозия, охватывающая всю поверхность металла и протекающая с одинаковой скоростью по всей поверхности металла;
3) подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла; продукты коррозии оказываются сосредоточенными в полостях металла, этот вид коррозии вызывает вспучивание и расслоение металлических изделий;
4) атмосферная коррозия — это коррозия металлов во влажной атмосфере Земли, как правило, с кислородной деполяризацией;
5) межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы;
6) контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Существуют и другие виды коррозии (почвенная, щелевая, радиационная и др.).
Все способы и методы борьбы с коррозией можно разделить на три группы.
I. Воздействие на металлическую систему:
а) использование наиболее чистых металлов;
б) использование коррозионно стойких сплавов.
II. Воздействие на окружающую среду и изоляция от неё:
а) удаление окислителей из среды (возможно только в замкнутых циклах водоподготовки), активаторов коррозии (СО2, SO2, Cl−, F− и т.д. ) и электролитов;
б) нанесение различных изоляционных покрытий на металл (лаков, красок, полимеров, смазок, пассивирующих металл пленок, покрытий металла коррозионно стойким металлом);
в) использование ингибиторов коррозии.
III. Воздействие на структуру двойного электрического слоя на межфазной границе металл − окружающая среда (электрохимические метода защиты):
а) катодная защита − снижение скорости коррозии наложением потенциала катодного направления от внешнего источника электрического тока;
б) протекторная защита − разновидность катодной защиты, при использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом, т.е. искусственно создается гальвано пара, в которой идет разрушение не конструкции, а протектора. Со временем протектор разрушается и его заменяют на новый;
в) анодная защита, при которой наложение потенциала анодного направления от внешнего источника электроэнергии смещает потенциал защищаемого металла в более положительную сторону до достижения пассивного устойчивого состояния системы.
Примеры решения типовых задач
Пример 1. Возможно ли в стандартных условия самопроизвольное протекание окислительно-восстановительного процесса между ионами Sn2+ и Ce4+, если стандартные потенциалы соответствующих систем имеют значения
а) φо (Sn4+/ Sn2+) = +0,15 В; б) φо (Ce4+/ Ce3+) = +1,74 В?
Дано:
Системы:
а) Sn4+/ Sn2+
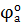 = +0,15 В
б) Ce4+/ Ce3+) = +0,15 В
б) Ce4+/ Ce3+)
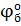 = +1,74 В = +1,74 В
| Решение
1) Термодинамическим условием самопроизвольного протекания окислительно-восстановительной реакции в прямом направлении является отрицательное значение изменения энергии Гиббса ΔG<0, которое определяется электрической работой (А) по переносу заряда (n∙ F) в пространстве: ΔG = –А.
2) Работу (А) по переносу заряда в пространстве можно рассчитать, используя максимальную разность потенциалов между точками переноса заряда или ЭДС (Е, В): А = n∙ F∙ E,
Е = φокислитель – φвосстановитель,
где: n – количество передаваемых в элементарном процессе электронов; F – постоянная Фарадея (96500 Кл/моль); E – максимальная разность потенциалов между точками переноса заряда (электродвижущая сила). Отрицательное значение изменения изобарно-изотермического потенциала (ΔG < 0) может быть только при условии: φокислитель > φвосстановитель.
3) Т.к. 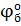 > > 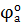 , следовательно окислитель содержится в системе б) (это ионы Ce4+), а восстановитель находится в системе а) (это ионы Sn2+). Процессы окисления и восстановления; , следовательно окислитель содержится в системе б) (это ионы Ce4+), а восстановитель находится в системе а) (это ионы Sn2+). Процессы окисления и восстановления;
 Ce3+ Ce3+
 Sn4+ Sn4+
суммарное уравнение: 2Ce4++ Sn2+= 2Ce3++ Sn4+ Суммарное молекулярное уравнение: SnCl2 + 2СеCl4= SnCl4 + 2CeCl3. 4) Рассчитываем стандартную ЭДС: Ео = Ео = 1,74 − 0,15 = 1,59 В; рассчитываем энергию Гиббса: ΔG = − n∙ F∙ E, ΔG = −2∙96500∙1,59 = −306870 Дж/моль = −306,87 кДж/моль. | |||
| Найти: ΔG ? | Ответ: т.к. ΔG< 0 (−306,87 кДж/моль), следовательно, данный процесс возможен в стандартных условиях. |
Пример 2. Покажет ли амперметр ток во внешней цепи гальванического элемента (при стандартных значениях температуры и давления), в основе работы которого лежит суммарная токообразующая реакция: Pb + Cu2+ 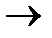 Pb2++Cu. Концентрация ионов свинца в растворе, со свинцовым электродом составляет: [Pb2+] = 10-2 моль/л, а концентрация ионов меди в растворе с медным электродом равна: [Cu2+] = 10-1 моль/л. Приведите схему гальванического элемента и расставьте полюсность электродов. Значения стандартных потенциалов соответствующих электрохимических систем см. в справочнике. Рассчитайте константу равновесия токообразующей реакции.
Pb2++Cu. Концентрация ионов свинца в растворе, со свинцовым электродом составляет: [Pb2+] = 10-2 моль/л, а концентрация ионов меди в растворе с медным электродом равна: [Cu2+] = 10-1 моль/л. Приведите схему гальванического элемента и расставьте полюсность электродов. Значения стандартных потенциалов соответствующих электрохимических систем см. в справочнике. Рассчитайте константу равновесия токообразующей реакции.
Дано:
Системы:
а) Pb2+/ Pb
б) Cu2+/Cu
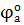 = − 0,13 В = − 0,13 В
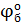 = +0,34 В
[Pb2+] = 10-2 моль/л
[Cu2+] = 10-1 моль/л = +0,34 В
[Pb2+] = 10-2 моль/л
[Cu2+] = 10-1 моль/л
| Решение
1) Исходя из значений стандартных электродных потенциалов, 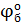 > > 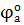 , можно предположить, что полуэлемент (а) является в данном гальваническом элементе анодной системой , а полуэлемент (б) – катодной. При этом на электродах будут протекать процессы:
(окисление на аноде) (А) Pb , можно предположить, что полуэлемент (а) является в данном гальваническом элементе анодной системой , а полуэлемент (б) – катодной. При этом на электродах будут протекать процессы:
(окисление на аноде) (А) Pb 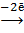 Pb2+ Pb2+
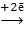 Cu Cu
токообразующая реакция: Pb + Cu2+
2) Рассчитываем потенциалы электродов, используя формулу Нернста, при данных концентрациях электродных растворов:
3) Рассчитываем ЭДС (Е, В) элемента и энергию Гиббса токообразующей реакции: Е = ΔG = − n∙ F∙Е, ΔG = − 2∙96500∙0,50 = − 96500 Дж/моль = − 96,5 кДж/моль Схема гальванического элемента: (А) (–)Pb │ Pb2+ (10-2 моль/л)║ Cu2+ (10-1 моль/л)│ Cu(+)(К). 4) Значение константы равновесия находим по формуле: К Ox/Red = 10 Е К Ox/Red = 10 Большое значение константы равновесия говорит о том, что токообразующая реакция практически протекает только в прямом направлении. | |
| Найти: ΔG ? | Ответ: т.к. Е >0 (+0,50 В) и ΔG< 0 (−96,5 кДж/моль) следовательно, данный гальванический элемент находится в рабочем состоянии и во внешней цепи наблюдается электрический ток. |
Пример 3. Будут ли отличаться по составу продукты электролиза расплава и водного раствора хлорида кальция, если при электролизе использовались графитовые электроды?
| Дано: Системы: 1) расплав СaCl2; 2) водный раствор СaCl2; электроды инертные | Решение
При электролизе на катоде происходит процесс восстановления вещества за счет электронов из внешней электрической цепи, а на аноде происходит процесс окисления – отдача электронов в цепь.
1) При прохождении тока через расплав хлорида кальция катионы кальция Са2+ движутся к отрицательно-заряженному электроду (катоду), на котором восстанавливаются. Хлорид ионы Cl‾ перемещаются к положительно заряженному электроду (аноду) и, отдавая электроны, окисляются.
Электролиз расплава хлорида кальция можно представить схемой:
CaCl 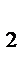 = Ca = Ca 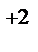 + 2Cl‾
(-) катод | Ca2+ 2Cl‾| анод (+)
К: Са2+ + 2Cl‾
(-) катод | Ca2+ 2Cl‾| анод (+)
К: Са2+ 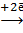 = Са А: 2Cl‾ = Са А: 2Cl‾ 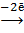 = Cl = Cl  CaCl2 (РАСПЛАВ) → Сa + Cl2↑
Продуктами электролиза системы 1) являются металлический кальций и газообразный хлор.
2) На ход электролиза из водных растворов большое влияние оказывают растворитель и материал электродов. При выборе наиболее вероятного процесса на катоде и аноде необходимо следовать правилам катодного восстановления и анодного окисления. Т.к. материалом анода является графит, который электролитически не окисляется, то такой электрод называется инертным.
Электролиз водного раствора хлорида кальция можно представить схемой:
Процесс диссоциации в водном растворе: CaCl2 = Ca2++ 2Cl‾
(-) катод Ca2+ Cl‾ анод (+)
H2O H2O
CaCl2 (РАСПЛАВ) → Сa + Cl2↑
Продуктами электролиза системы 1) являются металлический кальций и газообразный хлор.
2) На ход электролиза из водных растворов большое влияние оказывают растворитель и материал электродов. При выборе наиболее вероятного процесса на катоде и аноде необходимо следовать правилам катодного восстановления и анодного окисления. Т.к. материалом анода является графит, который электролитически не окисляется, то такой электрод называется инертным.
Электролиз водного раствора хлорида кальция можно представить схемой:
Процесс диссоциации в водном растворе: CaCl2 = Ca2++ 2Cl‾
(-) катод Ca2+ Cl‾ анод (+)
H2O H2O
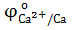 = −2,9 B = −2,9 B 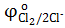 = +1,36 B = +1,36 B
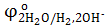 = −0,83 B = −0,83 B 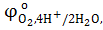 = +1,5 B
На катоде разряжается самый сильный окислитель (с максимальным значением потенциала), на аноде – самый сильный восстановитель (с минимальным значением потенциала):
К: 2Н2O = +1,5 B
На катоде разряжается самый сильный окислитель (с максимальным значением потенциала), на аноде – самый сильный восстановитель (с минимальным значением потенциала):
К: 2Н2O 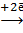 = H2↑ + 2OH‾ А: 2Cl‾ = H2↑ + 2OH‾ А: 2Cl‾ 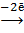 = Cl2↑
2Cl‾+ 2H2O = Cl2↑ + H2↑ + 2OH‾.
Молекулярное уравнение электролиза: CaCl2 + 2H2O = Cl2 + H2 + Ca(OH)2.
Продуктами электролиза системы 2) являются газообразный водород и в прикатодном пространстве электролизёра накапливается раствор КОН; на аноде выделяется газообразный хлор. = Cl2↑
2Cl‾+ 2H2O = Cl2↑ + H2↑ + 2OH‾.
Молекулярное уравнение электролиза: CaCl2 + 2H2O = Cl2 + H2 + Ca(OH)2.
Продуктами электролиза системы 2) являются газообразный водород и в прикатодном пространстве электролизёра накапливается раствор КОН; на аноде выделяется газообразный хлор.
|
| Найти: продукты электролиза систем 1), 2) | Ответ: продукты электролиза расплава и водного раствора хлорида кальция различаются |
Пример 4. Как изменилась масса анода при электролизе водного раствора сульфата никеля с электродами из никеля, если через этот электролит пропустили ток в 0,5 A в течение 5 ч?
| Дано: Система: NiSO4, H2O Материал электродов Ni металл I = 0,5 A τ = 5 ч М(Ni)= =59 г/моль F = 96500 Кл/моль z =2 | Решение
1) Процесс диссоциации соли в воде: NiSO4 = Ni2+ + SO42‾ .
Приводим схему электролиза водного раствора сульфата никеля с растворимыми никелевыми электродами:
(−) катод Ni+2 SO 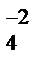 анод (+)
H2O H2O
Ni анод (+)
H2O H2O
Ni
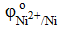 = − 0,25 B = − 0,25 B 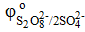 = +2,10 B = +2,10 B
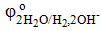 = −0,83 = −0,83 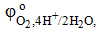 = +1,5 B = +1,5 B
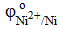 = − 0,25 B
Самый вероятный восстановитель (c минимальным потенциалом окисления) на аноде это металлический никель, т.е. материал анода, на катоде восстанавливается самый сильный окислитель Ni2+ (с максимальным потенциалом восстановления).
Процессы электролиза:
A: Ni = − 0,25 B
Самый вероятный восстановитель (c минимальным потенциалом окисления) на аноде это металлический никель, т.е. материал анода, на катоде восстанавливается самый сильный окислитель Ni2+ (с максимальным потенциалом восстановления).
Процессы электролиза:
A: Ni 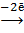 = Ni+2
K: Ni+2 = Ni+2
K: Ni+2 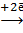 = Ni
Используя закон Фарадея, рассчитываем массу никеля, растворившегося на аноде:
m (Ni) = = Ni
Используя закон Фарадея, рассчитываем массу никеля, растворившегося на аноде:
m (Ni) = 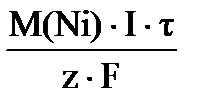 ; m (Ni) = ; m (Ni) = 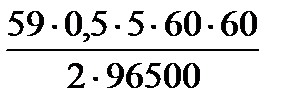 = 2,75 г.
∆mанода = m (Ni) = 2,75 г. = 2,75 г.
∆mанода = m (Ni) = 2,75 г.
|
| Найти: ∆mанода | Ответ: масса анода уменьшилась на 2,75 г |
Пример 5. Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев приведите уравнения электрохимической коррозии во влажной среде, насыщенной кислородом. Приведите схемы работающих гальванических элементов.
Дано:
Система:
Fe | Fe2+
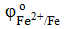 =
−0,44 B =
−0,44 B
| Решение
Протекторная защита заключается в присоединении к защищаемому металлическому изделию металла с более отрицательным значением стандартного электродного потенциала φо, т.е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий: а) 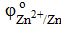 = −0,76 B; б) = −0,76 B; б) 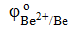 = −1,85 В.
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом для системы: 1) Fe — Zn , железо в данной паре металлов поляризуется катодно, а цинк является анодом
(Fe)К : O2 + 2H2O = −1,85 В.
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом для системы: 1) Fe — Zn , железо в данной паре металлов поляризуется катодно, а цинк является анодом
(Fe)К : O2 + 2H2O  4OH‾ 1
(Zn)А: Zn 4OH‾ 1
(Zn)А: Zn  Zn 2+ 2
2Zn + O2 + 2H2O = 2Zn2++ 4OH‾
Молекулярное уравнение: 2Zn + O2 + 2H2O = 2 Zn(ОН)2.
Схема элемента: (−)(А) Zn│ Zn(ОН)2, O2, H2O │ Fe (К)(+).
2) Система Fe —Ве, в данной паре также железо будет являться катодом, бериллий – анодом, т.к. Zn 2+ 2
2Zn + O2 + 2H2O = 2Zn2++ 4OH‾
Молекулярное уравнение: 2Zn + O2 + 2H2O = 2 Zn(ОН)2.
Схема элемента: (−)(А) Zn│ Zn(ОН)2, O2, H2O │ Fe (К)(+).
2) Система Fe —Ве, в данной паре также железо будет являться катодом, бериллий – анодом, т.к. 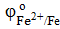 > > 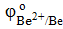 .
Процессы коррозии: (Fe)К : O2 + 2H2O .
Процессы коррозии: (Fe)К : O2 + 2H2O 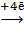 4OH‾ 1
(Ве)А: Ве 4OH‾ 1
(Ве)А: Ве 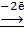 Ве2+ 2
Молекулярное уравнение: 2Ве + O2 + 2H2O = 2 Ве(ОН)2.
Схема элемента: (−)(А) Ве│ Ве(ОН)2, O2, H2O │ Fe (К)(+). Ве2+ 2
Молекулярное уравнение: 2Ве + O2 + 2H2O = 2 Ве(ОН)2.
Схема элемента: (−)(А) Ве│ Ве(ОН)2, O2, H2O │ Fe (К)(+).
|
| Ответ: цинк и бериллий могут являться протекторами |
Пример 6. К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при коррозии указанных пар в кислой среде?
Дано:
Системы:
а) Fe | Fe2+
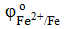 =
−0,44 B
б) Sn│ Sn2+ =
−0,44 B
б) Sn│ Sn2+
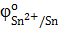 =
−0,14 В
в) Cu│Cu2+ =
−0,14 В
в) Cu│Cu2+
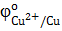 =
+0,34 В =
+0,34 В
| Решение
В кислой среде деполяризатором является ион водорода Н+.
1) В паре Sn→ Cu анодом будет являться олово, т.к. 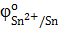 < < 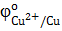 , следовательно, олово на меди будет являться анодным покрытием.
Процессы коррозии: (Cu)К : 2 Н+ , следовательно, олово на меди будет являться анодным покрытием.
Процессы коррозии: (Cu)К : 2 Н+ 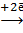 Н2
(Sn)А: Sn Н2
(Sn)А: Sn 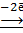 Sn 2+
Молекулярное уравнение: Sn + 2 НCl = SnCl2 + Н2.
Схема элемента: (−)(А) Sn │ SnCl2, H2O, НCl │ Cu (К)(+).
2) В паре Sn→ Fe анодом является железо, т.к. Sn 2+
Молекулярное уравнение: Sn + 2 НCl = SnCl2 + Н2.
Схема элемента: (−)(А) Sn │ SnCl2, H2O, НCl │ Cu (К)(+).
2) В паре Sn→ Fe анодом является железо, т.к. 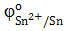 > > 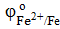 , следовательно, олово на железе является катодным покрытием, и при нарушении целостности покрытия протекают процессы коррозии:
(Sn)К : 2 Н+ , следовательно, олово на железе является катодным покрытием, и при нарушении целостности покрытия протекают процессы коррозии:
(Sn)К : 2 Н+ 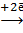 Н2
(Fe)А: Fe Н2
(Fe)А: Fe 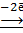 Fe 2+
Молекулярное уравнение: Fe +2 НCl = Fe Cl2 + Н2.
Схема элемента: (−)(А) Fe │ Fe Cl2, H2O, НCl │ Sn (К)(+). Fe 2+
Молекулярное уравнение: Fe +2 НCl = Fe Cl2 + Н2.
Схема элемента: (−)(А) Fe │ Fe Cl2, H2O, НCl │ Sn (К)(+).
|
| Ответ: олово по отношению к меди является анодным покрытием, а по отношению к железу − катодным. |
Контрольные вопросы и задания
Вариант 1
1. Каким типом проводимости должен обладать материал электрода в гальваническом элементе и при электролизе?
2. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция: Zn + 2AgNO3 → Zn(NO3)2 + 2 Ag ? Определите значение константы равновесия этой реакции в стандартных условиях.
а) (-) Zn│Zn(NO3)2║ AgNO3│ Ag (+);
б) (+)Zn│Zn(NO3)2║ AgNO3│ Ag (-);
в) (-)Zn│ AgNO3 ║ Zn(NO3)2│ Ag (+).
3. Какой процесс протекает на аноде в гальваническом элементе Ni │Ni2+ (1М)║Н+ (0,1М)│Н2, Pt ?
а) 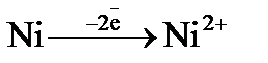 ; б)
; б) 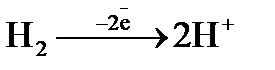 ; в)
; в) 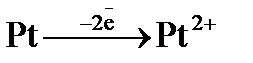 . Рассчитать ЭДС (Е) данного элемента.
. Рассчитать ЭДС (Е) данного элемента.
4. Какой процесс протекает на катоде при электролизе водного раствора сульфата натрия :
а) 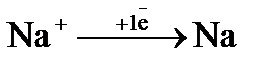 (
( 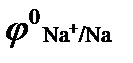 = - 2,71 В); б)
= - 2,71 В); б) 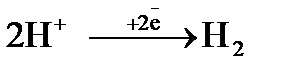 (
( 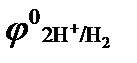 = 0,00 В);
= 0,00 В);
в) 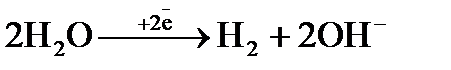 (
( 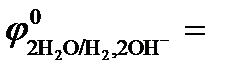 - 0,41 В).
- 0,41 В).
Свой выбор мотивируйте и рассчитайте количество вещества, которое выделяется за 1 минуту при силе тока равное 0,5 А.
5. С каким из металлов: а) с серебром; б) с цинком; в) с оловом, конструкционный контакт стальной детали является наиболее опасным, если: 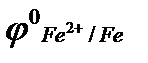 = - 0,44, В;
= - 0,44, В; 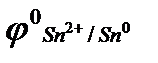 = - 0,14, В;
= - 0,14, В; 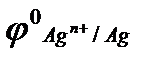 = 0,80, В;
= 0,80, В; 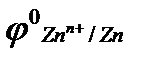 = - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии
= - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии
Вариант 2
1. Гальваническим элементом называется устройство, в котором:
а) происходит преобразование химической энергии окислительно-восстановительного процесса в электрическую энергию; б) происходит преобразование тепловой энергии в механическую работу: в) происходит преобразование химической энергии окислительно-восстановительного процесса в тепловую энергию. Выберите правильный ответ и приведите обоснование.
2. Катодом или анодом является водородный электрод в гальваническом элементе : Pt, H2 │HCl (1М)║ AgNO3│ Ag ? Рассчитайте потенциалы электродов, учитывая, что концентрация электродного раствора серебра равна 0,01 моль/л, приведите процессы на электродах и расставьте полюсность электродов.
3. Приведите процессы, протекающие на электродах в гальваническом элементе и токообразующую реакцию: Ni │Ni2+ (0,01М)║Н+ (0,1М)│Н2, Pt . Рассчитайте ЭДС элемента и изменение энергии Гиббса при работе данного элемента.
4. Приведите общую схему электролиза водного раствора КОН. Найдите объем кислорода (условия нормальные), который выделится при пропускании тока силой 6 А в течение 30 мин.
5. Какие продукты коррозии образуются при нарушении никелевого покрытия на стали во влажном воздухе, если: 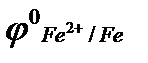 = - 0,44, В;
= - 0,44, В; 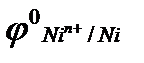 = - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде ко Вариант 3
= - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде ко Вариант 3
1. Приведите схему гальванического элемента, в котором медь является анодом. Рассчитайте ЭДС (Е) этого элемента, если концентрации электродных растворов и анода и катода равны 0,001 моль /л.
2. Какой вид имеет уравнение Нернста для стандартных расчетов потенциала электрода?
а) 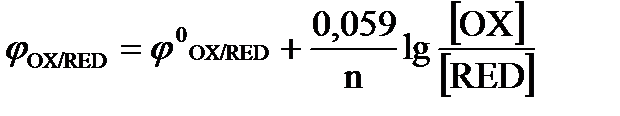 ; б)
; б) 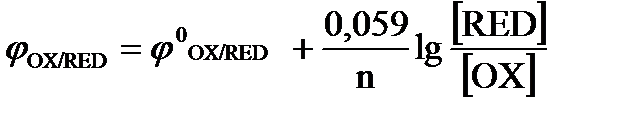 ;
;
в) 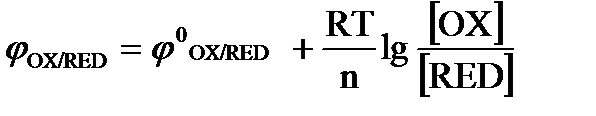 .
.
3. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен водородный показатель (рН) раствора, в который погружен анод, если катод погружен в раствор с рН=3?
4. Какой процесс протекает на медном аноде при электролизе водного раствора серной кислоты:
а) 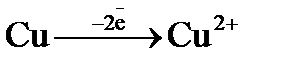 (
(  = + 0,34 В); б)
= + 0,34 В); б) 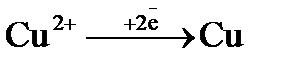 (
( 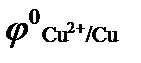 = + 0,34 В);
= + 0,34 В);
в) 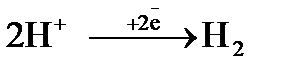 (
( 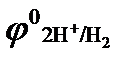 = 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
= 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
5. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 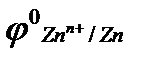 = - 0,76, В;
= - 0,76, В; 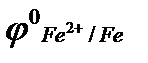 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
Вариант 4
1. Чем определяется ЭДС гальванического элемента:
(-) Pt,H2│H+(1 М)║Cu2+(1 M)│Cu(+) в стандартных условиях?
а) разностью стандартных потенциалов катода и анода; б) суммой стандартных потенциалов катода и анода; в) разностью потенциалов катода и анода. Какое стандартное значение имеет ЭДС данного элемента?
2. Гальванический элемент имеет схему: 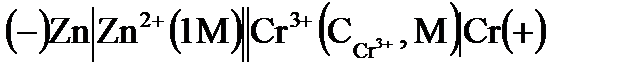 . При какой концентрации ионов хрома
. При какой концентрации ионов хрома 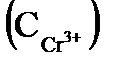 ЭДС этого элемента равна нулю?
ЭДС этого элемента равна нулю?
3. Рассчитайте потенциалы электродов и ЭДС гальванического элемента 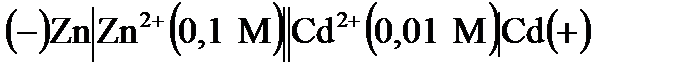 . Чему равно изменение энергии Гиббса при работе данного элемента?
. Чему равно изменение энергии Гиббса при работе данного элемента?
4. Приведите общую схему электролиза водного раствора 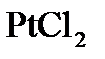 . Какие вещества и в каком количестве выделяются на электродах за 1 мин при прохождении тока силой 0,5 А?
. Какие вещества и в каком количестве выделяются на электродах за 1 мин при прохождении тока силой 0,5 А?
5. Какие из указанных металлов: а) цинк и магний; б) олово; в) медь, могут служить протектором для защиты стальных изделий от коррозии в морской воде, если: потенциалы электродов, и расставьте полюсность электродов.
Вариант 5
1. Какой процесс протекает на аноде в гальваническом элементе:
Вi │Вi3+ (0,1М)║Н+ (0,01М)│Н2, Pt ?
Рассчитайте потенциалы электродов, и расставьте полюсность электродов.
2. Приведите схему гальванического элемента, в котором никель является анодом. Рассчитайте ЭДС этого элемента, если концентрация электродного раствора анода равна 0,01 М, а катодного равна 0,001 моль /л.
3. Какое значение имеет стандартная электродвижущая сила (Е0) в гальваническом элементе Ni │Ni2+ (1М)║Н+ (1М)│Н2, Pt ? Анодом или катодом является никель? Определите значение константы равновесия токообразующей реакции в данном элементе.
4. При прохождении через водный раствор нитрата трехвалентного металла ток силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Приведите электродные процессы.
5. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 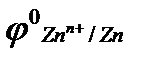 = - 0,76, В;
= - 0,76, В; 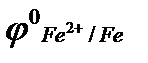 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Приведите схему гальванического элемента, работающего при коррозии стали в морской воде, запишите процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Приведите схему гальванического элемента, работающего при коррозии стали в морской воде, запишите процессы коррозии.
Вариант 6
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Fe| Fe2+; Zn| Zn2+; Pt, H2| 2H+. Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 0,1 моль/л, С анодного электролита = 0,01 моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
2. Для водного раствора ZnSO4: напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 0,5 час.
3. Составьте уравнения электродных процессов, происходящих при контактной коррозии металлических пар: Zn – Fe и Al – Fe ; а) в атмосфере влажного воздуха; б) в дистиллированной воде; в) в кислой среде.
4. Как рассчитать ЭДС окислительно-восстановительной реакции?
Каковы критерии самопроизвольного протекания окислительно-восстановительного процесса? Как связана ЭДС с изменением энергии Гиббса?
5. Сформулируйте законы Фарадея. Определите понятие электрохимического эквивалента.
Вариант 7
1. Гальванический элемент имеет схему: 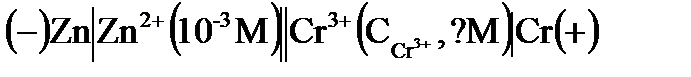 . При какой концентрации ионов хрома
. При какой концентрации ионов хрома 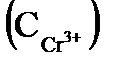 ЭДС этого элемента равна нулю?
ЭДС этого элемента равна нулю?
2. Как рассчитать ЭДС окислительно-восстановительной реакции?
Каковы критерии самопроизвольного протекания окислительно-восстановительного процесса? Как связана ЭДС с изменением энергии Гиббса?
3. К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при электрохимической коррозии указанных пар (Sn-Cu; Sn-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
4. Для водного раствора AgNO3: напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 2-х часов.
5. Привести уравнение Нернста для расчета электродного потенциала. Какие факторы влияют на величину потенциала? Что называют стандартным электродным потенциалом?
Вариант 8
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Mg | Mg 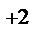 , Cr | Cr
, Cr | Cr 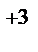 , Fe | Fe
, Fe | Fe 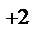 . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,1моль/л.
. Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,1моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
2. С каким из металлов: а) с медью; б) с цинком; в) с оловом, конструкционный контакт стальной детали является наиболее опасным, если: 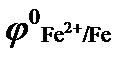 = - 0,44, В;
= - 0,44, В; 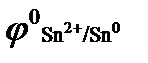 = - 0,14, В;
= - 0,14, В; 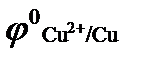 = 0,34, В;
= 0,34, В; 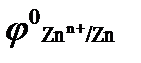 = - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
3. Определите концентрацию ионов Fe 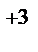 в растворе, при которой потенциал железного электрода Fe|Fe3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
в растворе, при которой потенциал железного электрода Fe|Fe3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
4. Для водного раствора NiSO4 напишите уравнения процессов, идущих на никелевых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 3А в течение времени 1 час.
5. Какие из металлов (Au, Sn, Mn) могут быть окислены кислородом при 298 К, рН = 7 и стандартных состояниях всех веществ?
Вариант 9
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Ni | Ni 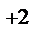 , Cu | Cu
, Cu | Cu 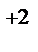 , Fe | Fe
, Fe | Fe 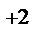 . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,01 моль/л.
. Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,01 моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
2. При прохождении через водный раствор нитрата трехвалентного металла ток силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла. Привести электродные процессы.
3. К какому типу покрытий относятся серебро на меди и на стале? Какие процессы будут протекать при коррозии указанных пар: а) в кислой среде; б) в атмосфере влажного воздуха?
4. Какой процесс протекает на серебряном аноде при электролизе водного раствора серной кислоты:
а) 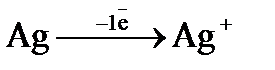 (
( 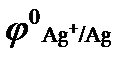 = + 0,80 В); б)
= + 0,80 В); б) 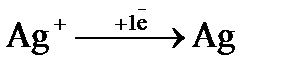 (
( 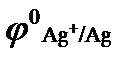 = + 0,80 В);
= + 0,80 В);
в) 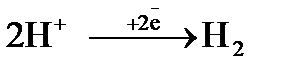 (
( 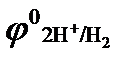 = 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
= 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
5. Какие из металлов (Pt, Cu, Mn) могут быть окислены кислородом при 298 К, рН = 7 и стандартных состояниях всех веществ?
Вариант 10
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Cr | Cr  , Ag | Ag
, Ag | Ag  , Pt | Pt
, Pt | Pt 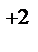 . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 10-3 моль/л, С анодного электролита = 10-2 моль/л.
. Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 10-3 моль/л, С анодного электролита = 10-2 моль/л.
Рассчитайте значение константы равновесия токообразующей реакции.
2. Для водного раствора Cu(NO3)2: напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 2-х часов.
3. Предложите протектор для защиты изделия из алюминиевой бронзы (сплав меди с алюминием) от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
4. Будет ли меняться рН в приэлектродных пространствах в процессе электролиза водного раствора AgNO3 с серебряными электродами? Ответ обосновать.
5. Определите концентрацию ионов Cr 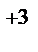 в растворе, при которой потенциал хромового электрода Cr|Cr3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
в растворе, при которой потенциал хромового электрода Cr|Cr3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
Вариант 11
1. Покажет ли амперметр ток во внешней цепи гальванического элемента:
Ni │Ni2+ (10-3 М)║Н+ (10-1 М)│Н2, Pt .
Для реакции, лежащей в основе работы гальванического элемента, рассчитайте энергию Гиббса и значение константы равновесия.
2. Для водного раствора Fe(NO3)2 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 3-х часов.
3. Определите концентрацию ионов Cr3+ в растворе, при которой потенциал электрода из хрома при 250С равен потенциалу водородного электрода в растворе с рН = 3.
4. Составьте уравнения электродных процессов, происходящих при контактной электрохимической коррозии металлической пары Zn – Ag: а) в атмосфере влажного воздуха; б) в дистиллированной воде;
в) в кислой среде.
5. Приведите уравнение Нернста для расчета электродного потенциала. Какие факторы влияют на величину потенциала? Что называют стандартным электродным потенциалом?
Вариант 12
1. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 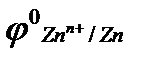 = - 0,76, В;
= - 0,76, В; 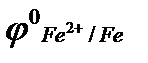 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
2. Для водного раствора К2SO4 напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 1 час.
3. Определите концентрацию ионов Cu2+ в растворе, при которой потенциал медного электрода Cu|Cu2+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
4. К какому типу покрытий относятся покрытие кадмия на меди и на стали? Какие процессы будут протекать при электрохимической коррозии указанных пар (Cd-Cu; Cd-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
5. Как рассчитать ЭДС окислительно-восстановительной реакции?
Каковы критерии самопроизвольного протекания окислительно-восстановительного процесса? Как связана ЭДС с изменением энергии Гиббса?
Вариант 13
1. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен водородный показатель (рН) раствора, в который погружен анод, если катод погружен в раствор с рН=2?
2. Для водного раствора NiSO4 напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 0,5 час.
3. Водородный электрод имеет раствор с рН = 0. На сколько изменится потенциал электрода, если раствор нейтрализовать до рН = 7?
4. К какому типу покрытий относятся покрытие никеля на меди и на стали? Какие процессы будут протекать при электрохимической коррозии указанных пар (Ni-Cu; Ni-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
5. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 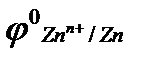 = - 0,76, В;
= - 0,76, В; 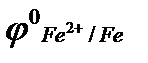 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
Вариант 14
1. Покажет ли амперметр ток во внешней цепи гальванического элемента:
Fe │Fe2+ (10-3 М)║Н+ (10-1 М)│Н2, Pt .
Для реакции, лежащей в основе работы гальванического элемента, рассчитайте энергию Гиббса и значение константы равновесия.
2. Для водного раствора NaCl напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 2-х часов.
3. С каким из металлов: а) медь; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 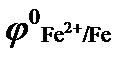 = - 0,44, В;
= - 0,44, В; 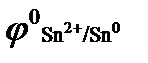 = - 0,14, В;
= - 0,14, В; 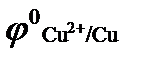 = 0,34, В;
= 0,34, В; 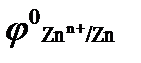 = - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
4. Составьте уравнения электродных процессов, происходящих при контактной электрохимической коррозии металлической пары Bi – Ag: а) в атмосфере влажного воздуха; б) в дистиллированной воде;
в) в кислой среде.
5. Какое значение имеет стандартная электродвижущая сила (Е0) в гальваническом элементе Вi │Вi2+ (1М)║Н+ (1М)│Н2, Pt ? Анодом или катодом является висмут? Определить значение константы равновесия токообразующей реакции в данном элементе.
Вариант 15
1. С каким из металлов: а) медь; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 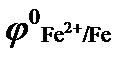 = - 0,44, В;
= - 0,44, В; 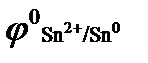 = - 0,14, В;
= - 0,14, В; 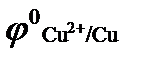 = 0,34, В;
= 0,34, В; 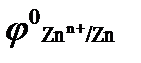 = - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Привести схему гальванического элемента, работающего при атмосферной коррозии.
2. Определите концентрацию ионов Fe 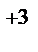 в растворе, при которой потенциал железного электрода Fe|Fe3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
в растворе, при которой потенциал железного электрода Fe|Fe3+ при 298 К равен потенциалу водородного электрода в растворе с рН = 2.
3. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Fe | Fe 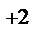 , Zn | Zn
, Zn | Zn 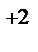 , Pt, H
, Pt, H 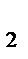 | 2H
| 2H 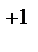 . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 0,1 моль/л, С анодного электролита = 0,01 моль/л.
. Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 0,1 моль/л, С анодного электролита = 0,01 моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
4. Для водного раствора ZnSO4: напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 0,5 час.
5. Катодом или анодом является водородный электрод в гальваническом элементе: Pt, H2 │HCl (1М)║ AgNO3│ Ag ? Рассчитайте потенциалы электродов, учитывая, что концентрация электродного раствора серебра равна 0,01 моль/л, приведите процессы на электродах и расставьте полюсность электродов.
Вариант 16
1. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция: Fe + 2AgNO3 → Fe(NO3)2 + 2 Ag ? Определите значение константы равновесия этой реакции в стандартных условиях.
а) (-) Fe│Fe(NO3)2║ AgNO3│ Ag (+);
б) (+)Fe│Fe(NO3)2║ AgNO3│ Ag (-);
в) (-)Fe│ AgNO3 ║ Fe(NO3)2│ Ag (+).
2. Приведите общую схему электролиза водного раствора КОН. Найдите объем кислорода (условия нормальные), который выделится при пропускании тока силой 6 А в течение 30 мин.
3. Какие продукты коррозии образуются при нарушении никелевого покрытия на стали во влажном воздухе, если: 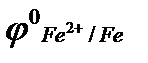 = - 0,44, В;
= - 0,44, В; 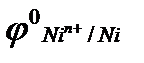 = - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
= - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
4. Для водного раствора Cu(NO3)2: напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 2-х часов.
5. Предложите протектор для защиты изделия из алюминиевой бронзы (сплав меди с алюминием) от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
Вариант 17
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Cr | Cr 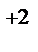 , Ag | Ag
, Ag | Ag 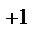 , Pt | Pt. . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 0,01 моль/л, С анодного электролита = 0,1 моль/л.
, Pt | Pt. . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 0,01 моль/л, С анодного электролита = 0,1 моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
2. С каким из металлов: а) медь; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 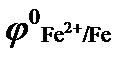 = - 0,44, В;
= - 0,44, В; 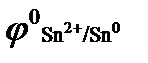 = - 0,14, В;
= - 0,14, В; 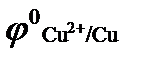 = 0,34, В;
= 0,34, В;  = - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
3. Для водного раствора CuSO4: напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 1 час.
4. Составьте уравнения электродных процессов, происходящих при контактной коррозии металлических пар: Zn – Fe и Al – Fe ; а) в атмосфере влажного воздуха; б) в дистиллированной воде; в) в кислой среде.
5. Предложите протектор для защиты металлического контакта сталь - медь от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
Вариант 18
1. Для водного раствора Cu(NO3)2 напишите уравнения процессов, идущих на медных электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 1 час. Изменится ли масса анода в процессе?
2. Предложите протектор для защиты изделия из алюминиевой бронзы (сплав меди с алюминием) от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
3. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция: Cu + 2AgNO3 → Cu(NO3)2 + 2 Ag ? Определить значение константы равновесия этой реакции в стандартных условиях.
а) (-) Cu│Cu(NO3)2║ AgNO3│ Ag (+);
б) (+)Cu│Cu(NO3)2║ AgNO3│ Ag (-);
в) (-)Cu│ AgNO3 ║ Cu(NO3)2│ Ag (+).
4. С каким из металлов: а) серебро; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 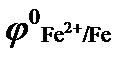 = - 0,44, В;
= - 0,44, В; 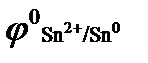 = - 0,14, В;
= - 0,14, В; 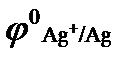 = 0,80, В;
= 0,80, В; 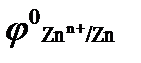 = - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
5. Составьте уравнения электродных процессов, происходящих при контактной электрохимической коррозии металлической пары Ni – Ag: а) в атмосфере влажного воздуха; б) в дистиллированной воде;
в) в кислой среде.
Вариант 19
1. Составьте схемы работающих гальванических элементов, используя предложенные электроды: Pb | Pb 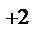 , Fe | Fe
, Fe | Fe 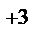 , Ag | Ag+ . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,01 моль/л.
, Ag | Ag+ . Напишите уравнения процессов, протекающих на аноде и катоде в данных элементах, уравнения токообразующих реакций. Рассчитайте значения электродных потенциалов при: С катодного электролита = 1 моль/л, С анодного электролита = 0,01 моль/л.
Рассчитайте значение электродвижущей силы гальванического элемента и энергию Гиббса токообразующей реакции.
2. При прохождении через водный раствор нитрата трехвалентного металла ток силой 1,5 А в течение 0,5 час на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Приведите электродные процессы.
3. К какому типу покрытий относятся никель на меди и на стале? Какие процессы будут протекать при коррозии указанных пар (Ni-Cu; Ni-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
4. Какой процесс протекает на серебряном аноде при электролизе водного раствора серной кислоты:
а) 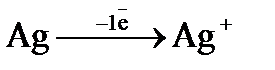 (
( 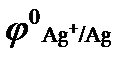 = + 0,80 В); б)
= + 0,80 В); б) 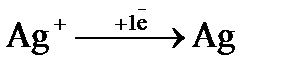 (
( 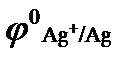 = + 0,80 В);
= + 0,80 В);
в) 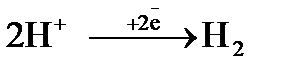 (
( 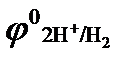 = 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 2 А?
= 0,00 В)? Ответ обосновать. На сколько уменьшится масса анода за 1 час пропускании тока силой 2 А?
5. Какие из металлов (Pt, Cu, Mn) могут быть окислены кислородом при 298 К, рН = 7 и стандартных состояниях всех веществ?
Вариант 20
1. Гальванический элемент имеет схему: 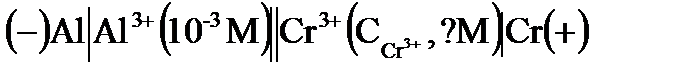 . При какой концентрации ионов хрома
. При какой концентрации ионов хрома 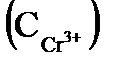 ЭДС этого элемента равна нулю?
ЭДС этого элемента равна нулю?
2. Как рассчитать ЭДС окислительно-восстановительной реакции?
Каковы критерии самопроизвольного протекания окислительно-восстановительного процесса? Как связана ЭДС с изменением энергии Гиббса?
3. К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при электрохимической коррозии указанных пар (Sn-Cu; Sn-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
4. Для водного раствора AgNO3: напишите уравнения процессов, идущих на серебряных электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 1 часа. Изменится ли масса анода в процессе?
5. Привести уравнение Нернста для расчета электродного потенциала. Какие факторы влияют на величину потенциала? Что называют стандартным электродным потенциалом?
Вариант 21
1. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен водородный показатель (рН) раствора, в который погружен анод, если катод погружен в раствор с рН=1?
2. Для водного раствора К2SO4 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 1,5 час.
3. Водородный электрод имеет раствор с рН = 1. Насколько изменится потенциал электрода, если раствор нейтрализовать до рН = 7?
4. К какому типу покрытий относятся покрытие никеля на меди и на стали? Какие процессы будут протекать при электрохимической коррозии указанных пар (Ni-Cu; Ni-Fe): а) в кислой среде; б) в атмосфере влажного воздуха?
5. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 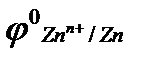 = - 0,76, В;
= - 0,76, В; 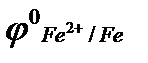 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Приведите схему гальванического элемента, работающего при коррозии стали в морской воде, запишите реакции процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Приведите схему гальванического элемента, работающего при коррозии стали в морской воде, запишите реакции процессы коррозии.
Вариант 22
1. ЭДС гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен водородный показатель (рН) раствора, в который погружен анод, если катод погружен в раствор с рН=2?
2. Какой процесс протекает на медном аноде при электролизе водного раствора серной кислоты:
а) 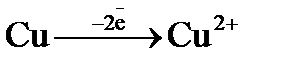 (
( 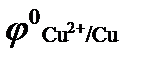 = + 0,34 В); б)
= + 0,34 В); б) 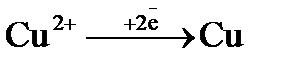 (
( 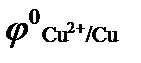 = + 0,34 В);
= + 0,34 В);
в) 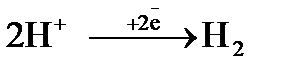 (
( 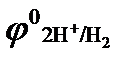 = 0,00 В)? Ответ поясните. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
= 0,00 В)? Ответ поясните. На сколько уменьшится масса анода за 1 час пропускании тока силой 1 А?
3. Какие коррозионные процессы протекают при нарушении оловянного покрытия на стальном изделии в морской воде (рН=7,5)? Приведите схему гальванического элемента, работающего при данном виде коррозии.
4. Для водного раствора КCl напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 2А в течение времени 2-х часов.
5. Предложите протектор для защиты металлического контакта сталь - медь от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
Вариант 23
1. Какой процесс протекает на аноде в гальваническом элементе Ni │Ni2+ (1М)║Н+ (0,01М)│Н2, Pt ?
Рассчитайте потенциалы электродов, и расставьте полюсность электродов.
2. Приведите схему гальванического элемента, в котором медь является анодом. Рассчитайте ЭДС этого элемента, если концентрация электродного раствора анода равна 0,01 М, а катодного - 0,001 моль /л.
3. Составьте уравнения электродных процессов, происходящих при контактной электрохимической коррозии металлической пары Bi – Ag: а) в атмосфере влажного воздуха; б) в дистиллированной воде;
в) в кислой среде.
4. Для водного раствора Cd(NO3)2 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 1,5 час.
5. Какой метод защиты от коррозии в морской воде стального корпуса плавучего крана при рН≈7 используется на причалах ( 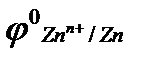 = - 0,76, В;
= - 0,76, В; 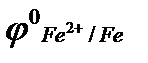 = ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
= ‑ 0,44, В): а) протекторная защита; Zn – протектор; б) покрытие из цинка; в) катодная защита. Привести схему гальванического элемента, работающего при коррозии стали в морской воде, записать процессы коррозии.
Вариант 24
1. Какая схема будет соответствовать гальваническому элементу, в основе работы которого лежит токообразующая реакция: Pb + 2AgNO3 → Pb(NO3)2 + 2 Ag ? Определите значение константы равновесия этой реакции в стандартных условиях.
а) (-) Pb│Pb(NO3)2║ AgNO3│ Ag (+);
б) (+)Pb│Pb(NO3)2║ AgNO3│ Ag (-);
в) (-)Pb│ AgNO3 ║ Pb(NO3)2│ Ag (+).
2. Для водного раствора NiCl2 напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение 1 часа.
3. С каким из металлов: а) медь; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 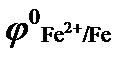 = - 0,44, В;
= - 0,44, В; 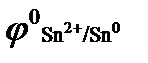 = - 0,14, В;
= - 0,14, В; 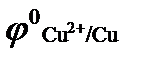 = 0,34, В;
= 0,34, В; 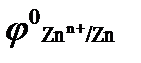 = - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
= - 0,76, В ? Приведите схему гальванического элемента, работающего при атмосферной коррозии.
4. Какие продукты коррозии образуются при нарушении никелевого покрытия на стали во влажном воздухе, если: 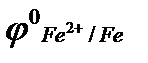 = - 0,44, В;
= - 0,44, В; 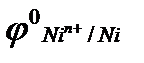 = - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
= - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
5. Предложите протектор для защиты изделия из алюминиевой бронзы (сплав меди с алюминием) от коррозии во влажном воздухе. Приведите уравнения протекающих процессов.
Вариант 25
1. Приведите общую схему электролиза водного раствора КОН. Найдите объем газа (условия нормальные), который выделится на: а) катоде; б)аноде при пропускании тока силой 6 А в течение 30 мин.
2. Какие продукты коррозии образуются при нарушении никелевого покрытия на стали во влажном воздухе, если: 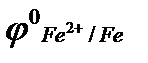 = - 0,44, В;
= - 0,44, В; 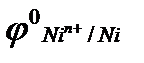 = - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
= - 0,25, В ? Приведите схему гальванического элемента, работающего при данном виде коррозии.
3. Для водного раствора NaCl напишите уравнения процессов, идущих на графитовых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 2-х часов.
4. С каким из металлов: а) медь; б) цинк; в) олово, конструкционный контакт стальной детали является наиболее опасным, если: 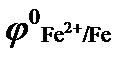 = - 0,44, В;
= - 0,44, В; 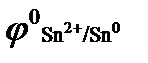 = - 0,14, В;
= - 0,14, В; 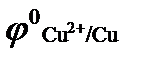 = 0,34, В;
= 0,34, В; 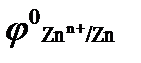 = - 0,76, В ? Приведите
= - 0,76, В ? Приведите
схему гальванического элемента, работающего при атмосферной коррозии.
5. Составьте уравнения электродных процессов, происходящих при контактной электрохимической коррозии металлической пары Bi – Ag:
а) в атмосфере влажного воздуха;
б) в дистиллированной воде;
в) в кислой среде.
ЛИТЕРАТУРА
Основная литература
1. Общая химия. Теория и задачи / Н.В. Коровин, Н.В. Кулешов, О.Н. Гончарук, В.К. Камышова. — СПб.: Лань, 2014.— 491 с. http://e.lanbook.com/books/element.php?pl1_id=51723
2. Гельфман, М.И. Химия / М.И. Гельфман, В.П. Юстратов. — СПб.: Лань, 2008.— 472 с. http://e.lanbook.com/books/element.php?pl1_id=4030
3. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. — СПб.: Лань, 2014.— 744 с. http://e.lanbook.com/books/element.php?pl1_id=50684
4. Вольхин, В.В. Общая химия. Основной курс: учебное пособие для вузов в области техники и технологии/ В.В. Вольхин. – СПб.: Лань, 2008. – 464с. http://lib.dvfu.ru:8080/lib/item?id=chamo:281662&theme=FEFU
5. Глинка, Н.Л. Общая химия: учебное пособие для вузов/ Н.Л. Глинка; под ред. А.И. Ермакова. – М.: Интеграл-Пресс, 2008. – 728с. https://lib.dvfu.ru:8443/lib/item?id=chamo:384127&theme=FEFU
6. Глинка, Н.Л. Задачи и упражнения по общей химии: учебное пособие для нехимических специальностей вузов/ Н.Л. Глинка; под ред. В.А. Рабиновича, Х.М. Рубиной. – М.: КноРус, 2014. – 240с. https://lib.dvfu.ru:8443/lib/item?id=chamo:729121&theme=FEFU
Дополнительная литература
1. Угай, Я.А. Общая и неорганическая химия: учебник для вузов/ Я.А. Угай. - М.: Высшая школа, 2007. – 527 с. http://lib.dvfu.ru:8080/lib/item?id=chamo:353896&theme=FEFU
2. Вольхин, В.В. Общая химия. Специальный курс: учебное пособие для вузов в области техники и технологии/ В.В. Вольхин. – СПб.: Лань, 2008. – 440с. http://lib.dvfu.ru:8080/lib/item?id=chamo:281661&theme=FEFU
3. Вольхин, В.В. Общая химия. Избранные главы: учебное пособие для вузов в области техники и технологии/ В.В. Вольхин. – СПб.: Лань, 2008. – 378с. http://lib.dvfu.ru:8080/lib/item?id=chamo:281664&theme=FEFU
4. Краткий справочник физико-химических величин /Под ред. Равделя А.А. и Пономаревой А.М. – СПб.: Специальная литература,1999. – 232с. https://lib.dvfu.ru:8443/lib/item?id=chamo:363942&theme=FEFU
5. Лурье, Ю.Ю. Справочник по аналитической химии / Ю.Ю. Лурье. – М.: Химия, 1989. – 448 с. https://lib.dvfu.ru:8443/lib/item?id=chamo:720634&theme=FEFU
Дата: 2018-11-18, просмотров: 1520.
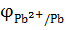 =
= 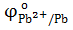 +
+ 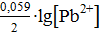 ;
;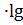 10-2 = − 0,19 В;
10-2 = − 0,19 В;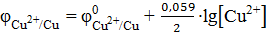 ;
;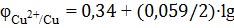 10-1 = +0,31 В.
10-1 = +0,31 В.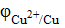 −
− 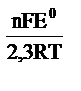 , где n – число электронов, участвующих в реакции (n=2ē), E
, где n – число электронов, участвующих в реакции (n=2ē), E  - стандартное значение ЭДС.
- стандартное значение ЭДС.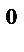 =
= 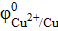 –
– 
 = 10
= 10 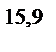 = 10
= 10 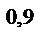 ∙10
∙10  = 8,3∙10
= 8,3∙10  >>10
>>10  .
.