Начиная с 1978 г. ВРТ стали широко использовать во всем мире, и сейчас рождение детей, зачатых «в пробирке», - не редкость и составляет 1-3% всех новорожденных. В 2002 г. появились первые сведения о новорожденных с болезнями импринтинга. Безусловно, интересен тот факт, что у таких пациентов, как правило, не обнаруживают структурных аномалий импринтированных районов (делеции, дупликации), а заболевания возникают в результате эпимутаций - нарушений метилирования ДМР и регуляторных последовательностей импринтированных генов. К эпигенетическим аномалиям может приводить целый ряд причин: 1) собственно бесплодие; 2) процесс стимуляции овуляции; 3) физические манипуляции с эмбрионом в процессе оплодотворения in vitro (IVF), введение сперматозоида в яйцеклетку (ICSI), непосредственно перенос эмбриона; 4) особенности культивирование эмбриона in vitro.
Эти критические манипуляции совпадают с очень тонкими эпигенетическими процессами стирания, установления и поддержания метилирования на ранних этапах формирования гамет, оплодотворения и раннего эмбриогенеза (рис. 22). Большинство случаев связано с нарушением метилирования материнского аллеля. Если исходить из процесса развития герминальных клеток, то ВРТ - маловероятная причина возникновения эпимутаций на отцовской хромосоме, так как импринт на отцовских аллелях в процессе гаметогенеза устанавливается раньше, чем на материнских. Отцовский импринт, видимо, устанавливается уже на стадии диплоидного сперматогония. Напротив, в ооците материнский импринт начинает устанавливаться в растущем ооците и продолжает формироваться на стадиях от примордиального до антрального перехода, а для ряда генов окончательно формируется только перед овуляцией, что доказано в экспериментах на мышах. Именно поэтому механизмы материнского импринтинга могут быть уязвимы уже при стимуляции яичников. Кроме того, материнский геном может быть более подвержен дефектам импринтинга и метилирования в течение преимплантационного периода, когда эмбрион полностью зависит от условий культивирования in vitro. В ряде случаев установлена материнская ОРД. Этот факт имеет логическое обоснование: нерасхождение хромосом характерно для женщин старшего возраста, которые чаще прибегают к ВРТ.
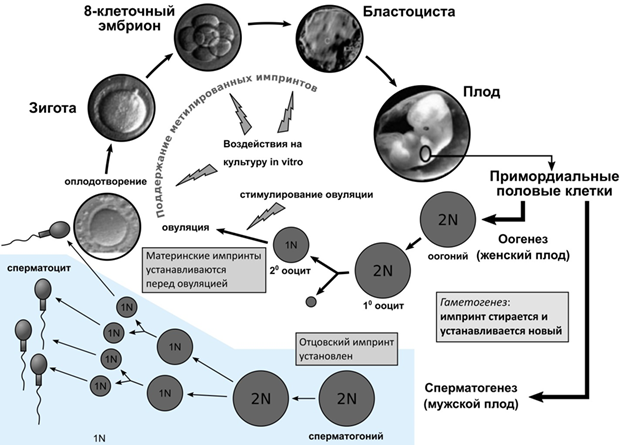
Рисунок 22. Критические этапы гаметогенеза и раннего эмбриогенеза, могущие привести к эпигенетической патологии при ВРТ.
В ряде случаев установлена материнская ОРД. Этот факт имеет логическое обоснование: нерасхождение хромосом характерно для женщин старшего возраста, которые чаще прибегают к ВРТ.
Уже описано значительное количество случаев СБВ; статистический анализ показал, что вероятность рождения ребенка с СБВ после ВРТ примерно в 7 - 10 раз выше по сравнению с естественным зачатием. В подавляющем большинстве (83,3-100%) пациенты имели гипометилирование материнского аллеля в районе СБВ-ЦИ2, регулирующим экспрессию генов СDKN1C и KCNQ1. Частота эпимутаций этого района значительно превышает таковую (50-60%) у пациентов, рожденных без использования ВРТ. Частота эпимутаций этого района у пациентов, рожденных в результате ВРТ(50-60%), значительно превышает таковую у пациентов без использования ВРТ.
На сегодняшний день описано несколько десятков случаев СА, возникших в результате использования ВРТ и имеющих эпимутации - потерю материнского метилирования в локусе SNRPN. В целом, имеющихся данных недостаточно для подтверждения связи между ВРТ и СА в результате дефектов импринтинга, хотя основная масса случаев СА связана с делецией импринтированного района. Исследования ограничены еще и чрезвычайной редкостью аномалий импринтинга при СА, так как их частота в общей популяции составляет от 1/300,000 до 1/750,000.
Случаев СРС описано еще меньше. В одном из исследований было показано, что из 11 случаев СРС, появившихся в результате ВРТ, у 10 было выявлено гипометилирование отцовского аллеля H 19, наиболее распространенный молекулярный механизм СРС. У одного ребенка было установлено нормальное метилирование H 19 и гиперметилирование ДМР PEG 1/MEST (хромосома 7q32) отцовского аллеля. В другом исследовании СРС в результате ВРТ была выявлена высокая (80%) частота аномалий метилирования других ДМР, отличных от Н19, по сравнению с 30% пациентов, которые были зачаты естественным путем. Однако эти различия в паттернах метилирования между ВРТ и естественно зачатыми пациентами с СРС не отражались на их клинических особенностях или на тяжести синдрома. Таким образом, СРС не встречается чаще у детей, зачатых методом ЭКО/ИКСИ, по сравнению с общей популяцией.
При исследовании 261 пациента с СПВ, рожденных в результате ВРТ, эпимутации импринтированного района не обнаружены, но установлены делеции критического района 15q11-q12. Их частота также не превышает популяционного уровня.
В нескольких исследованиях был изучен статус метилирования промоторного района гена RB1 у детей с ретинобластомой, рожденных в результате ВРТ. Ни в одном случае аномального метилирования выявлено не было. В настоящее время нет существенных доказательств того, что эпигенетические изменения, приводящие к спорадической РБ, происходят чаще в популяции ВРТ.
Описано всего 2 пациента с ПГПТ1Б, родившихся в результате ВРТ. У обоих была определена потеря метилирования экзона А/В импринтированного района GNAS . Поэтому говорить о влиянии ВРТ на частоту заболевания преждевременно.
В отношении синдрома материнского гипометилирования, его характерных фенотипических проявлений и возможной ассоциации с ВРТ, так же говорить рано.
Заключение.
Поскольку уже описано более 150 импринтированных генов, а предполагается, что генов с моноаллельной экспрессией должно быть не менее 200 (возможно, в разных тканях и в различные периоды онтогенеза), справедливо полагать, что причиной ряда синдромальных состояний, где молекулярный дефект еще неизвестен, станут эпигенетические нарушения, представленные аномальным метилированием ДНК и изменениями экспрессии нкРНК.
Эпигенетическая регуляция экспрессии генов в организме человека всеобъемлюща, как в норме, так и при патологии. Появляется все больше данных об эпигенетическом наследовании приобретенных признаков (фенотипических и поведенческих) благодаря нкРНК сперматозоидов. В частности, показано, что несколько сотен важных для развития малых нкРНК соматического происхождения доставляются в сперматозоид специальным классом нановезикул эпидидимиса, называемых эпидидимосомами. Эпидидимус является ключевым участником формирования эпигенома спермы, т.к. может включать РНК из экзосом соматического происхождения. Состав нкРНК сперматозоидов отражает образ жизни и несет в себе ”память" отцовского опыта; эта «память» на основе РНК передается потомству как приобретенные характеристики, способные повлиять на здоровье и общую биологическую судьбу потомства. Недавние эксперименты на мышах показали потенциал нкРНК сперматозоидов в качестве трансгенерационных модификаторов, свойства которых появились в ответ на условия окружающей среды или стресса, включая диету, сигаретный дым, чувствительность к запаху, когнитивные и поведенческие условия. Убедительные эксперименты показали, что нкРНК действительно являются трансгенерационными модификаторами - потомство из нормальных зигот, в которые вводили РНК сперматозоидов особей, подвергшихся стрессу, повторяет фенотипические черты животных-доноров РНК. РНК, доставляемые сперматозоидами при оплодотворении выполняют регуляторные функции и ремоделируют профиль экспрессии генов на самых ранних стадиях эмбриогенеза. Таким образом, РНК играет роль центрального узла информации, служащего носителем информации, модификатором и аттенюатором (преобразователем) для многих биологических процессов, в том числе и эволюционных.
В то же время не следует забывать, что существует огромное количество мультифакториальных заболеваний, где эпигенетические факторы регуляции играют одну из основных ролей. Метилирование ДНК, модификации хроматина, многочисленные некодирующие РНК и их регуляторные взаимодействия присутствует во всех вариантах патологии, в том числе играют очень значительную роль в возникновении, прогрессии, ответе на лечение и прогнозе развития мультифакториальных заболеваний (онкологических, иммунных, атопических, эндокринных, кардиологических и др.). В рамках одной главы про все варианты патологии можно только упомянуть.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Введение в молекулярную диагностику. Том 2. Молекулярно-генетические методы в диагностике наследственных и онкологических заболеваний / Под ред. М.А.Пальцева и Д.В.Залетаева. Москва. «Медицина», 2011.
Эпигенетика / Под редакцией С. Д. Эллиса, Т. Дженювейна, Д. Рейнберга. Москва. «Техносфера», 2013.
Эпигенетика. Химический и медико-биологический аспекты / В. Г. Граник. Москва. «Вузовская книга», 2018.
DNA Methylation and Complex Human Disease / Michel Neidhart. – UK: Academic Press, 2015. eBook ISBN: 9780127999203.
Epigenomics in Health and Disease / Ed. by: Mario Fraga Agustin Fernandez. - UK: Academic Press, 2015. eBook ISBN: 9780128004968.
Medical Epigenetics / Ed. by Trygve Tollefsbol. – UK: Academic Press, 2016. eBook ISBN: 9780128032404.
Epigenetics in Human Disease, 2nd Edition / Ed. by Trygve Tollefsbol. – UK: Academic Press, 2018. eBook ISBN: 9780128123294.
https://freevideohub.ru/search/%D1%8D%D0%BF%D0%B8%D0%B3%D0%B5%D0%BD%D0%B5%D1%82%D0%B8%D0%BA%D0%B0-%D1%87%D0%B5%D0%BB%D0%BE%D0%B2%D0%B5%D0%BA%D0%B0-%D0%BA%D0%BD%D0%B8%D0%B3%D0%B0
Дата: 2019-12-10, просмотров: 604.