Некодирующие РНК (нкРНК), долгое время считавшиеся транскрипционным шумом, уже более 10 лет признаны одним из механизмов транскрипционной и посттранскрипционной регуляции экспрессии генов. Описано участие нкРНК во многих клеточных процессах, необходимых для нормального функционирования организма, кроме того, нарушение их экспрессии характерно для целого ряда заболеваний. К настоящему времени нкРНК обнаружены в клетках всех эукариот, причем их количество коррелирует с биологической сложностью организма. Так, гены нкРНК покрывают более 70% генома человека против всего 2% белок-кодирующих генов. Широкая представленность, межвидовая консервативность и локализация генов нкРНК в активной части генома указывают на функциональную значимость нкРНК. В зависимости от длины транскриптов выделяют короткие нкРНК (20‒200 н.), из которых наиболее известны микроРНК, и длинные нкРНК (от 200 н.). Кроме того, некоторые нкРНК домашнего хозяйства, такие как малые ядерные и малые ядрышковые РНК, малые РНК, происходящие из транспортной РНК, способны выполнять регуляторные функции в клетке, что позволяет относить их одновременно к обеим группам нкРНК.
Обширный класс регуляторных РНК млекопитающих составляют очень короткие (19-25 нуклеотидов) молекулы, получившие название микроРНК (miРНК), и короткие интерферирующие РНК (siРНК). Предшественниками miРНК являются эндогенные короткие шпилечные структуры, а их мишени - другие локусы со сходной, но не идентичной нуклеотидной последовательностью, где miРНК вызывают репрессию трансляции. siРНК образуются из более длинных двунитевых РНК или длинных шпилек, часто экзогенного происхождения. Их обычные мишени - гомологичные последовательности в том же локусе либо в другой части генома. miРНК и siРНК разрушают мРНК таргетных последовательностей, переводя соответствующие гены в инактивированное состояние. Это явление называют РНК-интерференцией (РНКи). Различие между miРНК и siРНК несколько скрадывается вследствие того, что те и другие образуются посредством одних и тех же метаболических путей и имеют сходные механизмы действия. Получены убедительные данные о том, что miРНК и siРНК могут подавлять трансляцию мРНК (в случае неполной комплементарности) и расщеплять РНК-мишени (в случае полной комплементарности). Показано, что miРНК активно участвуют в процессах онтогенеза, метаболизма жира, секреции инсулина, гемопоэзе, развитии мышц, самообновлении и дифференцировке стволовых клеток, а также в канцерогенезе. Напротив, siРНК изначально рассматривали как систему противовирусной защиты и репрессии транспозонов, действующую по механизму РНКи. Результаты исследований позволяют предположить, что этот класс РНК принимает гораздо большее участие в регуляции работы генов и генома.
У млекопитающих miРНК имеют некоторые уникальные свойства. Около 50% их локализуется внутри интронов генов и транскрибируется совместно с того же промотора, остальные - из интронов и экзонов генов мРНК-подобной некодирующей РНК. Координированная экспрессия связана с тонкой регуляцией miРНК трансляции мРНК гена. Большинство miРНК кластерировано в геноме человека и экспрессируется совместно, что свидетельствует о необходимости более чем одной miРНК для регуляции экспрессии конкретного гена. Большинство miРНК консервативны и располагаются в районах, вовлеченных в структурные перестройки хромосом, или в ломких сайтах. Установлено, что это имеет значение в развитии ряда генетических и онкологических заболеваний у человека.
Процессинг miРНК - двухступенчатый процесс расщепления более длинных первичных транскриптов (в том числе антисмысловых), представленных обычными пре-мРНК и некодирующими РНК (рис. 5). Было показано, что первичные транскрипты (длина - 100-1000 нуклеотидов), содержащие miРНК, синтезируются при участии РНК-полимеразы II, полиаденилируются и кэпируются. Процессинг этих транскриптов осуществляет белковый комплекс, состоящий из РНКазы III Drosha и белка DGCR8, связывающего двунитевую РНК. Он расщепляет шпильки РНК, содержащие большие (≥10 нуклеотидов) концевые петли, и вырезает предшественников длиной 65-75 нуклеотидов, называемых пре-miРНК. Затем пре-miРНК экспортируются из ядра переносчиком Exportin 5 и Ran-GTP и подвергаются процессингу цитоплазматической РНКазой III (эндонуклеазой Dicer), распадаясь на несовершенные дуплексы размером около 22 пар нуклеотидов с двунуклеотидными 3'-выступающими концами.
siРНК также образуются из двунитевых предшественников путем процессинга нуклеазой Dicer, но Drosha не участвует в этом процессе. Возможно, предшественники образуются эндогенно (например, из смысловых-антисмысловых транскриптов). Они могут быть и экзогенного (вирусного) происхождения, как было установлено при открытии siРНК. Они катализируют разрушение эндогенных РНК с полностью комплементарной нуклеотидной последовательностью, что в настоящее время служит широко распространенным приемом изучения функций генов с помощью индуцированного siРНК адресного нокдауна гена.
После расщепления нуклеазой Dicer короткий дуплекс miРНК раскручивается с помощью хеликаз и одна из его цепей встраивается в состав РНК-зависимого комплекса репрессии (RISC), включающего в качестве основного компонента эндонуклеазу семейства Argonaute (Ago2) и связывающий белок TRBP. Мутации белков Argonaute нарушают самые разнообразные процессы развития, такие, как созревание половых клеток, пути дифференцировки стволовых клеток, а также участвуют в развитии рака и аномалий развития у человека. В RISC, из прошедшего процессинг дуплекса, остается только одна цепь РНК. Выбор одной из двух цепей определяется относительной стабильностью разных концов дуплекса: предпочтение отдается той цепи, 5'-конец которой конъюгирован менее прочно, а комплементарная цепь (miРНК*), как правило, деградирует. Тем не менее, в случае некоторых miРНК обе цепи объединяются с комплексом RISC и в таком случае их обозначают как “5p” и “3p” в зависимости от того, с
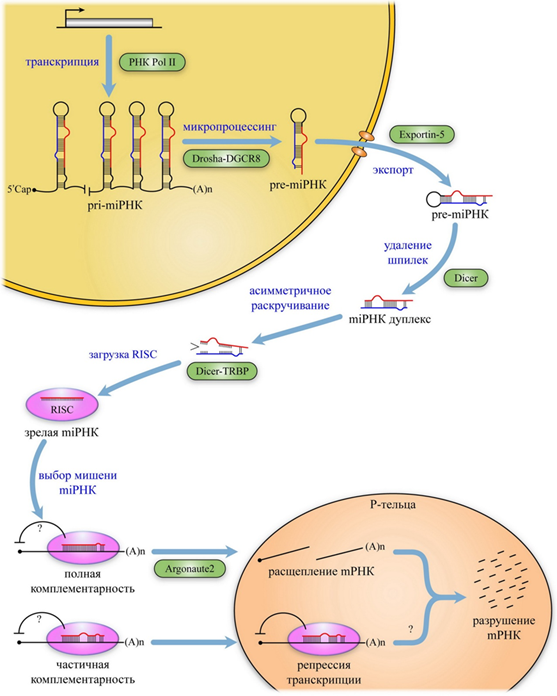
Рисунок 5. Процессинг и механизм действия miРНК.
какого конца шпильки они транскрибировались. Комплекс RISC, содержащий функциональную цепь miРНК, связывается с 3’-нетранслируемым районом (3’-НТР) гомологичной мРНК гена-мишени. Результат зависит от степени комплементарности между участком 2-8 нуклеотидов на 5’-конце miРНК и 3’-НТР мРНК. Полная комплементарность приводит к деградации мРНК посредством РНК-интерференции, наличие 2–3 неспаренных нуклеотидов – к репрессии ее трансляции. Эндонуклеазная активность внутри комплекса RISC опосредована РНКаза-H-подобным доменом (piwi) в белке Argonaute. Процессинг мРНК заканчивается в Р-тельцах, где она распадается на нуклеотиды.
В качестве механизмов репрессии трансляции служат: 1) блокирование инициации трансляции; 2) блокирование элонгации трансляции; 3) деаденилирование и разрушение мРНК; 4) протеолиз вновь синтезированного белка. Для miРНК и siРНК характерен еще один способ инактивации экспрессии генов - они могут индуцировать метилирование CpG-островков промоторных районов генов.
Другие малые некодирующие РНК также имеют вполне определенные функции.
Транспортные РНК, величиной 76-90 н., осуществляют трансляцию мРНК в белок. Стресс-активируемая рибонуклеаза Angiogenin может разрезать зрелую tРНК в антикодоновой петле, что дает две половинки, которые представляют собой tiРНК, несущие информационную функцию. Дальнейший процессинг приводит к получению tRF-3s и tRF-5s (17-18 н.), которые ассоциированы с сайтами инициации транскрипции и выполняют функцию miРНК (рис. 6).
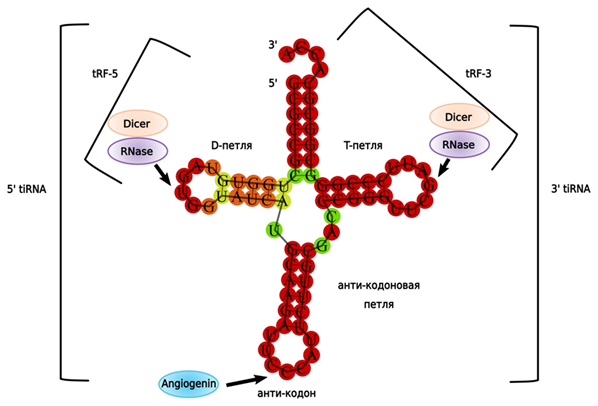
Рисунок 6. Процессинг транспортной РНК. Пояснения в тексте.
Малые ядерные РНК (snРНК), или сплайсосомные РНК, длиной 100-150 н., являются ключевой составляющей процесса сплайсинга мРНК - 14 различных вариантов, выполняют свою функцию в составе белковых комплексов.
Малые ядрышковые РНК – snoРНК (70-120 н.) участвуют в метилировании и псевдоуридилировании rРНК, tРНК, snРНК, дифференциально экспрессируются в различных тканях, осуществляют регуляторные функции.
Малые РНК, обнаруженные в тельцах Кахала, scaРНК, участвуют в процессинге теломеразной РНК.
PIWI-взаимодействующая РНК, piРНК (26-30 н.) – эпигенетически и пост-транскрипционно инактивирует транспозоны преимущественно в половых клетках, экспрессируются в мозге.
SpliРНК – РНК, ассоциированная с сайтами сплайсинга (17-18 н.), участвуют в распределении нуклеосом и/или организации хроматина.
PASRs – малые РНК, ассоциированные с промоторами. РНК-опосредованная инактивация/активация транскрипции.
TSSa-РНК – малые РНК, ассоциированные с сайтом старта транскрипции. РНК-опосредованная инактивация/активация транскрипции.
PROMPTS – (promoter upstream transcripts) пред-промоторные транскрипты. РНК-опосредованная инактивация/активация транскрипции.
Длинные некодирующие РНК (днРНК) ‒ самый многочисленный класс нкРНК, включающий транскрипты длиной более 200 н. с ограниченной способностью кодировать белки или совсем без нее. Как правило, длина днРНК гораздо больше 200 н., а у 2482 днРНК человека превышает 1000 н. За последнее десятилетие в ходе полногеномного анализа идентифицировано огромное количество новых днРНК. На данный момент в геноме человека описано 58648 генов днРНК и их число постоянно возрастает.
Несмотря на термин “некодирующие”, в ряде исследований показано, что некоторые днРНК содержат короткую открытую рамку считывания (ОРС) и транслируются с образованием пептидов длиной до 100 аминокислотных остатков. днРНК обладают и другими чертами сходства с мРНК. Помимо короткой ОРС, транскрипции РНК-полимеразой II и 5'-концевого кепа, днРНК также могут состоять из нескольких экзонов,
поэтому возможен их сплайсинг с образованием нескольких изоформ с разными функциями. Около 60% генов днРНК млекопитающих транскрибируются с тех же участков, что и белок-кодирующие гены, но в противоположном им направлении, иногда с общего промотора, что обеспечивает их взаимную регуляцию. Установлено что нокаут днРНК может приводить к аномалиям развития и когнитивным нарушениям.
Многообразие функций днРНК определяется не только их структурной гетерогенностью и локализацией в разных субклеточных компартментах, но и способностью образовывать такие вторичные и третичные структуры, как петли и шпильки, что приводит к посттранскрипционным модификациям и обеспечивает взаимодействие днРНК с белками и хроматином. Часть днРНК функционирует самостоятельно как рибозимы или рибосвитчи (рис. 7). Однако в большинстве случаев они действуют вместе с белками, образуя рибонуклеопротеиновые (РНП) комплексы. Взаимодействие РНК с белками происходит с использованием нескольких основных механизмов. днРНК могут функционировать, как молекулярные каркасы, объединяющие белки в комплексы и инициирующие разные биологические процессы; как проводники, направляющие белки к местам их функционирования; или как ловушки, связывающие белки и препятствующие их присоединению к генам-мишеням. В случае образования хроматином петель днРНК могут действовать как транскрипционные энхансеры.
днРНК действуют как на уровне транскрипции, так и посттранскрипционно. На уровне
транскрипции днРНК привлекают факторы транскрипции или эпигенетические модификационные комплексы, действуя при этом in cis или in trans, в зависимости от расположения относительно сайта транскрипции генов-мишеней. Посттранскрипционно днРНК могут регулировать трансляцию мРНК, а также модулировать альтернативный сплайсинг и деградацию мРНК.
Находясь в ядре, днРНК может регулировать экспрессию генов, взаимодействуя с факторами транскрипции и направляя их на специфические участки генома. Благодаря вторичной структуре, днРНК взаимодействуют как с геномной ДНК, так и с факторами модификации хроматина. Таким образом, они способны связывать белки и предотвращать их взаимодействие с регуляторными элементами или, наоборот, доставлять их к ДНК и стабилизировать. Некоторые днРНК осуществляют непрямой контроль метилирования ДНК, рекрутируя ДНК-метилтрансферазы или другие белки, задействованные в процессах метилирования, к нужным участкам хромосомы.
Основные функции днРНК в цитоплазме ‒ контроль трансляции и стабилизация мРНК. Большая часть этих днРНК связана с полисомами. Кроме того, как в ядре, так и в цитоплазме днРНК не только выполняют свои основные функции, но и часто служат предшественниками коротких нкРНК, таких как miРНК и piwiРНК. И наоборот, днРНК может служить так называемой губкой для miРНК, если содержит комплементарные им последовательности, что позволяет связывать miРНК, препятствуя взаимодействию с геном-мишенью.
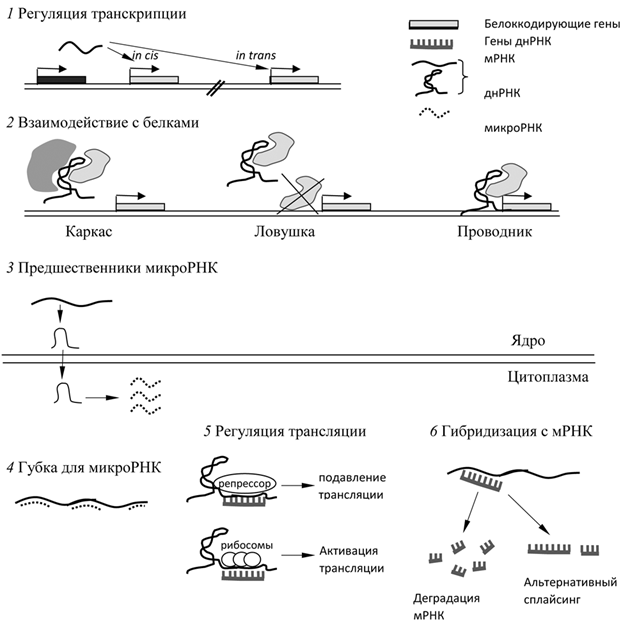
Рисунок 7. Функции и механизмы действия днРНК. Пояснения в тексте.
Около 70% генов человека могут подвергаться альтернативному сплайсингу, что вносит значительный вклад в разнообразие протеома и объясняет несоответствие между количеством генов (около 23341) и количеством белков человека (более 90000). Первичный транскрипт может иметь несколько районов альтернативного сплайсинга и в результате различных комбинаций ген может кодировать от десятков до сотен различных изоформ, которые обнаруживаются, как в норме, так и при различных вариантах патологии.
Необходимо упомянуть такое явление, как сплайсинг, индуцированный транскрипцией (transcription induced chimerism - TIC). Явление межгенного сплайсинга или химеризма, обусловленного транскрипцией, установлено достаточно недавно. Выделяют два вида сплайсинга: транс-сплайсинг подразумевает наличие двух различных молекул РНК генов, находящихся на разных хромосомах, цис-сплайсинг – результат слияния РНК двух близкорасположенных генов в одну объединенную молекулу мРНК (рис. 8).
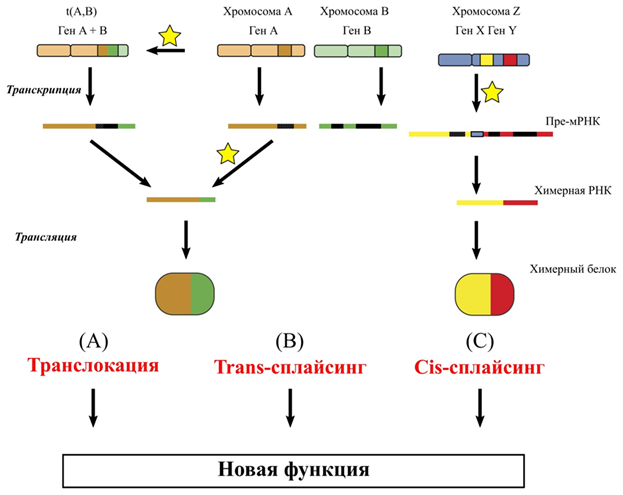
Рисунок 8. Межгенный сплайсинг, обусловленный транскрипцией.
Предполагают, что в образовании химер могут участвовать более 400 генов и их число будет стремительно увеличиваться: предполагается, что от 2 до 5% всех генов может быть вовлечено в процесс межгенного сплайсинга.
Было описано явление транс-сплайсинга на примере химерного транскрипта JAZF1/JJAZ1 в образцах нормальной ткани эндометрия. Эти химерные РНК и белок идентичны тем, что образуются в результате транслокации. Результаты молекулярно-генетического анализа свидетельствовали об отсутствии в образцах соответствующей транслокации t(7;17)(p15;q21), которая и приводит к появлению химерного онкогена JAZF1/JJAZ1 при стромальной саркоме эндометрия. Можно предполагать, что химера играет индуцирующую роль ростового фактора в нормальном развитии, а возникающая при патологии соответствующая транслокация вызывает необратимое изменение, приводящее к злокачественной трансформации.
Ответ на вопрос, что собой представляет обусловленный транскрипцией химеризм, остается пока неразрешенным. Предполагается, что TIC является физиологическим процессом, характерным для нормальных тканей, поддерживающим эволюционные механизмы или же это новый патологический механизм, лежащий в основе некоторых нервно-мышечных, гематологических или онкологических заболеваний, на который можно воздействовать антисмысловыми РНК. К настоящему моменту понятно, что TIC более широко распространен в геноме человека, чем предполагалось ранее и формирует дополнительный уровень белковой вариабельности.
Как и днРНК, миРНК могут регулировать альтернативный сплайсинг. Их возможное участие согласуется с данными о высокой консервативности последовательностей, примыкающих к альтернативным сайтам сплайсинга, у различных видов. Было показано, что расположение сайтов сплайсинга можно легко изменить, как в культуре клеток, так и in vivo, введением антисмысловых малых РНК, что оказалось многообещающим подходом к генотерапии миодистрофии и некоторых других наследственных болезней человека, вызванных мутациями сайтов сплайсинга. Предполагается, что малые РНК и в норме контролируют выбор сайтов сплайсинга.
Дата: 2019-12-10, просмотров: 443.