Хромосомный район 15(q11.2-q13) протяженностью ~7 млн. пар нуклеотидов, содержит кластер импринтированных генов (~5 млн. пар нуклеотидов) и неимпринтированную область. Критическая область занимает примерно половину района 15(q11.2-q13) и содержит пять белок-кодирующих гена (MKRN3/ZNF127, MAGEL2, NECDIN, NPAP1/C15orf2, SNURF-SNRPN), ряд генов, кодирующих нетранслируемые РНК (MKRN3-AS/ZNF127-AS, IPW, UBE3A-AS/SNHG14), а также кластер генов, кодирующих малые ядрышковые РНК (SNORD116 – 29 копий, SNORD115 – 48 копий, SNORD64, SNORD107, SNORD108, SNORD109A и SNORD109B). Все перечисленные локусы экспрессируются моноаллельно на хромосоме отцовского происхождения. Моноаллельная экспрессия на материнской хромосоме показана для двух генов - UBE3A и ATP10C, расположенных в дистальной части района 15(q11.2-q13) (рис. 10).
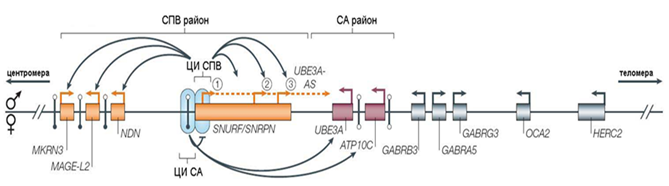
Рисунок 10. Схема функционирования центра импринтинга при синдроме Прадера–Вилли и Ангельмана: ЦИ СПВ и ЦИ СА — центры импринтинга соответствующих синдромов. Цифры в кружках: 1 — SNURF/SNRPN-транскрипт; 2 — IPW-транскрипт; 3 — snoРНК-транскрипты. Этот комплексный транскрипт подавляет экспрессию UBE3A и ATP10C на отцовской хромосоме.
Неимпринтированная область находится в дистальной части критического района и содержит несколько биаллельно функционирующих генов: локус OCA2/Р (отвечает за пигментацию кожи и глаз), гены GABRB3, GABRA5, GABRG3 (кодируют субъединицы рецептора γ-аминомасляной кислоты - ГАМК) и НЕRC2, а в проксимальной - NIPA 1, NIPA 2, CYFIP 1 и TUBGCP 5.
Существование генов, кодирующих нетранслируемую РНК, - общая характерная особенность всех известных импринтированных хромосомных доменов, в том числе и для района 15(q11.2-q13). Некоторые из транскриптов синтезируются на антисмысловой цепи соответствующих генов, что обозначено аббревиатурой AS (antisense). Например, на антисмысловой цепи белок-кодирующего гена MKRN3 в противоположном направлении транскрибируется нетранслируемая РНК (MKRN3-AS/SNHG14), причем и MKRN3, и MKRN3-AS активны на отцовской хромосоме. Антисмысловая РНК обнаружена также для гена UBE3A, но, в отличие от MKRN3-AS, транскрипция UBE3A и UBE3A-AS происходит на разных родительских хромосомах. UBE3A-AS экспрессируется на отцовской хромосоме лишь в тех тканях мозга, где UBE3A подвержен импринтингу и активен только на материнской хромосоме. В остальных тканях, где UBE3A экспрессируется биаллельно, UBE3A-AS транскрипт не обнаруживают.
Малые ядрышковые РНК (snoРНК), включая SNORD64, SNORD107, SNORD109A/В, SNORD116, и SNORD115, располагаются в области между SNRPN и UBE3A. Они относятся к классу С/D snoРНК. SNORD115 участвует в РНК- редактировании рецептора 5HTR2C, но функция других кластеров snoРНК практически не изучена. Так же мало известно о функции большинства днРНК-транскриптов в этом районе. Некоторые из них служат в качестве места расположения транскриптов кластеров snoРНК. snoРНК расположены в интронах «материнского» гена малых ядрышковых РНК 14 (SNHG14). У человека SNHG14 кодирует нетранслируемый транскрипт, экспрессирующийся с отцовской хромосомы особенно в мозге. Два недавно охарактеризованных транскрипта SPA1 и SPA2, днРНК, которая является мякРНК, но 5'- кэпируется и 3'- полиаденилируется, вовлечены в РНК- связывание белков и альтернативный сплайсинг мРНК.
Некодирующие и антисмысловые РНК часто являются продуктами импринтированных генов и участвуют в механизмах импринтинга, обеспечивая моноаллельную экспрессию некоторых генов. Антисмысловые РНК, благодаря образованию РНК-РНК-дуплексов, могут ингибировать трансляцию смысловых РНК, стабилизировать смысловую РНК-цепь, участвовать в процессах экспорта мРНК из ядра, а также обеспечивать механизмы сплайсинга.
Регулирование импринтинга в области 15(q11.2-q13) контролируется ЦИ, состоящим из двух элементов: центра импринтинга, контролирующего СА (ЦИ-СА) и центра импринтинга, контролирующего СПВ (ЦИ-СПВ). ЦИ-СА - область протяженностью 880 п.н., расположенная в 35 т.п.н. центромернее промотора SNURF-SNRPN. ЦИ-СА управляет транскрипцией вышерасположенных U-экзонов гена SNURF-SNRPN в материнских герминальных клетках для того, чтобы установить метилирование (импринт) в ЦИ-СПВ, который расположен в районе промотора и первого экзона этого гена. Этот район метилирован на материнском аллеле и неметилирован на отцовском. Метилирование ЦИ-СПВ/ЦИ-СА играет важную роль либо в инактивации, либо в активации экспрессии малого ядерного рибонуклеопротеина N (SNRPN) и соседних snoРНК на одном и том же аллеле. SNRPN кодирует белок, необходимый для образования сплайсосом, которые отвечают за альтернативный сплайсинг различных мРНК.
Наименьшие области перекрывания всех делеций ЦИ при СА и СПВ не совпадают. Минимальный район перекрывания всех делеций ЦИ при СА имеет длину 1,15 тыс. пар нуклеотидов. U -экзоны кодируют нетранслируемую РНК, их метилирование показано на обеих родительских хромосомах. При СПВ обнаруживают микроделеции второго (дистального) компонента ЦИ (ЦИ-СПВ), Наименьший район перекрывания микроделеций ЦИ при СПВ составляет 4,3 тыс. пар нуклеотидов.
Неметилированный отцовский аллель управляет экспрессией полицистронного транскрипта, который включает пару SNURF-SNRPN, некодирующий транскрипт IPW и кластеры мякРНК в дистальной части района. В нейронах транскрипция продолжается дальше, чтобы получить днРНК UBE3A-AS, которая, необходима для инактивации UBE3A отцовского аллеля. Проксимальная часть кластера содержит нескольких генов, не содержащих интроны и экспрессирующихся на отцовской хромосоме, включая гены MKRN3 и NDN. Эти два гена имеют дифференциально метилированные CpG-островки в своих промоторах, которые, как и ЦИ-СПВ, не метилированы на отцовской хромосоме, но метилированы на материнской. Мутации или эпимутации (нарушение паттерна метилирования ДНК) ЦИ-СПВ приводят к нарушению профиля метилирования ДМР NDN и MKRN3, и отсутствию аллельной экспрессии всего импринтированного района, что свидетельствует о том, что ЦИ-СПВ является основным регулятором импринтинга этого района в соматических тканях.
Исключение из этого правила наблюдалось у двух пациентов с СПВ с необычным более мягким фенотипом. Эти пациенты имели материнскую ОРД с метилированием обоих аллелей ЦИ-СПВ, но экспрессией импринтированных генов, включая MKRN3, которые обычно инактивированных при СПВ. Это позволяет предположить, что некоторое ослабление регуляции импринтинга, контролируемое ЦИ-СПВ, может происходить в импринтированном районе, по крайней мере, в контексте указанной патологии.
Непосредственный объект регуляции для ЦИ - лишь те гены, которые в норме активны на отцовской хромосоме, в том числе и локус, кодирующий антисмысловой нетранслируемый транскрипт UBE3A-AS/SNHG14, регулирующий экспрессию UBE3A на материнской хромосоме. Согласно этой модели, прямое назначение ЦИ-СПВ - установление в гаметогенезе и поддержание в соматических тканях активной транскрипции генов на отцовской хромосоме (см. рис. 10). В случае наследования делеции ЦИ-СПВ от отца возникает фенотип СПВ и происходит биаллельная экспрессия UBE3A как следствие инактивации UBE3A-AS на отцовской хромосоме. В соответствии с этой схемой, роль ЦИ-СА сводится к отмене функции ЦИ-СПВ в овогенезе и сдерживанию тех процессов, которые реализуются под контролем последнего в сперматогенезе. Именно поэтому в результате делеции ЦИ-СА становится невозможной инактивация отцовских генов на материнской хромосоме (в том числе UBE3A-AS), а значит, и активация гена UBE3A. При наследовании такой делеции от матери возникают биаллельная экспрессия отцовских генов и «молчание» гена UBE3A.
Благодаря этой модели становится понятным тот факт, что делеции ЦИ при СА никогда не распространяются на область ЦИ-СПВ, но в то же время делеции ЦИ у некоторых пациентов с СПВ перекрывают район ЦИ-СА. Незаконная активация отцовских генов на материнской хромосоме в результате делеции ЦИ-СА возможна только при условии сохранности ЦИ-СПВ. Таким образом, ЦИ имеет две основных функции: 1) переключение в гаметогенезе женского импринта на мужской или наоборот; 2) поддержание экспрессии или инактивации импринтированных генов критического района в течение жизни.
Ген UBE3A состоит из 16 экзонов и кодирует фермент E6-AP убиквитинпротеинлигазу. Биаллельная экспрессия осуществляется во всех тканях, только в ряде структур мозга UBE3A активен лишь на материнской хромосоме. У мышей моноаллельная экспрессия гена Ube3a была показана в клетках Пуркинье коры мозжечка, нейронах гиппокампа и обонятельной луковицы. В остальных отделах мозга и других органах установлен биаллельный характер экспрессии. Дефицит материнской копии гена в клетках Пуркинье может объяснить атаксию и тремор, возникающие у пациентов с СА, а эпилептические припадки и невозможность обучения таких больных могут быть связаны с отсутствием экспрессии этого гена в нейронах гиппокампа.
Белок E6-AP входит в состав мультиферментного комплекса, обеспечивающего присоединение к цитоплазматическим белкам молекулы небольшого белка убиквитина, состоящего из 76 аминокислот. После этого они становятся мишенями для деградации в протеосомаx. Этот белок также служит транскрипционным ко-активатором для рецепторов стероидных гормонов, т.е. функционирует одновременно в качестве убиквитинлигазы и транскрипционного фактора. Обе эти активности независимы друг от друга, поскольку регуляцию транскрипции опосредует N-концевой домен, а убиквитинирование сопряжено с C-концевой частью белка.
В 3’-нетранслируемом районе UBE3A обнаружен промоторный район другого гена, имеющего транскрипт длиной 3,5 т.п.н. Этот транскрипт экспрессируется с материнского аллеля в мозге, но мутации в нем не обнаружены. Кроме того, в этом же районе локализован антисмысловой транскрипт, включающий полностью смысловой транскрипт длиной 3,5 тыс. пар нуклеотидов и почти половину UBE3A - UBE3A- AS экспрессируется в мозге с отцовского аллеля.
В результате исследования методом прямого секвенирования пациентов с клиническим диагнозом СА, у которых зарегистрирован нормальный статус метилирования локусов критического района, мутации были обнаружены в 75% семейных и 23% спорадических случаев заболевания. Во всех информативных семьях, где были обнаружены мутации, фенотип СА отмечен только в случае наследования мутации от матери. Мутации гена UBE3A на отцовской хромосоме фенотипически не проявляются. Преобладают мутации со сдвигом рамки считывания и нонсенс-мутации. Миссенс-мутации, по-видимому, существенно не нарушают функцию белкового продукта, и фенотип у таких пациентов отличается от характерного для СА. Отсутствие молекулярного дефекта у части пациентов можно объяснить неточностью клинического диагноза в связи с вариабельностью фенотипических признаков и несовершенством диагностических критериев заболевания.
В 200 т.п.н. дистальнее гена UBE3A расположен ген, кодирующий аминофосфолипидтранспортирующую АТФазу - ATP10C. Установлено, что он экспрессируется преимущественно с материнского аллеля в фибробластах и различных структурах мозга. Его функция состоит в поддержании контактов между клеточными мембранами и передаче сигналов в ЦНС. Вполне вероятно, что отсутствие экспрессии гена в мозге при СА может приводить к более тяжелым симптомам, связанным с тяжелым аутизмом у больных.
Патогенез эпилептических припадков при СА связывают с кластером ГАМК-рецепторных генов, которые располагаются между геном UBE3A и локусом OCA2 и поэтому попадают в область частых делеций. Один из этих генов - GABRB3 - кодирует β3-субъединицу ГАМК-рецептора. У экспериментальных мышей, несущих гомозиготную делецию гена Gabrb3, отмечают нарушения памяти, неспособность к обучению, судорожные припадки и моторные нарушения, сходные с симптомами СА. Животные, гетерозиготные по этой делеции, имеют менее выраженные неврологические расстройства. Следовательно, клинические симптомы СА в случае протяженной делеции, по крайней мере, частично, могут быть обусловлены гаплонедостаточностью гена GABRB3.
В область делеций при СА и СПВ также попадает ген OCA2, который функционирует биаллельно и располагается в дистальной части критического района. Потеря обоих аллелей этого гена у человека и мыши приводит к альбинизму, а у гетерозигот по мутациям отмечают незначительное снижение пигментации. Действительно, гипопигментация кожи при СПВ и СА возникает только в случае протяженных делеций критического района, но отсутствует у пациентов с ОРД, мутациями ЦИ и точковыми мутациями в гене UBE3A.
СПВ сопровождается потерей функции генов критического района 15(q11.2-q13), которые в норме экспрессируются только на хромосоме отцовского происхождения. Точковых мутаций, приводящих к СПВ, ни в одном из этих генов обнаружено не было. На моделях животных показано, что отсутствие любого из этих генов может приводить к определенным аномалиям, но фенотипически не соответствующим СПВ. Поэтому СПВ можно охарактеризовать как синдром последовательности импринтированных генов, имеющих отцовскую экспрессию, а сам критический район - как комплекс импринтинга.
Однако, с применением новых геномных технологий молекулярной диагностики, секвенирования всего экзома, удалось выявить редкие и тонкие генетические дефекты хромосомы 15(q11.1-q13) у ряда пациентов с диагнозом СПВ. В частности, были выявлены микроделеции, порядка 400 т.п.н., кластера SNORD 116 (рис.11).
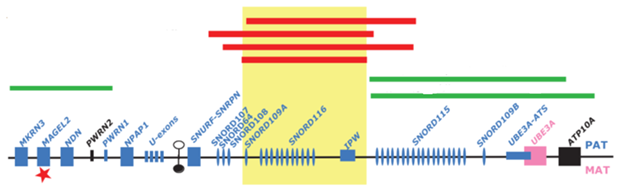
Рисунок 11. Схема импринтированного района 15(q11.1-q13). Желтым прямоугольником обозначен наименьший район перекрывания всех выявленных микроделеций (обозначены красным цветом), которые сопровождаются классическим фенотипом СПВ. Зеленым цветом обозначены делеции, которые не сопровождаются классическим фенотипом. Красной звездочкой обозначены мутации MAGEL2. Голубым цветом обозначены последовательности, которые экспрессируются с отцовской хромосомы, розовым – с материнской; темный и светлый овалы – метилированный ЦИ-СА и неметилированный ЦИ-СПВ.
Делетированный район включал транскрипт «материнской» днРНК - SNHG14, который перекрывался с транскриптами IPW, SPA 1 и SPA 2. Наименьшая выявленная микроделеция была ограничена кластером SNORD 116 и его транскриптом днРНК, частью IPW и транскриптом SPA 2. Эти микроделеции показывают, что область между SNRPN и UBE 3 A, в частности кластер SNORD 116, могут иметь решающее значение в формировании ключевых фенотипических проявлений СПВ. Поскольку этот импринтированный район имеет большую гомологию с мышиным, было создано несколько моделей с делецией SNORD116. Мыши с делецией имитируют фенотипические признаки, характерные для СПВ, такие как, проблемы с моторным обучением, плохая память, гиперфагия, задержка роста и повышенная тревожность.
Однако, это не исключает, что нарушение SPA 2 и IPW, а также «материнского» транскрипта SNORD 116 также может играть роль, поскольку было показано, что днРНК SPA 2 и IPW участвуют в регуляции других генов. В частности, днРНК IPW регулирует импринтированную область DLK1-DIO3 и экспрессию импринтированного гена MEG3 на хромосоме 14. Некоторые клинические особенности СПВ могут быть вызваны аномальной экспрессией материнских аллелей генов в области DLK1-DIO3.
Дата: 2019-12-10, просмотров: 465.